
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Задачи для самостоятельного решения
1. Реакция идет по уравнению 2СО(г) + О2(г) → 2СО2 (г). Как изменится скорость этой реакции, если:
а) увеличить давление в 3 раза;
б) увеличить концентрацию кислорода в два раза?
2. В системе Са(НСО3)2(ж) СаСО3(кр) + СО2(г) + Н2О(ж) установилось равновесие. Как изменится скорость обратной реакции при уменьшении давления в 2 раза? В сторону какой реакции – прямой или обратной – сместится равновесие:
а) при удалении из системы углекислого газа;
б) при повышении температуры (прямая реакция эндотермическая)?
3.
Скорость реакции 2NO(г)
+ O2(г)
→ 2NO2(г)
при
концентрациях
сNO
= 0,3 моль/л,
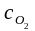 =
0,15 моль/л равна 1,3·10-3
моль/л·с.
Вычислите константу скорости реакции.
Поясните, в чем ее физический смысл.
Укажите факторы, от которых она зависит.
=
0,15 моль/л равна 1,3·10-3
моль/л·с.
Вычислите константу скорости реакции.
Поясните, в чем ее физический смысл.
Укажите факторы, от которых она зависит.
4. Определите температурный коэффициент скорости реакции γ, если при охлаждении от 80 оС до 40 оС скорость реакции уменьшилась в 16 раз. Что показывает температурный коэффициент скорости реакции? Дайте определение понятию «энергия активации».
5. В системе CaCO3 (кр) CaO(кр) + CO2(г) установилось равновесие. В сторону какой реакции – прямой или обратной – оно сместится при удалении из системы CO2 и при увеличении температуры? Реакция разложения CaСO3 эндотермическая.
6. Произойдет ли смещение равновесия в системах:
Fe2O3(кр) + 3H2(г) 2Fe (кр) + 3H2O (г),
CaCO3 (кр) CaO(кр) + CO2 (г)
при изменении давления? Ответ поясните. Сформулируйте принцип смещение равновесия Ле Шателье.
7. Как нужно изменить концентрации реагирующих веществ, давление и температуру, чтобы равновесие в системе
4NH3 (г) + 5O2 (г) 4NO(г) + 6H2O(г)
сместилось в сторону образования аммиака? Прямая реакция экзотермическая.
Примерный вариант самостоятельной работы 1. Реакция идет по уравнению 2СО(г) + О2(г) → 2СО2 (г). Как изменится скорость этой реакции, если: а) увеличить давление в 3 раза; б) увеличить концентрацию кислорода в два раза? Запишите кинетические уравнения прямого и обратного процесса и подтвердите ответ расчётом. 2. Пользуясь табличными данными, рассчитайте изменение энергии Гиббса (ΔG0) реакции 4NH3 (г) + 5O2 (г) 4NO(г) + 6H2O(г), происходящей в стандартных изобарно-изотермических условиях. Решите вопрос о возможности самопроизвольного её протекания в открытой системе. 3. Определите температурный коэффициент, если образец цинка растворяется в серной кислоте при 25 оС за 16 минут, а при 45 оС за 4 минуты. 4. В системе SiO2(кр) + 2C (кр) Si(кр) + 2CO2(г) установилось равновесие. В какую сторону сместится равновесие системы при удалении из системы оксида углерода (IV) и повышении температуры? Прямая реакция эндотермическая. |
Вопросы для семинарского занятия
1. Основные термодинамические понятия: система, гомогенная и гетерогенная система, изолированная закрытая система, система открытая, параметры состояния системы, термодинамические функции. Внутренняя энергия и энтальпия. Тепловой эффект реакции. Эндотермические и экзотермические процессы. Закон Гесса и следствия, вытекающие из него. Стандартная энтальпия образования сложного вещества. Термохимические уравнения. Энтропия и изобарно-изотермический потенциал. Направленность химических процессов. I, II начала термодинамики.
2. Химическая кинетика. Скорость химических реакций. Энергия активации. Уравнение Аррениуса. Зависимость скорости реакции от концентрации реагирующих веществ и давления. Закон действия масс. Кинетические уравнения. Константа скорости реакции.
3. Влияние температуры на скорость химической реакции, правило Вант-Гоффа, температурный коэффициент. Влияние катализатора на скорость реакции. Сущность катализа.
4. Процессы обратимые и необратимые. Химическое равновесие. Константа химического равновесия. Принцип Ле-Шателье. Влияние температуры, концентрации, давления и катализатора на смещение равновесия.
