
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Стандартные электродные потенциалы в водных растворах при 298 к
№ п/п |
Электродная реакция |
Е0, В |
№ п/п |
Электродная реакция |
Е0, В |
1 |
Li+ + e− → Li0 |
- 3,05 |
15 |
Sn+2 + 2e− → Sn0 |
- 0,14 |
2 |
К+ + е− → К0 |
- 2,93 |
16 |
Pb2+ + 2е− → Pb0 |
- 0,13 |
3 |
Са2+ + 2е− → Са0 |
- 2,87 |
17* |
2H+ + 2e− → H20 |
0 |
4 |
Na+ + e− → Na0 |
- 2,71 |
18 |
Bi3+ + 3e− → Bi0 |
+ 0,22 |
5 |
Mg2+ + 2e− → Mg0 |
- 2,36 |
19 |
Cu2+ + 2е− → Cu0 |
+ 0,34 |
6 |
Al3+ + 3e− → Al0 |
- 1,66 |
20 |
Ag+ + e− → Ag0 |
+ 0,80 |
7 |
Ti2+ + 2e− → Ti0 |
- 1,63 |
21 |
S0 + 2e− → S2− |
- 0,45 |
8 |
Mn2+ + e− → Mn0 |
- 1,18 |
22** |
O20+ 2H2O + 4e−→ 4OH- |
+ 0,40 |
9 |
Zn2+ + 2e− → Zn0 |
- 0,76 |
23 |
J2 + 2е− → 2J− |
+ 0,54 |
10 |
Cr3+ + 3e− → Cr0 |
- 0,74 |
24 |
Br02 + 2e → 2Br− |
+ 1,06 |
11 |
Fe2+ + 2e− → Fe0 |
- 0,44 |
25 |
O20 + 4H+ + 4e− → 2H2O |
+ 1,23 |
12 |
Cd2+ + 2e− → Cd0 |
- 0,40 |
26 |
Cl20 + 2e− → 2Cl− |
+ 1,36 |
13 |
Co2+ + 2e− → Co0 |
- 0,28 |
27 |
S2O82− + 2e → 2SO42− |
+ 2,01 |
14 |
Ni2+ + 2e− → Ni0 |
- 0,25 |
28 |
F02 + 2e− → 2F− |
+ 2,87 |
*,
** В нейтральной среде (рН 7)
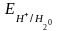 =
– 0,41 В,
=
– 0,41 В,
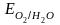 =
+ 0,82 В.
=
+ 0,82 В.
Гальванический элемент – это устройство, в котором энергия самопроизвольных окислительно-восстановительных процессов превращается в электрическую. В простейшем случае гальванический элемент состоит из двух пластин, изготовленных из разных металлов, которые погружены в растворы собственных солей – электролиты. Металл (электронный проводник), находящийся в растворе соли (ионный проводник), называется электродом. Электроды соединены между собой металлическим проводником, а растворы солей – электролитическим (солевым) мостиком. Процесс окисления (отдача электронов) протекает на аноде и называется анодным. Процесс восстановления (присоединение электронов) – на катоде, называется катодным. Анодом всегда является металл с более отрицательным электродным потенциалом, то есть более активный. Анод – это отрицательный полюс элемента, катод – положительный.
При работе гальванического элемента электроны движутся по внешней цепи от анода к катоду, а ионы – внутри элемента по электролитическому мостику. В результате возникает электрический ток, поэтому протекающая суммарная химическая реакция называется токообразующей.
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется
электродвижущей
силой (ЭДС)
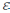 элемента:
элемента:
= Екатода – Еанода. (5.2)
