
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Решение типовых задач
Задача 1. Кобальтовые пластины погружены: одна в раствор сульфата цинка, другая – сульфата меди. В каком случае будет происходить реакция? Ответ обоснуйте, напишите молекулярные и электронные уравнения соответствующих реакций.
Решение. Запишем стандартные электродные потенциалы (табл. 5.1)
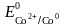 =
– 0,28 В,
=
– 0,28 В,
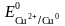 =
+ 0,34 В,
=
+ 0,34 В,
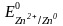 =
– 0,76 В,
=
– 0,76 В,
и рассмотрим поочередно каждый из предложенных вариантов:
а) реакция Со + ZnSО4 не идет, так как стандартный электродный потенциал Со более положительный, чем Zn, следовательно, Со менее активен и не способен восстановить Zn2+;
б) реакция Со + CuSO4 идет, так как кобальт активней меди ( более отрицателен, чем ) и может вытеснить ее ионы из раствора соли:
Со + CuSO4 → СоSO4 + Cu.
Электронные уравнения:
Со0 – 2е− → Со2+ (процесс окисления),
Cu2+ + 2е− → Cu0 (процесс восстановления).
Задача 2. Гальванический элемент состоит из хромового и оловянного электродов в растворах их нитратов. Составьте схему гальванического элемента, напишите уравнения электродных процессов и токообразующей реакции. Вычислите ЭДС:
а)
при стандартных условиях ( =
=
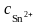 =
1 моль/л);
=
1 моль/л);
б) при концентрациях = = 0,01 моль/л.
Решение. При схематической записи гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой. Анод записывается слева.
Сравним
стандартные электродные потенциалы
металлов:
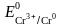 =
– 0,74 В,
=
– 0,74 В,
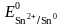 =
– 0,14 В. Хром,
как более активный металл, является
анодом, а олово – катодом.
=
– 0,14 В. Хром,
как более активный металл, является
анодом, а олово – катодом.
Запишем схему гальванического элемента:
(-) Cr | Cr(NO3)3 ║ Sn(NO3)2 | Sn (+)
или (-) Cr | Cr 3+ ║ Sn2+ | Sn (+);
электродные процессы:
а нодный:
Cr
0 – 3е−
→ Cr3+
(процесс окисления), х
2
нодный:
Cr
0 – 3е−
→ Cr3+
(процесс окисления), х
2
катодный: Sn2+ + 2е− → Sn0 (процесс восстановления); х 3
уравнение токообразующей реакции:
2Cr 0 + 3Sn2+ → 2Cr3+ + 3Sn0.
Вычислим электродвижущую силу (ЭДС):
а)
стандартную ЭДС 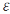 0,
то есть ЭДС элемента при стандартных
условиях, когда концентрации ионов
металла равны 1 моль/л, рассчитаем по
уравнению (5.2):
0,
то есть ЭДС элемента при стандартных
условиях, когда концентрации ионов
металла равны 1 моль/л, рассчитаем по
уравнению (5.2):
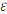
 0
= Е0катода
– Е0анода
=
–
,
0
= Е0катода
– Е0анода
=
–
,
0 = – 0,14 – (– 0,74) = 0,60 В;
б) в условиях отличных от стандартных сначала рассчитаем по уравнению Нернста (5.1) отдельные электродные потенциалы металлов:
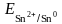 =
+
=
+
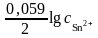 ,
,
=
– 0,14 +
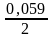 lg10−2
= – 0,14 +
∙
(–2) = – 0,20 В;
lg10−2
= – 0,14 +
∙
(–2) = – 0,20 В;
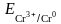 =
+
=
+
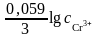 ,
,
=
– 0,74 +
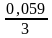 lg10−2
= – 0,74 +
∙
(–2) = – 0,78 В,
lg10−2
= – 0,74 +
∙
(–2) = – 0,78 В,
а затем по формуле (5.2) вычислим ЭДС, учитывая, что олово осталось катодом, а цинк – анодом:
= – ,
= – 0,20 – (– 0,78) = 0,58 В.
5.2. Электролиз Содержание материала для самостоятельного изучения
Сущность электролиза. Последовательность разряда ионов при электролизе. Анодное окисление и катодное восстановление. Электролиз с растворимым и нерастворимым анодом. Законы Фарадея. Применение электролиза.
Литература: [1 – гл. 9, §§ 9.5 – 9.7]; [2 – гл. ІХ, §§ 101 – 103].
