
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Решение типовых задач
Задача 1. В какой последовательности восстанавливаются катионы при электролизе смеси водных растворов сульфатов лития, магния, меди? Ответ обоснуйте.
Решение. В растворе имеются катионы Li+, Mg2+, Cu2+, образовавшиеся в результате диссоциации солей, и молекулы H2O .
На катоде, прежде всего, разряжаются катионы, процесс восстановления которых характеризуется наиболее положительным электродным потенциалом. Стандартные электродные потенциалы (табл. 5.1)
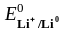 =
– 3,04
В,
=
– 3,04
В,
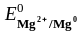 =
– 2,36
В,
=
– 2,36
В,
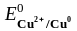 =
+ 0,34
В,
=
+ 0,34
В,
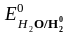 =
– 0,41В.
=
– 0,41В.
Таким образом, первым восстанавливается Cu2+, затем H+. Ионы Li+ и Mg2+ из водных растворов не восстанавливаются, т.к. их потенциалы значительно отрицательнее электродного потенциала водородного электрода в нейтральной среде (табл. 5.1).
Задача 2. Составьте уравнения реакций, протекающих на электродах, при электролизе водного раствора сульфата лития в случае инертного анода и анода из меди.
Решение. Анод инертный:
Li2SO4 → 2Li+ + SO42-
H2O
Катод (–) Анод (+)
Li+
(
=
– 3,04
В)
H2O
(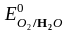 =
+ 0,82 В)
=
+ 0,82 В)
H2O
(
=
– 0,41В)
SO42–
(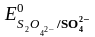 =
+ 2,01 В)
=
+ 2,01 В)
На катоде: 2Н2О + 2e – → H2 + 2OH‾ , так как этот процесс характери- зуется наименее отрицательным
потенциалом;
На аноде: 2H2O → O2 + 4H+ + 4e– , так как потенциал данного процесса
имеет наименее положительное
значение.
Анод активный (медный анод):
На катоде происходит тот же процесс, что и в первом случае:
2H2O + 2e – → H2+ 2OH–.
На аноде возможно окисление H2O, SO42‾ и Cu0. Но так как потенциал окисления меди ( = + 0,34 B) более отрицателен (менее положителен), чем остальные, то реально идет окисление медного анода:
Cu0 → Cu2+ + 2e –.
Задача 3. Сколько граммов меди выделилось на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4 А?
Решение. Согласно объединенному закону Фарадея (5.3)
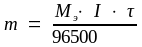 ,
,
где m – масса вещества, выделившегося при электролизе на электроде;
I – сила тока, А;
τ – продолжительность электролиза, с;
Mэ – молярная масса эквивалента вещества, моль/л.
Молярная масса эквивалента меди равна молярной массе меди, деленной на число электронов, участвующих в процессе восстановления:
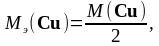
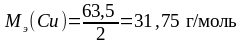 ,
,
I = 4 A, τ = 1∙ 60 ∙ 60 = 3600 с. Подставив значение в формулу, получаем
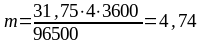 г.
г.
Масса выделившейся меди равна 4,74 г.
5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
Классификация коррозионных процессов. Химическая и электрохимическая коррозия. Скорость коррозионных процессов и факторы, влияющие на неё. Методы защиты от коррозии: легирование, электрохимические методы, защитные покрытия, изменение свойств коррозионной среды. Ингибиторы коррозии.
Литература: [1 – гл. 10, §§ 10.1 – 10.4]; [2 – гл. ХVІ, § 196].
