
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Молекулы пав обозначают следующим символом:
 полярная
часть
полярная
часть
неполярная часть
ПАВ располагаются на межфазной поверхности следующим образом: полярная часть молекулы ПАВ при адсорбции обращена к полярной фазе, а неполярная – к неполярной:
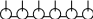
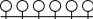 вода
углеводороды
воздух
вода
углеводороды
воздух
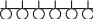
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / /
уголь глина вода
Особую роль в ГДС отводят коллоидным растворам (размер частиц дисперсной фазы 10–9 ≤ а ≤ 10–7 м), которые называются золями. Коллоидные системы можно получить двумя противоположными методами – диспергированием (дроблением вещества до размера коллоидных частиц) и конденсацией (переходом молекулярных и ионных растворов в коллоидные), например проведением реакций обмена, сопровождающихся получением труднорастворимых веществ.
Различают кинетическую и агрегативную устойчивость коллоидных систем. Кинетическая устойчивость обусловлена малым размером коллоидных частиц, находящихся в броуновском движении.
Под агрегативной устойчивостью понимают сохранение системой присущей степени дисперсности. Основными факторами агрегативной устойчивости являются одноименный электрический заряд коллоидных частиц и структурно-механический барьер, обусловленный защитными свойствами адсорбционных слоев, их гидратацией.
При снятии стабилизующего барьера происходит потеря агрегативной устойчивости, которая приводит к укрупнению частиц, их слипанию. Этот процесс называется коагуляцией. Коагуляция вызывает нарушение кинетической устойчивости и расслоение системы на две сплошные фазы. Явная коагуляция называется седиментацией – оседание частиц под действием силы тяжести.
Коагуляция может быть вызвана различными факторами, наиболее важным из них является действие электролита. Минимальная концентрация электролита, вызывающая коагуляцию, называется порогом коагуляции (ПК).
Решение типовых задач
Задача 1. Золь AgI получен в результате реакции взаимодействия нитрата серебра с избытком йодида калия. Определите заряд частиц образовавшегося золя, и напишите формулу его мицеллы.
Решение. При смешивании растворов AgNO3 и KI происходит реакция:
AgNO3 + KI → AgI + K NO3,
избыток нерастворимое
соединение
Ag+ + NO3– + K+ + I– → AgI + K+ + NO3–
На поверхности агрегата лиофобной мицеллы адсорбируются преимущественно те ионы, которые имеют с ним общие химические элементы (правило Фаянса), или образуют труднорастворимое соединение с ионами. В растворе имеется избыток KI, следовательно, образовавшиеся агрегаты m(AgI) адсорбируют на своей поверхности потенциалопределяющие ионы I –, которые определяют отрицательный заряд коллоидных частиц золя. Противоионами являются ионы K+. Формула мицеллы золя иодида серебра при условии избытка KI:
|– агрегат –|
{[ m (AgI) nI – (n-x) K+]х – x K+}0,
|_____ядро____| адсорбционный диффузный
слой слой
|____коллоидная частица_______|
{ ____________ мицелла _______ }
где n – количество потенциалопределяющих ионов;
(n-x) – количество противоионов адсорбционной части двойного электрического слоя;
x – количество противоионов диффузной части двойного электрического слоя.
Если в растворе будет избыток AgNO3, то потенциалопределяющими будут ионы Ag+, которые определят положительный заряд коллоидной частицы йодида серебра; противоионами – ионы NO3–. Формула мицеллы золя йодида серебра при условии избытка AgNO3 может быть представлена как:
{[m (AgI) nАg+ (n-x) NO3– ] х+ x NO3–} 0.
Задача 2. Определите заряд коллоидных частиц кремниевой кислоты, если он обусловлен диссоциацией поверхностного слоя частиц. Напишите формулу мицеллы кремниевой кислоты и изобразите схему строения мицеллы.
Решение. Под действием полярных молекул воды происходит диссоциация молекул кремниевой кислоты поверхностного слоя агрегата, и частицы золя приобретают отрицательный заряд. Противоионами являются ионы Н+.
H2SiO3 Н++ HSiO3–.
Формула мицеллы кремниевой кислоты –
{[m(H2SiO3) nHSiO3–(n-x)H+]х–xH+ }.
Задача 3. Положительно заряженный золь Fe(OH)3 получен в результате полного гидролиза хлорида железа (III). Какой из предложенных электролитов-коагулянтов – NaCl, Na2SO4, Na3PO4 – более эффективен при коагуляции золя? Напишите формулу мицеллы, укажите ее составные части.
Решение. Полный гидролиз хлорида железа (III) можно представить молекулярным и ионно-молекулярным уравнениями:
FeCl3 +3H2O → Fe(OH)3+3HCl
Fe+3 + 3Cl – + 3H2O → Fe(OH)3+3H+ + 3Cl –.
Ядро мицеллы Fe(OH)3 составляет агрегат m(Fe(OH)3) с адсорбированными им ионами Fe3+. Противоионами являются ионы Сl –.
Формула мицеллы:
|– агрегат –|
{[m(Fe(OH)3) nFe3+ 3(n - x) Cl –]3+ 3x Cl –}0.
|______ядро_____| адсорбционный диффузный
слой слой
|______коллоидная частица_________|
{ _________________________мицелла ______________}
Коагулирующий ион имеет знак заряда, противоположный знаку заряда коллоидной частицы, и чем он больше, тем сильнее его коагулирующее действие (правило Шульце−Гарди), а, следовательно, меньше порог коагуляции (ПК). Поскольку золь Fe(OH)3 заряжен положительно, то коагулирующими ионами являются Cl –, SO42–, PO43–.
ПК обратно пропорционален шестой степени заряда коагулирующего иона: СIК: СIIК: СIIIК = 1: (1/26) : (1/36) = 1: 0,016 : 0,0014,
где СIК, СIIК, СIIIК− порог коагуляции одно-, двух-, трехзарядных ионов.
Наиболее эффективен при коагуляции, таким образом, фосфат натрия, и его порог коагуляции самый низкий.
