
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Основные теоретические положения
Дисперсная система (ДС) – это система, состоящая из двух или более веществ, одно из которых равномерно распределено в другом.
Специфическими особенностями дисперсных систем являются гетерогенность и дисперсность. Гетерогенность означает, что система состоит, как минимум, из двух фаз. Сплошная фаза, в которой равномерно распределено раздробленное вещество, называется дисперсионной средой, а раздробленное вещество (одно или несколько) – дисперсной фазой.
Под дисперсностью понимают величину, обратную среднему размеру частиц дисперсной фазы:
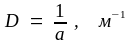 ,
,
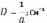 (4.20)
(4.20)
где а – средний размер частиц, м.
Классифицируют ДС по степени дисперсности, по агрегатному состо-янию дисперсной фазы и дисперсионной среды, по характеру взаимодействия частиц фазы между собой, по характеру взаимодействия частиц фазы и среды.
Классификация дисперсных систем по данному признаку представлена в табл. 5.1.
Таблица 4.5
Классификация дисперсных систем по размеру частиц дисперсной фазы
Средний диаметр частиц , м |
10-4 |
10-5...10-6 |
10-7...10-9 |
≤10-9 |
|
Классификация дисперсных систем |
грубо-дисперсные |
тонко-дисперсные |
коллоидные |
истинные растворы |
|
Примеры |
взвеси |
суспензии, эмульсии |
золи, гели. наносистемы |
водные растворы электролитов и неэлектролитов |
|
|
гетерогенные |
гомогенные |
|||
Гетерогенные дисперсные системы (ГДС) имеют размер частиц дисперсной фазы 10 –4…10 –9 м. Для получения ГДС частицы, имеющие больший размер (макротела) подвергают измельчению; атомы, молекулы и ионы соединяют (конденсируют) в более крупные агрегаты.
По характеру взаимодействия частиц дисперсной фазы между собой ГДС делятся на свободнодисперсные (золи), в которых такое взаимодействие мало и связанодисперсныех (гели), в которых частицы дисперсной фазы с участием дисперсионной среды связаны между собой силами межмолекулярного взаимодействия.
По степени молекулярного взаимодействия дисперсной фазы и дисперсионной среды дисперсные системы подразделяют на лиофильные и лиофобные. Лиофильный: в переводе с греческого означает «любящий растворение»; лиофобный – «боящийся растворения».
В лиофильных системах частицы дисперсной фазы взаимодействуют с молекулами дисперсионной среды, образуя сольватные оболочки. Если средой является вода, то говорят соответственно о гидрофильности, гидрофобности и гидратных оболочках.
В лиофобных системах частицы фазы фактически «выталкиваются» из дисперсионной среды.
Примеры дисперсных систем представлены в табл. 4.6.
Таблица 4.6
Классификация дисперсных систем по агрегатному состоянию
дисперсной фазы и дисперсионной среды
Фаза Среда |
газ
|
жидкость |
твёрдая |
газ |
воздух |
туман, пар |
пыль, дым |
жидкость
|
пена |
эмульсия (молоко, водоэмульсионные краски) |
суспензия, коллоидные системы |
твёрдая |
газосиликат |
минералы |
сплавы |
Характерным свойством гетерогенной дисперсной системы (ГДС) является наличие большой межфазной поверхности. В связи с этим определяющими являются свойства поверхности, а не частиц в целом.
В отличие от термодинамически устойчивых истинных растворов (молекулярных и ионных), гетерогенные дисперсные системы (двух- и более фазные) принципиально неустойчивы, однако некоторые из них длительное время могут сохранять устойчивость и не разрушаться.
На границе раздела фаз частицы обладают избыточной свободной энергией. Свободная поверхностная энергия Gs определяется суммарной поверхностью частиц дисперсной фазы S и величиной поверхностного натяжения σ:
Gs = σ ∙ S. (4.21)
Поверхностное натяжение – работа, затраченная на образование единицы поверхности раздела фаз или избыток свободной поверхностной энергии, приходящейся на единицу поверхности. Поверхностное натяжение зависит от природы взаимодействующих фаз, температуры.
Свободная поверхностная энергия самопроизвольно стремится к уменьшению. Если это происходит за счет уменьшения площади поверхности частиц дисперсной фазы (слипание частиц), то ГДС разрушается, т.к. частицы укрупняются и выделяются из дисперсионной среды.
Уменьшение Gs за счет уменьшения поверхностного натяжения приводит к стабилизации ГДС. Это наблюдается в результате самопроизвольного процесса адсорбции ионов или молекул на границе раздела фаз.
Адсорбция – преимущественное концентрирование веществ в поверхностном слое по сравнению с объемом.
Вещества, снижающие свободную поверхностную энергию за счет адсорбции, называются поверхностно-активными (ПАВ). Это чаще всего органические вещества дифильного строения, имеющие полярные (гидрофильные) группы − ОН, − NH2, − COOH, − COONa, − SO3Na и др. и неполярные (гидрофобные) группы − углеводородные радикалы, содержащие не менее 8…10 атомов углерода).
