
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Задачи для самостоятельного решения
1. Золь гидроксида алюминия получен в результате полного гидролиза сульфата алюминия. Напишите уравнения реакции гидролиза в молекулярной и ионно-молекулярной форме. Составьте формулу мицеллы гидроксида алюминия, укажите ее составные части. Определите знак заряда коллоидной частицы и выберите наиболее эффективный электролит-коагулянт среди приведенных солей: KCl, K2SO4, K3PO4. Расположите электролиты в порядке возрастания порога коагуляции.
2. Какие вещества называются поверхностно-активными (ПАВ)? Какова особенность строения молекул ПАВ? Какое влияние оказывают ПАВ на смачивание твердых поверхностей полярной жидкостью?
3.
Какое явление называется адсорбцией?
Укажите ее роль в стабилизации ГДС?
Рассмотрите стабилизацию суспензии
«вода-сажа» поверхностно-активным
веществом олеатом натрия
(С15H31COONa).
Молекулы ПАВ обозначьте общепринятым
символом
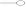 .
.
4. Расположите электролиты-коагулянты – FeCl3, Ca(NO3)2, K2SO4 – по мере уменьшения их порога коагуляции для золя кремниевой кислоты, заряженного отрицательно?
Примерный вариант самостоятельной работы 1. Золь кремниевой кислоты H2SiO3 получен при взаимодействии растворов K2SiO3 и HCl. Приведите уравнения реакции в молекулярной и ионно-молекулярной форме. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к отрицательно заряженному электроду. 2. Золь гидроксида меди получен при сливании 0,1 л раствора Cu(NO3)2 и 0,25 л раствора NaOH, молярные концентрации эквивалента которых соответственно равны 0,05 моль/л и 0,05 моль/л. Напишите формулу образовавшейся мицеллы. Какой из прибавленных электролитов – NaCl, Ba(NO3)2, CaSO4, Na3PO4 – имеет наименьший порог коагуляции? 3.
Изобразите
графически стабилизацию эмульсий
типа «масло-вода» поверхностно-активным
веществом С17H35COONa
(молекулы ПАВ обозначьте символом
|
Тема 5. Электрохимические системы
5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
Понятие об электродных потенциалах, механизм их возникновения. Зависимость электродных потенциалов от природы электродов и концентрации растворов. Определение электродных потенциалов. Ряд напряжений металлов, выводы из него, практическое значение.
Гальванические элементы – механизм работы, расчет электродвижущей силы гальванических элементов.
Литература: [1 – гл. 9, §§ 9.1 – 9.3]; [2 – гл. IХ, §§ 98 – 100].
Основные теоретические положения
Если металлическую пластину опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, остающиеся на металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость катионами и поверхностью металла. На границе металл – раствор возникает двойной электрический слой, и устанавливается равновесие: Ме Меn+ + nе−.
При погружении металлов в растворы собственных солей наблюдается два случая: активные металлы, ионы которых обладают значительной способностью к переходу в раствор, будут заряжаться отрицательно; малоактивные металлы будут заряжаться положительно вследствие перехода катионов металла из раствора на пластину.
Двойной
электрический слой характеризуется
скачком потенциала – электродным
потенциалом
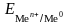 .
.
Стандартным
электродным потенциалом металла
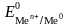 называется
электродный потенциал, возникающий при
погружении металла в раствор собственной
соли с концентрацией (точнее активностью)
ионов 1 моль/л, измеренный по отношению
к стандарт-ному водородному электроду,
потенциал которого при 25 0С
условно принимается равным нулю (
называется
электродный потенциал, возникающий при
погружении металла в раствор собственной
соли с концентрацией (точнее активностью)
ионов 1 моль/л, измеренный по отношению
к стандарт-ному водородному электроду,
потенциал которого при 25 0С
условно принимается равным нулю (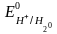 =
0 В).
=
0 В).
Располагая металлы в ряд по мере возрастания их стандартных потенциалов , получают ряд электрохимической активности или ряд напряжений металлов.
Положение того или иного металла в ряду напряжений характеризует его восстановительную способность в водных растворах. Чем более отрицательное значение электродного потенциала, тем большей восстановительной способностью обладает данный металл, и тем меньшую окислительную способность проявляют его катионы. Значения стандартных электродных потенциалов приведены в табл. 5.1.
Величина электродного потенциала зависит от природы металла, концентрации ионов данного металла в растворе и температуры. Эта зависимость выражается уравнением Нернста, которое при 298 К имеет вид:
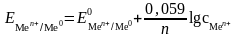 ,
(5.1)
,
(5.1)
где – стандартный электродный потенциал металла, В;
n – количество электронов, принимающих участие в реакции;
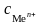 –
концентрация ионов
металла в растворе, моль/л.
–
концентрация ионов
металла в растворе, моль/л.
Таблица 5.1
