
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Решение типовых задач
Задача 1. Взаимодействие алюминия с раствором соляной кислоты протекает по следующей реакции:
2Al + 6HCl → 2AlCl3 + 3H2↑
В реакции участвуют 2,7 кг алюминия. Рассчитайте объем водорода, выделившегося в ходе реакции, протекающей при нормальных условиях, а так же при температуре 28 оС и давлении 102 кПа; абсолютную плотность водорода и плотность водорода по воздуху; массу образовавшегося хлорида алюминия и массовую долю алюминия в нем.
Решение. Реакция протекает по уравнению
2Al + 6HCl → 2AlCl3 + 3H2 ↑.
В виде таблицы представим молярные массы, количество моль и соответствующие им массы участвующих в реакции веществ.
|
Al |
HCl |
AlCl3 |
H2 |
ν, моль |
2 |
6 |
2 |
3 |
М, г/моль |
27 |
36,5 |
133,5 |
2 |
m = M·ν, г |
54 |
133,5 |
267 |
6 |
Чтобы найти объем водорода, выделившегося в реакции при нормальных условиях, составим пропорцию:
54 г Al выделяют из кислоты (22,4·3) л водорода (по уравнению реакции)
2700 г Al выделяют из кислоты Vх л водорода (по условию задачи);
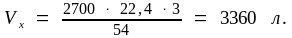
Для условий, отличных от нормальных, объем газа рассчитаем по уравнению (1.5):
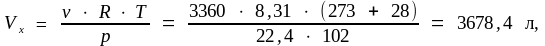
или по формуле (1.4):
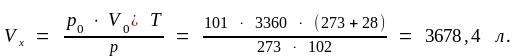
Абсолютную плотность водорода рассчитаем по формуле (1.7):
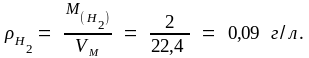
Относительную плотность водорода по воздуху рассчитаем по формуле (1.9):
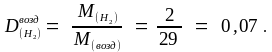
Массу образовавшегося в реакции хлорида железа рассчитаем по уравнению реакции, составив пропорцию:
2700
г Al
образуют
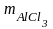
54 г Al образуют 267 г AlCl3;
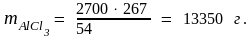
Массовую долю железа в AlCl3 рассчитаем, исходя соответственно из атомных и молярных масс атомов и молекул:
133,5 г AlCl3 составляют 100 %
27 г Al составляют х %;
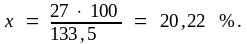
Задача 2. Какой объем воздуха необходим для сгорания 1 м3 водяного газа следующего состава: СО – 40 %, H2 – 50 %, CO2 – 5 %, N2 – 5 % (по объему)? Найдите массу эквивалента углерода (II) и (IV) и эквивалентов соответствующих оксидов.
Решение. Газы CO2 и N2 не горят, поэтому расчет необходимого объема воздуха будем проводить по реакциям горения H2 и СО.
Приняв 1 м3 водяного газа за 100 %, найдем объемы входящих в него газов:
1 м3 воздуха – 100 %
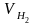 – 50
%;
– 50
%;
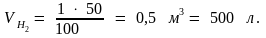
1 м3 воздуха – 100 %
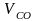 – 40
%;
– 40
%;

Напишем уравнения реакций горения водорода и оксида углерода (II):
2H2 + O2 → 2H2O; 2CO + O2 → 2CO2.
Из уравнений реакций видно, что на сгорание 2-х молей водорода (22,4 · 2 = 44,8 л) расходуется 1 моль кислорода (22,4 л), и на сгорание 2-х молей оксида углерода (II) расходуется также 1 моль кислорода. Составим пропорции:
44,8 л H2 – 22,4 л O2
500
л H2
–
Vx
л O2;
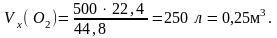
44,8 л H2 – 22,4 л O2
400
л H2
–
Vy
л O2;

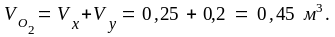
Учитывая, что в воздухе содержится 20,9 % по объему кислорода, найдем необходимый объем воздуха для сгорания 1 м3 водяного газа данного состава:
0,45 м3 – 20,9 %
Vвозд
м3
– 100
%;
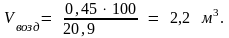
Молярные массы эквивалента углерода и его оксидов находим по формулам (1.15) и (1.16):
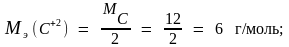
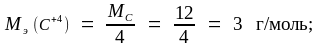
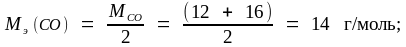
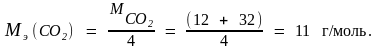
Задача 3. Вычислите молярную и молярную массу эквивалента трехвалентного металла, если 5,4 г его вытесняют из кислоты 7,06 л водорода, измеренных при 25 oС и давлении 105 кПа.
Решение. Запишем уравнение реакции взаимодействия Ме (III) с кислотой:
2Me + 6HCl → 2MeCl3 + 3H2.
Из уравнения реакции следует, что 2 моля металла вытесняют из кислоты 3 моля водорода, т.е. 3 · 22,4 = 67,2 л, измеренных при нормальных условиях. Приведем этот объем к заданным условиям, воспользовавшись формулой (1.4):
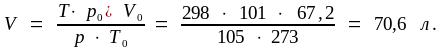
По условию задачи водорода выделилось в 10 раз меньше, что соответствует не 3, а 0,3 моля, значит, и металла было не 2, а 0,2 моля. По пропорции находим MMe:
0,2 моля – 5,4 г
1
моль
– ММе;
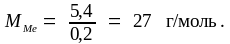
Эквивалентную массу металла определяем по формуле (1.15):
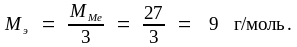
Этот металл – алюминий (Al).
