- •Часть 1
- •Часть 1
- •Введение
- •Кинематика.
- •Динамика.
- •Динамика вращательного движения.
- •Элементы механики сплошных сред.
- •Релятивистская механика.
- •Термодинамика и статистическая физика.
- •Электричество и магнетизм.
- •Диэлектрики в электрическом поле.
- •Методические указания
- •Контрольная работа по физике №1
- •Студента группы рк-001
- •Шифр 257320
- •Иванова Петра Ивановича
- •1. Механика
- •Кинематика материальной точки
- •1.2.Кинематика поступательного и вращательного движения абсолютно твёрдого тела
- •Примеры решения задач по кинематике
- •Решение
- •Решение
- •Решение
- •1.3. Динамика материальной точки и поступательного движения абсолютно твердого тела
- •1.4. Динамика вращательного движения твердого тела
- •1.4.1. Момент инерции и момент импульса твердого тела
- •1.4.2. Момент силы. Основной закон динамики вращательного движения твердого тела
- •Примеры решения задач по динамике поступательного и вращательного движения тел
- •Решение
- •Решение
- •Решение
- •Решение
- •1.5. Механическая энергия, работа и мощность
- •1.5.1 Механическая работа и мощность при поступательном движении
- •1.5.2. Кинетическая и потенциальная энергия
- •1.5.3. Работа и мощность при вращательном движении
- •Примеры решения задач на работу и мощность
- •Решение
- •Решение
- •Решение
- •Решение
- •1.6. Законы сохранения
- •1.6.1. Закон сохранения импульса
- •1.6.2. Закон сохранения момента импульса
- •1.6.3. Закон сохранения механической энергии
- •Примеры решения задач на законы сохранения
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •1.7. Механика упругодеформируемых тел
- •1.7.1 Одноосное растяжение и сжатие
- •1.7.2. Сдвиг
- •Примеры решения задач на деформацию твердых тел
- •Решение
- •Решение
- •Решение
- •1.8. Механика жидкостей и газов
- •1.8.1. Идеальная жидкость. Уравнение неразрывности. Уравнение Бернулли
- •1.8.2. Вязкость. Ламинарный и турбулентный режимы течения жидкостей
- •Примеры решения задач на механику жидкостей
- •Решение
- •Решение
- •1.9. Основы релятивистской механики
- •1. 9.1. Преобразования координат и принцип относительности Галилея
- •1.9.2. Постулаты специальной теории относительности
- •1.9.3. Преобразования Лоренца. Следствия из преобразований Лоренца
- •1.9.4. Импульс и энергия в релятивистской механике
- •2. Молекулярная физика
- •2.1. Идеальный газ. Уравнение состояния идеального газа
- •2.2. Основное уравнение молекулярно-кинетической теории
- •2.3. Распределение молекул по скоростям
- •2.4. Барометрическая формула. Распределение Больцмана
- •2.5. Эффективный диаметр и средняя длина свободного пробега молекул
- •2.6. Явления переноса
- •Примеры решения задач по мкт
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •3. Термодинамика
- •3.1. Внутренняя энергия идеального газа. Равномерное распределение энергии по степеням свободы молекул
- •3.2. Теплота и работа. Первое начало термодинамики
- •3.3. Применение первого начала термодинамики к изопроцессам. Молярная теплоемкость идеального газа
- •3.4. Адиабатный процесс. Уравнение Пуассона
- •3.5. Круговые процессы. Цикл Карно. Второе начало термодинамики
- •3.6. Энтропия
- •Примеры решения задач по термодинамике
- •Решение
- •Решение
- •Решение
- •Решение
- •Р ешение
- •Решение
- •4. Электростатика
- •4.1. Электрический заряд. Закон сохранения электрического заряда. Закон Кулона
- •4.2. Электростатическое поле. Напряженность электростатического поля. Принцип суперпозиции полей
- •4.3. Линии напряжённости. Поток вектора напряжённости. Теорема Гаусса
- •4.4. Работа сил электрического поля. Потенциал
- •4.5. Эквипотенциальные поверхности. Связь между напряженностью и потенциалом
- •4.6. Проводники в электрическом поле
- •4.7. Диэлектрики в электрическом поле
- •4.8. Электроемкость уединенного проводника. Конденсаторы
- •4.9. Энергия электрического поля
- •Примеры решения задач по электростатике
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •5. Законы постоянного тока
- •5.1. Сила и плотность тока. Сторонние силы, эдс и напряжение
- •5.2 Обобщённый закон Ома. Дифференциальная форма закона Ома
- •5.3. Работа тока. Закон Джоуля - Ленца
- •5.4. Правила Кирхгофа и их применение к расчёту электрических цепей
- •Решение
- •Подставляя это выражение в (1), получим
- •Решение Из условия равномерности возрастания тока следует
- •Решение
- •Задачи для контрольных заданий
- •86. Азот находится при нормальных условиях. Найти:
- •Варианты контрольных заданий
- •Заключение
- •Приложения
- •1. Вычитание векторов
- •1. Скалярное произведение двух векторов
- •1. Векторное произведение двух векторов
- •2. Производная и дифференциал
- •2. Таблица простейших производных
- •2. Правила вычисления дифференциалов
- •3. Элементы интегрального исчисления Интегрирование– действие обратное дифференцированию
- •Неопределенный интеграл
- •4. Понятие градиента физической величины
- •5. Основные физические постоянные
- •6. Некоторые астрономические величины
- •7. Плотности ρ твёрдых тел, жидкостей и газов
- •8. Диэлектрическая проницаемость ε
- •9. Удельное сопротивление ρ и температурный коэффициент α проводимости
- •Библиографический список
- •Оглавление
- •1.1. Кинематика материальной точки………..………….………....8
- •1.4.1. Момент инерции и момент импульса твердого
- •1.5.1 Механическая работа и мощность при поступа-
- •2.5. Эффективный диаметр и средняя длина свободного
- •4.1. Электрический заряд. Закон сохранения электрического
- •Учебное издание
- •Краткий курс физики
- •Часть 1
- •3 94026 Воронеж, Московский просп., 14
3.5. Круговые процессы. Цикл Карно. Второе начало термодинамики
Круговым
процессом или циклом называется процесс,
при котором система, проходя через ряд
состояний возвраща- ется в исходное
(рис.3.4). Цикл можно разбить на процессы
расширения (1-a-2)
и сжатия (2-в-1).
Работа расширения положительна и равна
площади под кривой 1-а-2,
а работа сжатия отрицательна и равна
площади под кривой 2-в-1.
Следовательно, работа за цикл определяется
площадью, охватываемой циклом. Если
цикл протекает по часовой стрелке, то
работа за цикл положительна (![]() ).
Такой цикл называется прямым. Если же
цикл протекает против часовой стрелки,
то он называется обратным, а работа за
цикл отрицательна. Прямой цикл используется
в тепловых двигате- лях, а обратный – в
холодильных машинах.
).
Такой цикл называется прямым. Если же
цикл протекает против часовой стрелки,
то он называется обратным, а работа за
цикл отрицательна. Прямой цикл используется
в тепловых двигате- лях, а обратный – в
холодильных машинах.
В результате цикла полное изменение внутренней энергии газа равно нулю, поэтому работа за цикл равна количеству полученной извне теплоты. Однако, в круговом процессе термодинамическая система, получившая некоторое количество теплоты Q1 от нагревателя, обязательно отдаёт часть теплоты Q2 холодильнику. Таким образом, КПД прямого кругового процесса, т.е. тепловой машины, определяется выражением
![]() .
(3.20)
.
(3.20)
Цикл называется обратимым, если он может происхо- дить как в прямом, так и в обратном направлениях, при этом в окружающей среде и в самой системе не происходит никаких изменений. Процесс неудовлетворяющий этим условиям, является необратимым. Обратимые процессы – это идеализа- ция реальных процессов.
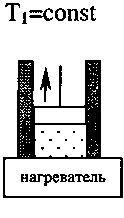
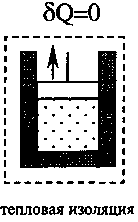
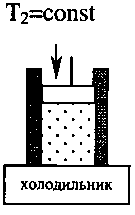
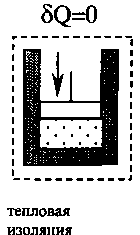
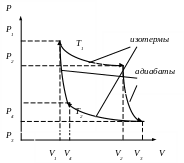
Самым экономичным обратимым процессом является цикл Карно. Этот процесс состоит из двух изотерм и двух адиабат (рис.3.5).
В качестве рабочего тела в цикле Карно используется идеальный газ, заключённый в сосуде с подвижным поршнем. Схема работы тепловой машины по циклу Карно показана в таблице.
КПД цикла Карно определяется только температурой нагревателя Т1 и холодильника Т2:
![]() .
(3.21)
.
(3.21)
 КПД всякого реального теплового
двигателя ввиду неизбежных тепловых
потерь гораздо меньше, чем для цикла
Карно.
КПД всякого реального теплового
двигателя ввиду неизбежных тепловых
потерь гораздо меньше, чем для цикла
Карно.
Рис.3.5
Как
следует из (3.21), даже в идеализированном
случае
![]() .
Это означает, что невозможен процесс
единственным результатом которого было
бы превращение всей полученной от
нагревателя теплоты в работу.
Данное утверждение называют вторым
началом термодинамики.
.
Это означает, что невозможен процесс
единственным результатом которого было
бы превращение всей полученной от
нагревателя теплоты в работу.
Данное утверждение называют вторым
началом термодинамики.
Процесс |
1. Изотермиче-ское расширение |
2. Адиабатиче-ское расширение |
3. Изотермиче-ское сжатие |
4. Адиабатиче- ское сжатие |
|
|
|
|
|
Работа, совершаемая системой |
|
|
|
|
3.6. Энтропия
Для обратимого цикла Карно из выражений (3.20) и (3.21) следует, что
![]() ,
,
или с
учётом того, что![]() величина
алгебраическая, получим
величина
алгебраическая, получим
![]() .
.
Величина
![]() называется
приведённым
количеством теплоты.
Следовательно, для цикла Карно сумма
приведённых количеств теплоты равна
нулю. Этот результат
можно распространить на любые обратимые
циклы,
т.е.
называется
приведённым
количеством теплоты.
Следовательно, для цикла Карно сумма
приведённых количеств теплоты равна
нулю. Этот результат
можно распространить на любые обратимые
циклы,
т.е.
![]() ,
или
,
или
![]() .
(3.22)
.
(3.22)
Полученный результат означает, что
![]() не
зависит от пути
интегрирования (последовательности
промежуточных состояний),
то есть величина
не
зависит от пути
интегрирования (последовательности
промежуточных состояний),
то есть величина
![]() является полным дифференциалом
является полным дифференциалом
![]() .
(3.23)
.
(3.23)
Функция состояния S,
дифференциалом которой является
![]() ,
называется
энтропией:
,
называется
энтропией:
![]() .
.
Изменение энтропии при переходе системы из состояния 1 в состояние 2 равно
![]() .
(3.24)
.
(3.24)
В частности, для идеального газа
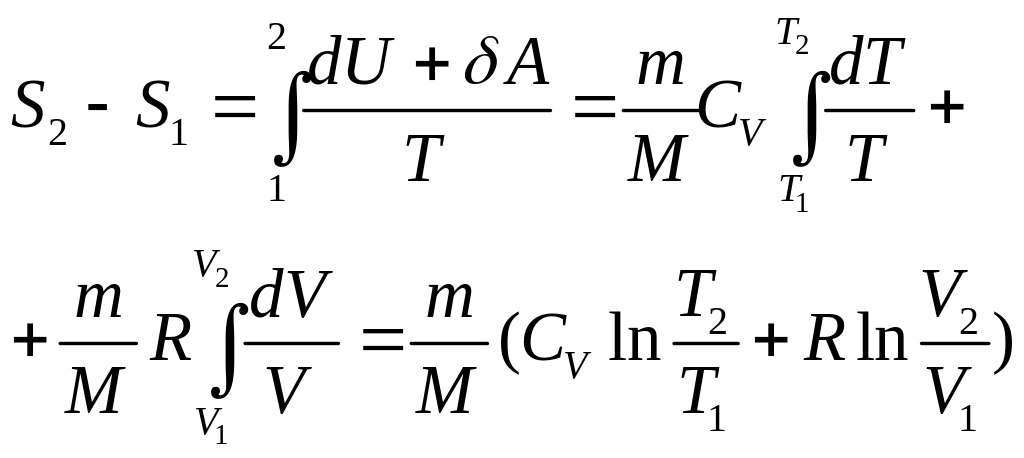 .
(3.25)
.
(3.25)
В изолированной системе, предоставленной самой себе, процессы происходят в направлении увеличения энтропии. Следовательно, состояние равновесия характеризуется максима- льной энтропией. Обратимые адиабатические процессы, для которых Q=0, характеризуются постоянной энтропией, S = const.
Все реальные процессы необратимы. Энтропия в них растет. Поэтому для всех возможных процессов в изолированной системе (включая и обратимый) получаем
![]() ,
(3.26)
,
(3.26)
то есть
энтропия либо растёт, либо остаётся
неизменной.
Этот
результат является ещё одним выражением
второго
начала термодинамики: в
любых процессах, протекающих в
изолированных
системах, энтропия не убывает.
Второй закон
термодинамики определяет направленность
тепловых процессов
в изолированных системах: они всегда
протекают в
сторону увеличения энтропии.
Если система
не изолирована, то её энтропия может
как возрастать, так и убывать в
зависимости от знака
![]() .
.
Как было установлено Больцманом, энтропия связана с термодинамической вероятностью системы W следующей формулой
![]() ,
(3.27)
,
(3.27)
где k – постоянная Больцмана.
Термодинамическая вероятность W - это число способов, которыми может быть реализовано данное состояние макро- скопической системы. Чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия, т.е. наиболее вероятном состоянии, число микросостояний максимально, при этом максимальна и энтропия. Следовательно, энтропия является мерой неупорядо- ченности системы.