
- •Направление I
- •ФУНДАМЕНТАЛЬНЫЕ ОСНОВЫ ПРОЦЕССОВ СОЗДАНИЯ И ФУНКЦИОНИРОВАНИЯ АВИАЦИОННЫХ, КОСМИЧЕСКИХ И ТРАНСПОРТНЫХ СИСТЕМ
- •ПЕРСПЕКТИВЫ ВОДОРОДНОЙ ЭНЕРГЕТИКИ В АВИАЦИИ
- •К ВОПРОСУ ОБ ОПРЕДЕЛЕНИИ ДИНАМИКИ НАГРЕВА ТОРМОЗОВ ПРИ ПРОБЕГЕ САМОЛЕТА ПОСЛЕ ПОСАДКИ
- •Получение накопителей водорода на основе никеля и его сплавов
- •НАПРАВЛЕНИЯ ПО РАЗВИТИЮ ГИДРОАВИАЦИИ
- •С.В. Ульшин
- •ВЛИЯНИЕ УПРУГИХ ДЕФОРМАЦИЙ И КОЛЕБАНИЙ НА ФУНКЦИОНИРОВАНИЕ СИСТЕМЫ УПРАВЛЕНИЯ
- •ОСОБЕННОСТИ ЭЛЕКТРОХИМИЧЕСКОГО ОБРАЗОВАНИЯ КОМПОЗИТОВ Ni-B
- •В ПОСТОЯННОТОКОВОМ И ИМПУЛЬСНОМ РЕЖИМАХ ЭЛЕКТРОЛИЗА
- •А.В.Звягинцева, канд. хим. наук; В.И. Корольков, д-р техн. наук, М.И.Смородинов
- •ИССЛЕДОВАНИЕ ДВИЖЕНИЯ ЧАСТИЦ ЗАГРЯЗНИТЕЛЯ В ПОТОКЕ ЖИДКОСТИ
- •(в настоящее время в России действует «Федеральная целевая программа обеспечения БП в государственной авиации», утвержденная распоряжением правительства РФ от 06.05.2008 № 641-р)
- •ИССЛЕДОВАНИЕ ПРОЦЕССА РОТАЦИОННОГО ОБЖИМА КОЛЕСНОГО ДИСКА
- •БЕЗОПАСНОСТЬЮ ПОЛЁТОВ
- •ЧИСТОВАЯ ОБРАБОТКА ОТВЕРСТИЙ В СМЕШАННЫХ ПАКЕТАХ
- •ЭЛЕКТРОХИМИЧЕСКАЯ ИМПУЛЬСНАЯ ТЕХНОЛОГИЯ АНОДНОЙ ОБРАБОТКИ ФОЛЬГИ
- •ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ 3D ПРИНТЕРА ДЛЯ ИЗГОТОВЛЕНИЯ ДЕТАЛЕЙ АВИАЦИОННОЙ ТЕХНИКИ
- •ВЛИЯНИЕ ДЕФЕКТОВ МИКРОСТРУКТУРЫ ЛИСТОВОГО ПОЛУФАБРИКАТА НА ОБРАБАТЫВАЕМОСТЬ ДАВЛЕНИЕМ
- •БЕРЕЖЛИВОЕ ПРОИЗВОДСТВО НА «АВИАСТАР СП»
- •Особенности расчета подбора СОСТАВА ТОПЛИВНЫХ компонентов в АРД
- •Новые решения в конструкции подшипника скольжения с увеличенным рабочим ресурсом
- •БЕСПИЛОТНЫЙ ВИНТОКРЫЛЫЙ ЛЕТАТЕЛЬНЫЙ АППАРАТ ПОВЫШЕННОЙ МАНЕВРЕННОСТИ
- •СТЕНДОВАЯ УСТАНОВКА ДЛЯ ОЦЕНКИ АБРАЗИВНОГО ИЗНОСА ДЕТАЛЕЙ АВИАЦИОННЫХ
- •УЗЛОВ И МЕХАНИЗМОВ
- •ПРЕИМУЩЕСТВА СООСНОЙ СХЕМЫ НЕСУЩИХ ВИНТОВ ВЕРТОЛЕТА
- •РАЗРАБОТКА ЖИДКОСТНОГО РАКЕТНОГО ДВИГАТЕЛЯ МАЛОЙ ТЯГИ ДЛЯ РАКЕТ СВЕРХЛЕГКОГО КЛАССА
- •Т.А. Башарина; В.С. Левин, В.В. Меньших, А.К. Ильина, В.С.Носова; Д.П. Шматов, канд. техн. наук
- •СХЕМЫ УПРАВЛЕНИЯ НЕСУЩИМИ ВИНТАМИ ВЕРТОЛЕТОВ И ИХ ОСОБЕННОСТИ
- •УСТРОЙСТВО ДЛЯ АНАЛИЗА РЕЗОНАНСНЫХ МОД КОЛЕБАНИЙ ЭЛЕМЕНТОВ КОНСТРУКЦИЙ
- •РАЗРАБОТКА БЕСПИЛОТНОГО СЕЛЬСКОХОЗЯЙСТВЕННОГО ЛЕТАТЕЛЬНОГО АППАРАТА
- •КОЭФФИЦИЕНТ ЗВУКОПОГЛОЩЕНИЯ ЗВУКОПОДАВЛЯЮЩИХ ОБЛЕГЧЁННЫХ СТРУКТУРИРОВАННЫХ ПАНЕЛЕЙ (ЗОСП)
- •АЛЬТЕРНАТИВНАЯ ПАРАШЮТНАЯ СИСТЕМА СПАСЕНИЯ ДЛЯ ЛЁГКОГО САМОЛЁТА
- •С.В. Фомин, студент; Е.Н. Некравцев, канд. техн. наук
- •ИССЛЕДОВАНИЕ МАССО-ЦЕНТРОВОЧНЫХ ХАРАКТЕРИСТИК СЕЧЕНИЙ
- •ОСОБЕННОСТИ ПОСТРОЕНИЯ АДАПТИВНЫХ СИСТЕМ УПРАВЛЕНИЯ СОВРЕМЕННЫХ САМОЛЕТОВ
- •С ЭТАЛОННОЙ МОДЕЛЬЮ
- •Рисунок 2 − Схема измерения по методу вписанной окружности
- •К ВОПРОСУ О МОДЕЛИРОВАНИИ ДИНАМИКИ НЕСУЩЕЙ СИСТЕМЫ ВЕРТОЛЕТА
- •АНАЛИЗ РАЗРАБОТОК В ОБЛАСТИ АВТОМАТИЗАЦИИ МОДЕЛИРОВАНИЯ ПРОЦЕССОВ ОМД
- •ПРОГРАММНО-МОДЕЛИРУЮЩИЙ КОМПЛЕКС ДЛЯ ОЦЕНКИ ХАРАКТЕРИСТИК ПИКИРОВАНИЯ САМОЛЕТА
- •АНАЛИЗ ВОЗМОЖНОСТЕЙ МОДЕЛИРОВАНИЯ УПРАВЛЯЮЩИХ ДЕЙСТВИЙ ЛЕТЧИКА ПРИ ДЕСАНТИРОВАНИИ МОНОГРУЗОВ
УДК 544.653.2.3.
ПОЛУЧЕНИЕ НАКОПИТЕЛЕЙ ВОДОРОДА НА ОСНОВЕ НИКЕЛЯ И ЕГО СПЛАВОВ
1Н. В. Брысенкова; 2Ю.Н. Шалимов, д-р техн. наук; 3И. В. Протасова, канд. хим. наук; 2А. В. Руссу, магистрант
1АО «Концерн «Созвездие»
2Воронежский государственный технический университет
3Воронежский государственный университет
В статье рассмотрены способы повышения удельной емкости в различных накопителях водорода. Приведены некоторые технологии для получения пористых структур. Представлена схема установки для бесперебойного питания радиоэлектронных устройств на основе топливных элементов с использованием рассмотренных накопителей водорода. Сделаны выводы о перспективах использования легирующих компонентов бериллий и бор.
Ключевые слова: накопители водорода, никель Ренея.
Введение В настоящее время в качестве накопителей водорода всё больше
уделяется внимание гидридам металлов и сплавам, содержащим гидридообразующие компоненты (Ti, Ni, Al, Zr, Hf…). Кроме того, для повышения удельной емкости в накопителе является важным наличие дефектов структуры в качестве ловушек водорода. В этом отношение интересными объектами исследования являются аморфные сплавы. Состав сплава подбирается таким образом, чтобы получилась надлежащая упругость диссоциации водорода [1, 2].
Накопители должны обладать следующими необходимыми
свойствами. |
|
|
1. |
Количество |
абсорбированного водорода должно быть |
наибольшим. |
|
|
2. |
Теплота образования гидридов должна быть мала, при этом |
|
должна сохраняться соответствующая средняя упругость диссоциации водорода несколько выше комнатных температур для исключения свободной диссоциации его.
3. Емкость по водороду не должна меняться во времени.
21
4.Абсорбирующая способность не должна ухудшаться в зависимости от загрязнения водородного газа разного рода примесями.
5.Абсорбат должен быть дешевым.
В качестве таких накопителей (абсорбатов водорода) могут выступать аморфные сплавы на основе алюминия. Они отвечают практически всем требованиям перечисленным выше. Причем в качестве легирующих компонентов могут выступать бериллий, бор, ниобий, никель и редкоземельные элементы.
Хотя на сегодняшний день данных по использованию в качестве накопителей аморфных сплавов на основе алюминия нет, но есть некоторые данные относительно аморфных сплавов на основе циркония и титана. Тем не менее, можно говорить, что в аморфных сплавах тенденция к сокращению циклов адсорбции и десорбции водорода выражена относительно слабо. Кроме того, в случае аморфных сплавов количество абсорбированного и адсорбированного водорода при низких температурах достаточно велико. Аморфные сплавы в качестве накопителей имеют также очевидные преимущества: возможность широкого выбора химического состава, большую величину максимального абсорбированного количества водорода, независимость абсорбирующей способности от степени загрязненности газа [1,2].
Важно также отметить, что для увеличения удельной емкости водорода в накопителях является степень развития поверхности, а именно наличие активных центров адсорбции. Этого можно добиться тремя способами, используя технологию получения катализаторов никеля Ренея и осаждение металла при импульсном электролизе, либо как в случае получения алюминиевой фольги анодного растворения в импульсных режимах [1,2,3].
Методика эксперимента Для решения поставленной задачи нами были выбраны в качестве
катализаторов: массивный никель Niº, мелкокристаллический никель на никелевой подложке, приготовленный по методике получения скелетного никелевого катализатора Ренея [3,4], сразу после выщелачивания цинка Niº/Ni*(NiZn)/ H, мелкокристаллический никель после разложения интерметаллидов Niº/Ni*/Н; мелкокристаллический никель после полного удаления водорода
22

Niº/Ni* и никелевое покрытие на графите С/Ni. Раствор для проведения реакции гидрирования имел состав: сантимолярный раствор малеиновой кислоты в децимолярном растворе гидроксида натрия. Подготовка электродов включала в себя стандартные операции для массивного никеля и определение коэффициента шероховатости для мелкокристаллического никеля и никелевого покрытия на графите. Каждый из этих катализаторов насыщали водородом при катодной поляризации в щелочном деаэрированном растворе при потенциале1 –1.00 В. Деаэрацию1 раствора осуществляли продувкой аргона марки х.ч. до тех пор, пока предельный ток восстановления кислорода на платиновом электроде становился не более 0.01 - 0.02 А/м2. Раствор щелочи готовился из реактивов ч.д.а. на бидистиллированной воде. Поляризация проводилась в трехэлектродной ячейке с разделенными катодным и анодным пространствами. В период деаэрации раствора в ячейке исследуемый электрод находился над раствором и только после достижения необходимой степени деаэрации он с помощью подвижного шлифа опускался в раствор. Поляризация и измерения проводились на потенциостате П-5848. И с помощью вольтамперометрического метода определяли содержание водорода.
В работе [5] была представлена методика получения алюминиевой фольги с высокой развитой пористой поверхностью. Физическая модель представляет собой систему из двух цилиндрических электродов имитирующих процессы в идеальной поре. Межэлектродный зазор изменялся в пределах от 0,1 до 5 мм. Длина электрода выбирается из условия обеспечения необходимого изменения градиента концентрации электролита по глубине поры. Предварительная формовка фольги осуществлялась в растворе
состава: Na2B4O7 10H2O – 0,25 г/л; H3BО3 - 5 г/л при температуре 40оС и напряжениях формовки Uф=60, 100, 140, 180, 240 В.
Различные напряжения формовки выбирались для выявления степени “маскировки” пор с малым диаметром туннелей. Ёмкость полученных образцов и ток утечки измерялись с помощью моста
“РЭМ-2”. Определение зависимостей iу=f(UФ, τф) даёт возможность оценить динамику процесса образования оксидных слоёв на
1 Здесь и далее потенциалы даны относительно стандартного водородного потенциала
23
алюминии при различных температурах в электролитах определённого химического состава. Необходимость проведения таких исследований определяется большим значением проблемы раскрытия механизма образования оксидных слоёв на металлах с высокой степенью пассивации, структура и физико-химические свойства которых определяют эксплуатационные характеристики электролитических конденсаторов. Время оксидирования определялось по значениям токов утечки при известных геометрических размерах образца в электролитах различного химического состава.
Результаты и их обсуждение Было установлено [3, 4], что электрохимически активная
поверхность мелкокристаллического электрода Ni°/Ni*, полученного по методике образования никеля Ренея, значительно превосходит
соответствующую поверхность компактного никеля Ni°. Коэффициент относительной шероховатости равен 178 ± 2.
Таким образом, электрод Niº/Ni*/ H (Zn), полученный травлением интерметаллидов системы Ni – Zn в щелочи, после анодного потенциостатического растворения, остатков цинка и сорбированного водорода представляет собой электрод Niº/Ni*, который от
компактного электрода Ni° отличается размером электрохимически активной поверхности.
Анодная поляризация электрода Niº/Ni*/ H (Zn) в 2 М NaOH при потенциале -0,70 ± 0,02 В, позволяет растворить остатки интерметаллидов цинка, но при этом мелкокристаллический никель на никелевой подложке останется наводороженным. Будем обозначать этот электрод так Niº/Ni*, Н. Этот же электрод можно получить катодной поляризации Niº/Ni* в щелочном растворе. Для того чтобы отличить его от предыдущего электрода, обозначим его как Ni°/Ni*/ H (Ik), то есть это наводороженный внешней катодной поляризацией мелкокристаллический никель на никелевой подложке. На рисунке 1 приведены зависимости тока растворения водорода от потенциала.
24
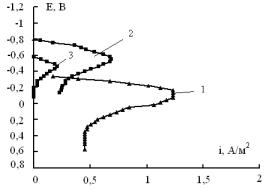
Рисунок 1 - Анодные потенциодинамические поляризационные кривые
(0,5 мВ/с) в 1 МNaOH для электродов: 1- Niº/Ni*/ H (Zn);
2- Niº/Ni*/ H (наводороженный в течение 0,5 ч); 3- Niº/ H (наводороживание 2 ч)
Анодные пики, соответствующие растворению водорода из электродов Ni°/Ni*/ H и Ni°/Ni*/ H (Ik) (кривая 1-2) располагаются при разных потенциалах. Максимум анодного растворения водорода из электрода Ni°/Ni*/ H (Ik) (кривая 2) находится при более отрицательном потенциале (- 0.550 ± 0.02 В), но это значение совпадает с потенциалом максимума анодного тока, соответствующего растворению водорода из наводороженного компактного никеля Ni°/H (кривая 3). Ионизация водорода при более положительных потенциалах для электрода Ni°/Ni*/ H, видимо, связана с тем, что наводороживание этого электрода происходит при выщелачивании цинка в течение 24 часов и за это время концентрация водорода в никеле значительно выше, чем в никеле, который наводороживается в течение 2 часов.
Количество водорода, сорбированного этими электродами, различается весьма значительно, если его относить на единицу видимой поверхности. По данным, приведенным в табл. 1, можно сделать вывод, что компактный электрод Ni°/H сорбирует на два порядка меньше, чем электроды Ni°/Ni*/ H и Ni°/Ni*/ H (Ik).
25
Таблица 1 – Количество сорбированного водорода на единицу видимой поверхности m и на единицу электрохимически - активной поверхности m’ различными электродами, наводороженными в 1М NaOH в течение 0,5 ч
Электрод |
m, моль/см2 |
m’, моль/см2 |
Ni°/H |
(0,598±0,002)*10-5 |
_________ |
|
||
Ni ° / Ni*/ Н |
(0,588±0,002)*10-3 |
(0,337±0,002)*10-5 |
|
|
|
Ni°/Ni*/ H (Ik)) |
(0,303±0,002)*10-3 |
(0,226±0,002)*10-5 |
|
|
|
Если учесть, что электрохимически активная поверхность электрода с мелкокристаллическим никелем Ni°/Ni* по отношению к соответствующей поверхности компактного никеля Ni° в 180 раз больше, то оказывается, что количество водорода, сорбированного на единицу поверхности компактного никеля несколько выше, чем у никелевого электрода с развитой поверхностью. Это, видимо, связано с тем, что в последнем случае в процессе наводороживания участвует не вся поверхность, так как доступ катодного тока в поры слоя мелкокристаллического никеля затруднен из-за омического сопротивления растворов в этих порах, а также из-за закрытия их пузырьками водорода.
Следует также отметить, что количество сорбированного водорода мелкокристаллическим никелем во время травления Ni, Zn – сплава на никеле в щелочном растворе больше, чем количество сорбированного водорода тем же мелкокристаллическим никелем, но наводороженного катодной поляризацией после удаления из него анодной поляризацией водорода и остатков цинка (табл. 1, электроды Ni°/Ni*/ H и Ni°/Ni*/ H (Ik)). Это обстоятельство легко объяснимо. При создании электрода Ni°/Ni*/ H травление Ni, Zn - сплава шло постепенно. Вначале вытравливался цинк из верхних слоев и образовавшиеся кристаллики никеля тут же сорбировали водород.
26

Такое постоянное травление способствовало сорбции2 водорода мелкодисперсным никелем в большом количестве. При наводороживании катодной поляризацией электрода Ni°/Ni*, на котором уже имеется готовый слой мелкокристаллического никеля, то осуществление реакции выделения водорода в глубоких порах затруднено. В этом случае количество сорбированного водорода электродом Ni°/Ni*/ H (Ik) несколько меньше, чем электродом
Ni°/Ni*/ H. [3].
Выводы Область применения таких накопителей довольна широка, в
частности может применяться для систем бесперебойного питания радиоэлектронных средств связи и летательных аппаратов, для которых необходима управляемая система резервного питания в том числе и в условиях внештатных ситуаций. Это система должна включать в себя основные элементы и блоки, управляемые по программе, алгоритм которой изменяется в зависимости от параметров сигнала датчиков. Например, при работе системы при номинальных параметрах (t, i) в случае уменьшения тока, потребляемого системой, датчики обратной связи выдают сигнал на увеличение температуры накопителя в результате чего количество топлива, подаваемое на топливный элемент, увеличивается, наоборот, при увеличении тока от топливного элемента, блок обратной связи формирует сигнал, в результате которого блокируются отдельные нагревательные элементы накопителя и количество водорода на топливном элементе уменьшается, кроме того, в системе предусмотрена автономная редукция топлива при постоянном потоке водорода от накопителя. Разрабатываемая система питания на основе топливных элементов будет иметь преимущество по энергетическим характеристикам по сравнению с существующими аккумуляторами на основе лития, интерметаллидов, металлгидридов.
Работа выполнена в рамках реализации Государственного задания №9.11295.2018/10.11 по теме «Разработка технологии высокоизносостойких покрытий подшипников скольжения со
2Под сорбцией понимается процесс адсорбции (физический и химический процесс) и
абсорбции.
27
сверхмалым коэффициентом трения на основе соединений никельбор»
Литература
1.Алдошин С.М., Добровольский Ю.А., Тарасов Б. П.// Альтернативная энергетика и экология. 2006. №7 (39). С.25-26
2.Судзуки К., Фудзимори Х., Хасимото К. Аморфные металлы. М.: Металлургия. 1987. 328 с.
3.Маршаков И.К., Гаврилова Н.В., Протасова И.В.// Конденсированные среды и межфазные границы. - 2006. - Т. 8. - №3. -
С.226-230 4. Гаврилова Н. В., Гусев А. Л., Кудряш В. И., Харченко Е. Л.,
Шалимов Ю. Н.// Альтернативная энергетика и экология. 2008. №8. С.10-26
5. Шалимов Ю.Н. Влияние тепловых и электрических полей на электрохимические процессы при импульсном электролизе. диссертация на соискание ученой степени доктора технических наук / Воронеж, 2006, – 354 с.
1Concern “Constellation”
2Voronezh State Technical University
3Voronezh State University
PRODUCED OF HYDROGEN STORAGE ON BASE OF NI
AND ITS ALLOYS.
1H. V. Brysenkova; 2Yu.N. Shalimov; 3I. V. Protasov;
2A. V. Russu
Methods of increase of specific capacity in different storages of hydrogen are considered in this article. Potentialities of application of alloy on bases of Ni for storage hydrogen are showed. Technologies of getting of porous structure are produced. Scheme of plant no-break power for radioelctronic device on base fuel cell with considering storages of hydrogen are produced.
Key words: hydrogen storage.
28
