
Методы исследования в медицинской бактериологии
.pdf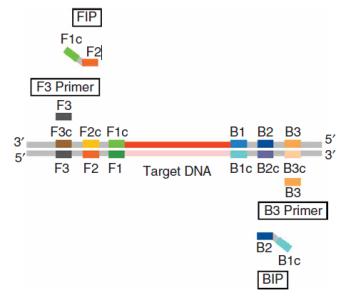
221
дорогостоящих реагентов. Чип состоит из трех функциональных частей: камеры для ПЦР; камеры для очистки ампликонов; камеры для капиллярного электрофореза (капилляр имеет длину 30 см и компактно скручен).
В клинической лабораторной практике секвенирование не используется. Секвенирование – это направление работы исследовательских лабораторий.
11.7. Петлевая изотермическая амплификация нуклеиновых кислот
Петлевая изотермическая амплификация нуклеиновых кислот (LAMP –
Loop-Mediated Isothermal Amplification) описана в 2000 г. японским ученым Цугунори Нотоми (Tsugunori Notomi) и в отличие от ПЦР осуществляется при постоянной температуре и не требует точного термоциклирования. Для амплификации нуклеиновой кислоты в этом методе используется термостабильная Bst-полимераза Bacillus stearothermophilus. Для практического использования предлагается несколько вариантов Bst-полимеразы, позволяющих готовить реакционную смесь при комнатной температуре, проводить реакцию RT-LAMP без добавления обратной транскриптазы и др.
Целевая последовательность нуклеиновой кислоты амплифицируется при постоянной температуре 60-65ОС в течение 15-60 минут. Для осуществления реакции используют 4 разных праймера (олигонуклеотиды F3, B3, FIP и BIP, являющиеся обязательными), специфичных к 6 участкам целевого фрагмента нуклеиновой кислоты (прямой наружный или внешний праймер, обратный наружный или внешний праймер, прямой внутренний праймер и обратный внутренний праймер). Строение праймеров для LAMP представлено на рисунке 223.
Рисунок 223 – Строение праймеров для LAMP. Заимствовано из Интернет-ресурсов. F3 – прямой наружный праймер, комплементарный участку F3c, B3 – обратный наружный праймер, комплементарный участку B3c, FIP – прямой внутренний праймер состоит из двух частей: F1c (5’) и F2 (3’), комплементарных участкам F1 и
222
F2c, соответственно, BIP – обратный внутренний праймер состоит из двух частей: B1c (5’) и B2 (3’), комплементарных участкам B1 и B2c, соответственно.
Для эффективной LAMP достаточно менее 10 копий целевого участка нуклеиновой кислоты в исходной реакционной смеси.
Процесс амплификации нуклеиновой кислоты при этом методе включает 3 основных этапа:
-образование базовой гантелеобразной (петлеобразной) структуры;
-циклическая амплификация;
-элонгация и повторение циклов.
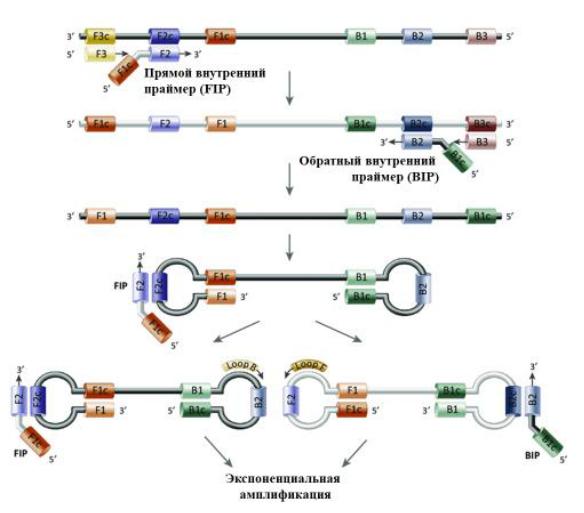
Процесс амплификации в LAMP-методе представлен на рисунке 224.
Рисунок 224 – Процесс петлевой изотермической амплификации нуклеиновых кислот. Заимствовано из Интернет-ресурсов.
Внешние праймеры (F3 и B3) необходимы лишь в самом начале реакции для разделения двух материнских цепей. Образование гентелевидной структуры происходит с помощью специально подобранных внутренних праймеров. Именно они формируют петли на концах искомого фрагмент. Для этого к 5′-концу праймера F2 прикреплена вторая часть (F1c), комплементарная F1 части матрицы. Полученный фрагмент F1c-F2 представляет собой прямой внутренний праймер (FIP) длинной до 50 нуклеотидов (обозначение F происходит от англ. forward – “прямой”).
223
F2 регион внутреннего праймера FIP гибридизируется с мишенью, а цепь достраивается с помощью ДНК-полимеразы. Затем внешний праймер F3присоединяется к F3c фрагменту мишени, и ДНК-полимераза достраивает цепь, смещая синтезированную последовательность, которая формирует петлеобразную структуру на 5′-конце, так как F1с-участок гибридизируется с F1-регионом.
То же самое происходит и с праймерами, садящимися на противоположный 3′-конец матрицы (обозначение B происходит от англ. backward – “обратный”). В конечном итоге, формируется одноцепочечный фрагмент ДНК с петлями с обеих сторон – своеобразная гантелевидная структура (dumbbell structure). С образованием такой структуры завершается первый этап LAMP.
После образования петлеобразной структуры с 3′-конца Bst-полимераза продолжает синтез к 5′-концу, в результате чего образуется “рукоятка” (stemloop). Концы “рукоятки” также замыкаются в петли, в результате чего формируются загзагообразные продукты.
Использование в дальнейших разработках петлевых праймеров позволило проводить синтез с петель в обе стороны. В результате этого уже через 10-20 минут возможно регистрировать продукт в достаточном количестве.
В качестве матрицы при проведении LAMP можно использовать как ДНК, так и РНК. В случае использования в качестве матрицы РНК в реакционную смесь добавляют обратную транскриптазу. Такой вариант метода называется RT-LAMP (reverse transcription-coupled LAMP).
Этапы проведения LAMP:
-начало амплификации – посадка олигонуклеотидов FIP и BIP и наработка гантелевидных ДНК-структур с двумя петлями;
-циклическая амплификация – наработка ДНК-продуктов с гантелевидной структурой;
-элонгация – наработка ДНК-продуктов различной длины и с множеством
петель.
Детекцию продуктов LAMP можно проводить методом агарозного гельэлектрофореза, однако этот способ трудоемкий и длительный. Проще добавить к реакционной смеси интеркалирующий краситель (например, бромистый этидий, пропидиум йодид и др.) и наблюдать за изменением флюоресценции в ходе процесса с помощью специального реал-тайм флуориметра для LAMP. Вместо красителей можно использовать специальные флюоресцентные зонды.
Выделяют следующие методы детекции, используемые в LAMP-методе:
-визуализация продуктов реакции электрофорезом с окрашиванием бромидом этидия;
-флюоресцентная детекция в растворе с интеркалирующими агентами;
-турбидиметрическая визуализация (образование нерастворимого пирофосфата);
-турбидиметрия с флюоресценцией;
-BART - турбидиметрия с люминесценцией;
-электрохимическое определение продуктов;
-использование флюоресцентно-меченых праймеров.
Некоторые способы детекции представлены на рисунке 225.

224
Рисунок 225 - Способы детекции продуктов реакции LAMP / RT-LAMP: слева – агарозный гель-электрофорез с окраской бромистым этидием; справа – окраска реакционной смеси интеркалирующим красителем.
В таблице 24 представлена сравнительная характеристика методов ПЦР и
LAMP.
Таблица 24 - Сравнительная характеристика ПЦР и LAMP
Характеристика |
ПЦР |
LAMP |
Этап денатурации |
Требуется |
Отсутствует |
Температурный режим |
94ОС, 55-60ОС, 72ОС |
60-65ОС |
Количество используемых |
2 |
4-6 |
праймеров |
|
|
Чувствительность к |
Высокая |
Низкая |
примесям |
|
|
Время реакции |
45 мин – 3 ч |
5-60 мин |
Приборное оснащение |
Амплификатор |
Термоблок или термостат |
Работа с РНК-матрицей |
Предварительный этап |
Обратная транскрипция |
|
обратной транскрипции, |
проводится при той же |
|
наличие фермента |
температуре без |
|
(обратной транскриптазы) |
специфического фермента |
Визуальные методы |
Нет |
Есть |
детекции |
|
|
225
12. Методы масс-спектрометрии
Масс-спектрометрия позволяет проводить идентификацию более 4000 видов микроорганизмов, сокращая при этом сроки идентификации на 24-72 часа. Один из важных показателей – экономичность методики, которая почти не требует затрат на реактивы и расходные материалы. В клинической микробиологии массспектрометрия позволяет с высокой точностью определить количественный и качественный состав вещества, его структуру, физико-химические свойства.
Масс-спектрометрия представляет собой физический метод измерения отношения массы заряженных частиц вещества к их заряду (m/z). Приборы, которые реализуют этот метод, называются масс-спектрометрами. Они состоят из источника ионов, системы разделения ионов (анализатор) и детектора. Чтобы получить массспектр надо превратить молекулы и атомы органического вещества в заряженные частицы – ионы (осуществляется в источнике ионов), разделить полученные ионы в пространстве и времени (осуществляется в анализаторе) и зафиксировать сигнал от полученных заряженных частиц (осуществляется в детекторе).
Масс-спектрометры используются в следующих направлениях микробиологии:
-идентификация микроорганизмов в биологических средах;
-видовое и родовое типирование бактерий;
-определение чувствительности микроорганизмов к антибиотикам.
Способы масс-спектрометрии (MS):
1 способ – по спектру белков микробов – белковое профилирование
(MALDI-TOF MS);
2 способ – по клеточным липидам – метод газовой хроматографии в сочетании с масс-спектрометрией (ГХ-МС) и метод жидкостной хроматографии в сочетании с масс-спектрометрией (ЖХ/МС).
Масс-спектрометрия наиболее полно реализована в технологии MALDI-TOF. MALDI (МАЛДИ, матрично-активированная лазерная десорбция/ионизация)
представляет собой “мягкий” способ ионизации твердого вещества, обусловленный воздействием лазерного излучения на смесь матрицы с анализируемым веществом. Иными словами, МАЛДИ - это система получения ионов из твердой фазы. Вспомогательная матрица снижает разрушительные свойства лазерного излучения, что обеспечивает ионизацию крупных биомолекул без деградации.
TOF (Time of Flight) – это принцип работы анализатора масс-спектрометра, заключающийся в разделении ионов в вакууме и фиксации времени пролета ионов в зависимости от их массы (измерение скорости дрейфа частиц в специальной трубе). Метод фиксирует время пролета заряженными частицами конкретного расстояния и разделяет ионы по этому признаку. Время пролета пропорционально отношению массы частицы к ее заряду. Фиксируемые время-пролетные характеристики неизвестных микроорганизмов сравниваются с имеющейся базой данных.
Преимущества метода масс-спектрометрии:
-быстрота проведения исследования;
-точность и достоверность результатов;
-подключение масс-спектрометра к автоматическим системам идентификации микроорганизмов;
226
-экстракция белков может быть проведена непосредственно на слайде;
-уверенность: одноразовые слайды исключают риск контаминации и не требуют мытья;
-высокое разрешение: высокая воспроизводимость идентификации спектров белков микроорганизмов в диапазоне более 10 кДа. Возможность сканирования веществ массой до 500 кДа;
-база данных состоит из клинически значимых видов и более 25000 спектров. Надежная валидация с использованием Расширенного Классификатора Спектров для достоверной идентификации. Для каждого вида в базе данных получены спектры большого количества штаммов.
Метод позволяет проводить и субтипирование микроорганизмов. Этапы масс-спектрометрического анализа:
-пробоподготовка (первичный посев клинического материала на питательную среду);
-мягкая ионизация - MALDI;
-сортировка ионов по массам и по времени пролета (TOF);
-идентификация (Biotyper).
Возможности и преимущества метода MALDI:
-замена всех морфологических и биохимических методов идентификации;
-точность исследования приближается к 100%;
-одинаковая простота идентификации анаэробов и аэробов;
-возможность идентификации микобактерий и плесневых грибов в день обнаружения роста.
Использование масс-спектрометрии в медицине:
-MALDI Biotyper - экспресс идентификация микроорганизмов;
-GENOLINK - генотипирование олигонуклеотидных полиморфизмов и оценка качества олигонуклеотидов;
-CLINPROT - поиск пептидных маркеров заболевания (белковое профилирование);
-ImagePrep - поиск молекулярных маркеров на гистологических срезах (молекулярная гистология);
-ProteinScape – исследования в области протеомики.
Метод матрично-активированной лазерной десорбции / ионизации был разработан для анализа высокомолекулярных соединений в 1985 г. немецкими учеными Францем Хилленкампом и Михаелем Карасом. В этом методе в качестве матрицы использовалось низкомолекулярное органическое соединение. Но для ионизации белков они этот метод не применяли. Дело в том, что при массспектрометрическом методе анализируемая молекула ионизируется и переводится в газовую фазу под действием лазера. Это воздействие приводит к разрушению таких макромолекул как белки.
В 1985 г. Танака Коити запатентовал методику под названием SLD (soft laser desorption) - мягкая лазерная десорбция для масс-спектрометрического анализа. Он предложил использовать тонкий металлический порошок в глицерине в качестве матрицы. В этом случае макромолекулярные аналиты ионизируются без разрушения структуры самого вещества. В 1987 г. он доложил эту методику на ежегодной конференции Японского масс-спектрометрического общества. С этого времени

•
227
•
Коити
а |
б |
в |
Танака Коити |
Франц Хилленкамп |
Михаель Карас |
Рисунок 226 – Разработчики метода матрично-активированной лазерной десорбции /
(1959) (1936-2014) (1952)
ионизации: а – Танака Коити (род. в 1959 г.); б – Франц Хилленкамп (1936-2014 гг.); в – Михаель Карас (род. в 1952 г.). Заимствовано из Интернет-ресурсов.
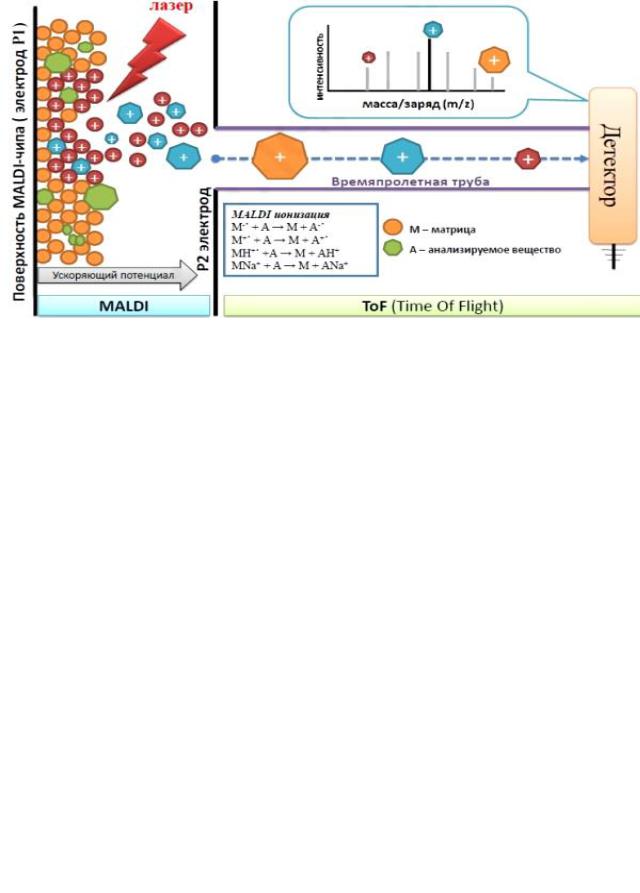
Сущность метода MALDI-TOF MS состоит в том, что с помощью лазерных импульсов органическое вещество микроорганизмов превращается в заряженные частицы – ионы (ионизация). При этом молекулы вспомогательного вещества (матрицы) и изучаемого белка под воздействием лазера переходят в газовую фазу. Под влиянием электрического поля ионы движутся от источника ионизации к детектору с ускорением, обратно пропорциональным атомным массам. Затем проводится сортировка ионов по массам (по отношению массы к заряду) и построение масс-спектр-графика. Сопоставление полученного спектра с имеющейся базой данных позволяет идентифицировать микроорганизмы. Идентификация микроорганизмов учитывает уникальный для каждого вида микроорганизмов набор белков – своеобразный “отпечаток пальца” (фингерпринтинг), “протеомная дактилоскопия”. Определение спектра белков проводится для бактериальных клеток из изолированной колонии с чашки первичного посева исследуемого материала. Идентификация осуществляется в основном по рибосомальным белкам, которые присутствуют во всех микроорганизмах. Принцип метода представлен на рисунке
227.
Время-пролетная масс-спектрометрия основана на измерении скорости пролёта каждой частицы микроорганизма и выведении на экран результатов “старта” и “финиша”. Вся процедура длится считанные секунды. Для молекул, полученных от разных микроорганизмов, характеристики уже известны, и прибору остаётся сравнить результаты с базой данных. Этот метод позволяет определять больше 4 тысяч видов микроорганизмов.
228
Рисунок 227 – Принцип MALDI-TOF MS. Заимствовано из Интернет-ресурсов.
Методика идентификации микроорганизмов с помощью масс-спектрометрии включает следующие этапы (рисунок 228):
1 этап: подготовка образца (смешивание материала из отдельной колонии с раствором специальной матрицы на подложке масс-спектрометра). Время – 10-33 минуты. В качестве матрицы используют 2',5'-дигидроксибензойная кислота.
2 этап: идентификация (смесь помещают в прибор и подвергают воздействию неносекундных лазерных импульсов) – сравнивание масс-спектра исследуемого
материала со спектрами из базы данных. Время – 12-43 минуты. За 1 загрузку можно идентифицироваПоследовательность192 образца. операций
Шаг 1
Выбор колонии и |
Добавление |
|
матрицы |
||
нанесение ее |
||
|
||
на подложку |
|
Шаг 2
Шаг 3
Идентификация
по базе данных
Получение
масс-спектра
Рисунок 228 – Последовательность операций при масс-спектрометрии. Заимствовано из Интернет-ресурсов.

229
Технология идентификации микроорганизмов методом MALDI-TOF реализована в нескольких анализатора, в том числе в лабораторном комплексе Vitek MS (БИОМЕРЬЕ, Франция). В этом анализаторе на идентификацию одного микроорганизма требуется 2 минуты. Затраты по времени для подготовки 24 изолятов составляют 10 минут, для 96 изолятов – 33 минуты.
Совмещение анализаторов Vitek MS и Vitek 2 позволило компании БИОМЕРЬЕ обеспечить решение двух задач – идентификации бактерий и определения чувствительности микроорганизмов к антибиотикам.
Анализатор Vitek MS (рисунок 229) позволяет проводить идентификацию и определение чувствительности культур к антибиотикам. Микроорганизмы наносятся на слайд, добавляется матрикс и запускается анализ. За 1 загрузку анализируется до 192 образцов.
Рисунок 229 - Анализатор Vitek MS. Заимствовано из Интернет-ресурсов.
Приборное оснащение микробиологических масс-спектрометрических исследований постоянно совершенствуется. Например, времяпролетный МАЛДИ масс-спектрометр Bruker Microflex LT представляет собой настольный вариант для клинических лабораторий (рисунок 230).

Времяпролетный МАЛДИ масс- |
|
спектрометр Bruker Microflex LT |
|
|
230 |
• |
Настольный масс- |
|
спектрометр для |
|
проведения |
|
исследований в |
|
клинических |
|
лабораториях. |
Рисунок 230 – Времяпролетный масс-спектрометр Bruker Microflex LT. Заимствовано из Интернет-ресурсов.
Система MALDI Biotyper является революционной разработкой в области
микробиологии. Система за несколько секунд оценивает наличие уникального |
||
Система MA |
||
набора белков неизвестного микроорганиз . Принцип |
Biotyper |
основан на |
сопоставлении полученных масс-спектров рибосомальных б лков с б зой данных, |
||
содержащей спектры большинства микроорганизмов. |
После |
нахождения |
уникального набора масс-пиков программа выдает наиболее вероятный результат (рисунок 231).
• |
Револ |
|
облас |
|
за нес |
|
нали |
|
белко |
|
микр |
• |
Систе |
|
микр |
|
спект |
Рисунок 231 - Система MALDI Biotyper. Заимствовано из Интернет-ресурсов.
Система идентификации микроорганизмов Axima@SARAMIS
•построенаСисте
на базе Maldi-Tof. Достоверный результат выдается за 2 минуты. Система обладает |
|
|
поло |
высокой воспроизводимостью результатов и позволяет значительно экономить |
|
средства и время (рисунок 232). |
гемок |
|
|
|
жидк |
