
Методы исследования в медицинской бактериологии
.pdf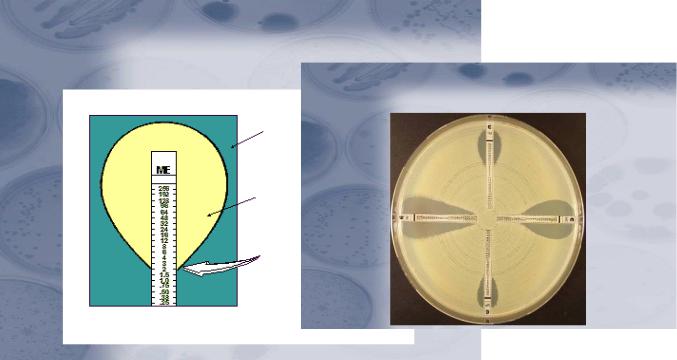
151
Диаметр зоны торможения роста (в мм) |
Чувствительность микроорганизмов |
10 |
нечувствительны |
10 – 15 |
слабо чувствительны |
15 – 20 |
чувствительны |
20 – 25 |
высокочувствительны |
Таким образом, если зона задержки роста составляет 15-25 мм, то микробы считают чувствительными к антибиотикам, до 15 мм - малочувствительными, а отсутствие зоны указывает на резистентность бактериальной культуры к данному антибиотику. Этот метод используется только для “быстрорастущих” микроорганизмов, образующих сплошной рост на плотной питательной среде (в виде “газона”) через 18-20 часов экспозиции.
Е-тест (эпсилометрический метод) представляет собой модификацию метода дисков. В то же время Е-тест позволяет получать как качественный (чувствительный, резистентный), так и количественный (МПК) результат исследования. В этом тесте вместо дисков используется пластиковая полоска, содержащая экспоненциально убывающие концентрации антибиотика (например, от 256 до 0,016 мкг/мл). Каждая зона полоски имеет соответствующую маркировку.
Для постановки теста готовят суспензию бактерий в концентрации 108 КОЕ/мл. Приготовленной суспензией смачивают стерильный тампон и равномерно штриховыми движениями распределяют суспензию по всей поверхности агара. После подсушивания на чашку диаметром 90 мм наносят не более 2, а на чашку диаметром 150 мм - не более 6 полосок Е-теста. Посевы с полосками инкубируют при температуре 35ОС в течение 16-18 часов.
(
Е-тест
Зона
имеет эллипсовидную концентрации антибиотика зона задержки роста
Вариант постановки Е-теста
|
Зона |
|
МПК 2 |
|
86 |
а |
б |
|
85 |
Рисунок 157 – Схема интерпретации результатов опыта (а) и определение МПК с помощью Е-теста (б). Заимствовано из Интернет-ресурсов.
Автоматические системы учета результатов метода серийных разведений представляют собой инкубационные системы со встроенными фотометрами, регистрирующими рост бактерий в лунках микропанелей, содержащих антибиотики. Например, устройство VITEK 2 позволяет получать результаты уже через 4-10

|
Vitek 2. Автоматическая система |
|
часов. Этот |
микроорганизмов и определения |
|
АМП |
||
определяет |
||
|
препаратов (рисунок
для иденти чувствител
• |
Обеспечивают по |
|
|
результата вмест |
|
|
антибиотикограм |
|
|
день получения ч |
|
|
культуры |
|
• |
Идентификация |
|
|
таксонов |
|
• |
Определение |
|
|
чувствительност |
|
Рисунок 158 – Устройство VITEK 2 для автоматической идентификации |
||
|
(минимальных |
|
определения чувствительности бактерий к антимикробным препаратам. |
||
Заимствовано из Интернет-ресурсов. |
ингибирующих |
|
концентраций) к |
||
|
||
|
антимикробных |
|
Автоматизированный метод определения чувствительности бактерий к |
||
антибиотикам предусматривает использование пластиковых |
препаратов |
|
карт с лунками, |
||
заполненными антибиотиками, углеводами, индикаторами рН. Все компоненты находятся в высушенном состоянии. Для постановки теста готовят суспензию чистой культуры исследуемых бактерий. Анализатор автоматически вносит суспензию микроорганизмов в тест-систему, инкубирует при 35ОС в течение суток, учитывая результаты каждые 2 часа. Прибор автоматически проводит нефелометрию и спектрофотометрию и по изменению мутности и цвета среды определяет МИК исследуемой культуры, сравнивает ее со стандартными величинами МИК и относит бактерии к чувствительным, умеренно чувствительным или резистентным. По мере готовности результатов анализатор выдает протокол испытаний (электронный или печатный). Этот метод прост в исполнении, позволяет получать результаты через 5–8 часов, способен создавать электронную базу данных. Однако для этого метода требуется дорогостоящий автоматический анализатор.
Карты-тест-системы для идентификации бактерий и определения чувствительности к антимикробным препаратам выпускаются к анализаторам VITEK 2 и VITEK 2 Compact. Они поставляются отдельно. Определение чувствительности к антибиотикам осуществляется методом, аналогичным методу двойных разведений в жидкой (полужидкой) среде. Карта для определения чувствительности имеет 64 лунки и содержит 18-22 антимикробных препарата в нескольких концентрациях. После заполнения суспензией бактерий карта запаивается и становится полностью герметичной и безопасной.
При определении чувствительности микроорганизмов к антибиотикам целесообразно соблюдать следующие условия:
-использование в работе чистых культур бактерий и выполнение исследований с соблюдением правил асептики;
-применение стандартных питательных сред, соответствующих питательным потребностям исследуемого микроорганизма;
153
-использование исследуемой культуры в установленной соответствующими инструкциями дозе с соблюдением соотношения культуры и среды;
-использование оптимального режима инкубирования.
Внекоторых случаях в бактериологии используют генетические методы, направленные на определении маркёров резистентности к антибиотикам. Выявление генетических маркёров резистентности целесообразно в тех случаях, когда традиционные фенотипические методы определения чувствительности микроорганизмов неприменимы или недостаточно эффективны. Например, определение чувствительности Mycobacterium tuberculosis к противотуберкулёзным препаратам с помощью фенотипических методов занимает 4-8 недель. При длительном культивировании микобактерий антибиотики снижают свою активность, что приводит к искажению получаемых результатов.
Впоследние годы в лабораторной практике стали применять метод ПЦР для выявления у микробов специфических генов, ответственных за формирование лекарственной устойчивости (геноиндикация антибиотикоустойчивых культур).
154
8. Биологический метод исследования
Биологический (экспериментальный) метод (биопроба) позволяет выделять патогены из организма зараженных животных, воспроизводить инфекционный процесс (качественный показатель), определять вирулентность культур (количественный показатель) и токсичность. В некоторых случаях с помощью биопробы можно изучать аллергическое действие микробов на макроорганизм.
8.1. Лабораторные животные, правила работы с ними
Выбор лабораторных животных определяется целью работы. Наиболее часто используют для заражения белых мышей, морских свинок и кроликов. Они восприимчивы к возбудителям многих инфекционных заболеваний человека, удобны в обращении и легко размножаются в питомниках. Реже заражают хомяков, обезьян и других животных. В некоторых лабораториях для заражения используют так называемых линейных животных, выведенных путем родственного братскосестринского скрещивания на протяжении более 20 последовательных поколений. Линейные животные являются генетически однородными и отличаются от нелинейных животных постоянными реакциями на воздействие различных факторов.
Лабораторные животные характеризуются видовой, возрастной и индивидуальной чувствительностью к микроорганизмам. В связи с этим при выборе животных для исследований необходимо учитывать их вид и возраст. У беспородных животных чувствительность характеризуется значительными индивидуальными колебаниями. Использование линейных животных, обладающих определенной постоянной восприимчивостью к микроорганизмам, позволяет исключить индивидуальные колебания чувствительности и получить воспроизводимые результаты.
Животных заражают для выделения чистой культуры возбудителя в тех случаях, когда нельзя получить ее другими способами (например, незначительное содержание микроорганизмов в пробе). Так, при исследовании разложившихся трупов грызунов на присутствие возбудителей чумы суспензией органов заражают морских свинок, которые погибают через 3-7 дней при явлениях септицемии (размножение микроорганизмов в крови). Из крови и внутренних органов павшей морской свинки можно легко выделить чистую культуру возбудителя.
Отбор животных. Опыты проводят только на здоровых животных. Желательно использовать животных одинакового возраста, пола, массы. Перед заражением животных взвешивают и измеряют у них температуру тела. Взвешивание и измерение температуры производят до заражения и в течение всего опыта. Нормальная температура тела у лабораторных животных колеблется в следующих пределах: у морских свинок - 37,8-39,5°С, у кроликов - 37,7-38,8°С, у мышей – 37-39°С.
Маркировка (метка) мелких животных (например, мышей) заключается в окрашивании различных участков шерсти растворами анилиновых красителей, пикриновой кислоты или в нанесении маркерных знаков на уши. Маркерные знаки

155
выпускаются в виде колец или жетонов из мягкой белой жести. Их закрепляют на лапках или ушах животных. Для маркировки морских свинок отмечают характер рисунка шерсти в виде схемы.
Место введения материала готовят накануне проведения опыта, чтобы к моменту введения исчезло раздражение кожи. На ограниченных участках шерсть выстригают, выбривают (выщипывание волос не рекомендуется) или удаляют с помощью депиляторов. Для депиляции смесь одной части бария сульфата и двух частей оксида цинка разводят водой до получения массы в виде густой сметаны и накладывают эту массу на 3 минуты на шерсть, после чего удаляют ее вместе с шерстью, а кожу тщательно промывают водой. Непосредственно перед инъекцией кожу дезинфицируют спиртом или йодной настойкой. У мелких животных шерсть не удаляют, а обрабатывают стерильным физраствором.
Фиксация животных. Неподвижность животного во время опыта достигается применением специальных станков, досок-фиксаторов, ящиков или приемов, с помощью которых помощник фиксирует животное в нужном положении.
Для проведения подкожных и внутрикожных инъекций кроликов и морских свинок кладут на бок, одной рукой держат задние конечности, а другой обхватывают грудную клетку, вводя пальцы в подмышечные впадины.
При взятии крови из сердца животных или при введении материала их кладут на спину, растягивая передние конечности в стороны и немного вверх (рисунок
159).
Рисунок 159 – Взятие крови из сердца кролика. Заимствовано из Интернетресурсов.
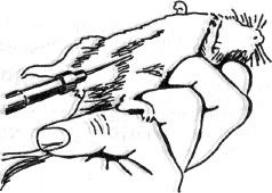
Мышь берут левой рукой за хвост, опускают на стол, туловище быстро прижимают к столу двумя пальцами правой руки и, передвигая их по спине, захватывают кожу над головой. Животное слегка растягивают. Чтобы держать мышь без помощника (одной рукой), кожу головы фиксируют пальцами левой руки, а хвост - мизинцем и ладонью той же руки (рисунок 160).
156
Рисунок 160 – Заражение мыши внутрибрюшинным способом. Заимствовано из Интернет-ресурсов.
Инструменты, необходимые для заражения и вскрытия животных, кипятят в течение 30 минут. Патологический материал или взвесь микроорганизмов набирают в шприц над кюветой с дезинфицирующим раствором. Для предупреждения разбрызгивания при удалении пузырьков воздуха иглу вводят в стерильную вату, поворачивают шприц иглой вверх и выталкивают воздух вместе с небольшим количеством материала. Загрязненную вату снимают пинцетом и погружают в дезинфицирующий раствор. После заражения шприц и инструменты вновь кипятят 30 минут и более в зависимости от устойчивости микроорганизмов в материале к температуре. При использовании одноразовых шприцов и инструментов их помещают в дезраствор, подвергают автоклавированию и уничтожают.
8.2. Методы заражения и вскрытия лабораторных животных
При заражении лабораторных животных исследуемый материал вводят различными путями: накожно, внутрикожно, подкожно, внутримышечно, внутривенно, перорально, интрацеребрально. Способ введения материала зависит от тропизма возбудителя к определенным тканям организма, а объем вводимого материала - от метода его введения и вида животных (таблица 20).
Таблица 20– Основные способы заражения лабораторных животных
Путь введения |
|
Объем вводимого материала, мл |
|
||
материала |
мышь |
|
морская свинка |
|
кролик |
В мозг |
0,02 |
|
0,1 |
|
0,2-0,3 |
Внутрикожно |
0,1-0,2 |
|
0,1-0,2 |
|
0,1-0,2 |
В брюшную полость |
До 1,0 |
|
До 5,0 |
|
До 10,0 |
Внутривенно |
До 1,0 |
|
До 2,0 |
|
До 5,0 |
Через нос |
0,03-0,05 |
|
До 2,0 |
|
До 2,0 |
Подкожно |
До 0,5 |
|
3,0-5,0 |
|
3,0-5,0 |
Внутримышечно |
0,25 |
|
2,0 |
|
5,0 |
В переднюю камеру |
- |
|
0,05-0,1 |
|
0,05-0,1 |
глаза |
|
|
|
|
|
157
Заражение через рот осуществляется путем добавления инфицирующего материала к корму или питьевой воде. Перед заражением животных не кормят в течение суток. Пероральное заражение можно производить с помощью зонда или эластичного катетера, шприца и иглы, сточенной под прямым углом или с оливой на конце.
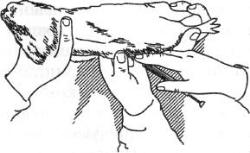
Подкожное заражение проводят следующим образом. Двумя пальцами левой руки захватывают кожу и в образовавшуюся складку вводят иглу (рисунок 161).
Рисунок 161 – Подкожное заражение морской свинки. Заимствовано из Интернет-ресурсов.
Проколов кожу, слегка меняют направление иглы, чтобы после ее извлечения материал не выливался, затем вводят содержимое шприца, надавливая на поршень правой рукой, и быстро извлекают иглу, предварительно положив на нее вату, смоченную в спирте. Кроликам и морским свинкам подкожные инъекции делают на спине и животе, а крысам и мышам - на спине, у корня хвоста.
Внутрикожное заражение требует более тщательного удаления шерсти животного. Кожу растягивают двумя пальцами левой руки и вводят тонкую иглу под острым углом отверстием кверху в поверхностный слой эпидермиса так, чтобы конец ее просвечивал через кожу. При правильном введении жидкости появляется четко отграниченное возвышение, не исчезающее в течение 3-5 минут. Кожа над ним приобретает вид лимонной корочки. Внутрикожно вводят не более 0,1-0,2 мл жидкости.
Накожное заражение - способ, при котором исследуемый материал втирают стеклянной палочкой в неповрежденную или скарифицированную кожу. Скарификацию (насечки) делают скальпелем или специальным пером. Материал втирают в местах, недоступных для слизывания (на спине, ближе к голове).
Внутрибрюшинное заражение проводят так, чтобы инфицирующий материал попал в нижний отдел брюшной полости. При этом животное держат головой вниз, чтобы кишечник переместился к диафрагме. Толчкообразным движением прокалывают брюшную стенку и вводят содержимое шприца.
Внутривенное заражение различно у разных видов животных. Кроликам инфицирующий материал вводят в краевую вену уха. Удалив шерсть вдоль наружного края уха, для лучшего кровенаполнения зажимают основание его, растирают или смазывают ксилолом. Иглу вводят в вену под острым углом (рисунок 162) по направлению тока крови, перед инъекцией сдавливание прекращают.

158
Рисунок 162 – Внутривенное заражение кролика. Заимствовано из Интернетресурсов.
Перед извлечением иглы вену сдавливают стерильной сухой ватой и не снимают ее до прекращения кровотечения,
Мышам инъекции осуществляют в хвостовую вену. Помощник держит мышь и сдавливает корень хвоста. Для более полного кровенаполнения сосудов хвост погружают на 1-2 минуты в воду, нагретую до 50°С. Прокол лучше делать у основания хвоста, где сосуды расположены поверхностно, а вены шире. Во время введения материала сдавливание у корня хвоста прекращают.
Морским свинкам материал вводят в вену на внутренней поверхности бедра, предварительно разрезав и отсепарировав кожу. После инъекции на рану накладывают швы.
Внутрисердечное заражение по технике не отличается от взятия крови из сердца. Кролика или морскую свинку фиксируют, как описано выше, при этом голова животного должна находиться слева от экспериментатора. Шерсть с левой стороны груди выстригают, кожу дезинфицируют спиртом или йодом. Большим пальцем левой руки экспериментатор слегка надавливает на правую сторону грудной клетки животного, а указательным пальцем нащупывает толчок сердца и одновременно определяет положение ребер. Иглу вводят в межреберный промежуток в месте толчка сердца перпендикулярно грудной клетке. Если игла находится в полости сердца, в шприц толчками поступает кровь. После заражения место прокола дезинфицируют спиртовым раствором йода.
Заражение через нос производят за защитным стеклом. Материал вводят под наркозом (эфирным), для чего животных (крыс, мышей) помещают в плотно закрываемую банку, на дно которой помещают вату, смоченную эфиром. При оптимальном наркозе у животных наблюдается глубокое ритмичное дыхание. Материал вводят в каждый носовой ход при помощи шприца с надетой на него иглой или пастеровской пипетки. При неглубоком наркозе у животных сохраняется чихательный рефлекс, и материал может быть разбрызган, что создает опасность заражения экспериментатора. При слишком глубоком наркозе дыхание животных поверхностное, и материал не втягивается в носовые ходы.
Заражение в переднюю камеру глаза. Животное фиксируют спиной кверху.
В конъюнктивальную полость закапывают 1-2 капли 2% раствора новокаина или другого анестетика. Об анестезии глаза свидетельствует исчезновение роговичного рефлекса. Помощник фиксирует голову кролика к поверхности стола на боку и
159
тупым концом пинцета выводит глазное яблоко из глазницы со стороны ее внутреннего угла. Левой рукой захватывают глазное яблоко за конъюнктиву с помощью глазного пинцета, а тонкой иглой, находящейся в правой руке, прокалывают роговицу параллельно радужной оболочке. Иглу медленно продвигают к центру роговицы, пока в ее просвете не окажется жидкость. После истечения 2-3 капель жидкости на иглу надевают шприц и в переднюю камеру глаза вводят 0,05-0,1 мл инфицирующего материала.
Заражение в мозг. Мышей и крыс фиксируют большим и указательным пальцами левой руки за кожу головы, а мизинцем и безымянным пальцем - за хвост. Череп прокалывают иглой, надетой на туберкулиновый шприц, латеральнее средней линии после предварительной обработки кожи 3% спиртовым раствором йода. Кроликам и морским свинкам материал вводят через суборбитальную борозду. Животных фиксируют, кожу освобождают от волос и обрабатывают 3% спиртовым раствором йода, прощупывают борозду, несколько смещают кожу и прокалывают кость у внутреннего угла глаза укороченной иглой (длиной 4-5 мм), направляя ее к срединной линии и вверх. Морских свинок и кроликов можно заражать также через трепанационное отверстие.
После заражения животных помещают в клетки или емкости, закрывающиеся сверху металлической сеткой. Помещение должно быть теплым и сухим. Особенно чувствительны к холоду мыши; морские свинки чувствительны, помимо холода, к повышенной влажности воздуха. Животные должны регулярно получать пищу с достаточным количеством витаминов, воду; за их состоянием нужно систематически следить.
Вскрытие павших животных проводится для извлечения пораженных органов, обнаружения возбудителя, вызвавшего гибель животного, выделения чистой культуры возбудителя и определения места его локализации. Заболевших животных забивают с помощью эфирного наркоза или воздушной эмболии. Вскрытие следует производить как можно раньше после гибели животного, так как кишечная микрофлора быстро проникает в ткани, кровь и органы. При комнатной температуре это происходит через 10-18 часов, а при температуре холодильника - через 20-22 часа, поэтому труп до вскрытия сохраняют на холоде. Животных вскрывают с соблюдением правил асептики, используя только стерильные инструменты.
Перед вскрытием шерсть животного смачивают дезинфицирующим раствором. Трупы вскрывают на доске, помещенной в металлическую кювету с дезинфицирующим раствором. Труп животного кладут на спину, растягивают в стороны лапы, осматривают наружные покровы, отмечая наличие язв, выпадение шерсти и изменение цвета кожи и т. п. Затем труп животного фиксируют к доске иглами или острыми гвоздями (рисунок 163).

160
Рисунок 163 – Фиксация и вскрытие трупа белой мыши. Заимствовано из Интернет-ресурсов.
Вскрытие наружных покровов начинают с продольного разреза кожи от нижней челюсти до лобка. Кожу отделяют от подлежащих тканей, обнажая всю переднюю поверхность туловища животного. Отмечают состояние подкожной клетчатки и лимфатических узлов и при наличии в них изменений делают посевы в питательные среды и препараты-отпечатки (прикасаясь предметным стеклом к месту разреза). Использованные инструменты погружают в дезинфицирующий раствор.
При вскрытии грудной полости всю область, освобожденную от кожи, смачивают спиртом и поджигают. Пинцетом захватывают мечевидный отросток, делают поперечный разрез под ним и два продольных, перерезая ребра в местах их соединения с хрящами. Полученный лоскут в виде треугольника (основание у диафрагмы, а вершина у ключицы) откидывают вверх и изучают состояние органов грудной клетки, отмечают наличие экссудата, делают посев крови и препаратыотпечатки из ткани легких. Кровь из сердца берут пастеровской пипеткой. Предварительно разрезают эпикард и прижигают поверхность мышцы сердца, прикладывая к ней раскаленный скальпель, затем капилляр пипетки вводят в сердце. Кровь, поступившую в капилляр, высевают на питательные среды и используют для приготовления мазков.
Вскрытие брюшной полости производят осторожно, чтобы не захватить петлю кишки. Для этого приподнимают пинцетом брюшную стенку, делают ножницами продольные разрезы от диафрагмы до лобка и два поперечных разреза по направлению к конечностям. Отвернув мышечные лоскуты, исследуют состояние органов брюшной полости, обращая особое внимание на величину, цвет и консистенцию селезенки, печени, надпочечников.
Затем делают посевы из ткани селезенки, печени, брыжеечных лимфатических узлов и экссудата. Поверхность органа прижигают раскаленным скальпелем и в этом участке производят разрез. В месте разреза петлей делают соскоб и высевают в питательные среды. Для приготовления мазка вырезают небольшой кусочек ткани,
