
Методы исследования в медицинской бактериологии
.pdf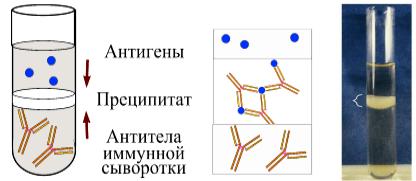
191
9.8. Реакция преципитации и ее варианты
Реакции преципитации (лат. praecipito – осаждать) основаны на феномене образования видимого осадка (преципитата) в растворе или в виде полос преципитации в геле после взаимодействия растворимых антигенов (преципитиногенов) со специфическими антителами (преципитинами). Реакции преципитации проводят в пробирках, в агаре, в гелях. Гелевой основой служат агар, агароза, карбоксиметилцеллюлоза и другие соединения. В качестве реагентов в реакциях преципитации используют гипериммунные преципитирующие сыворотки с высокими титрами антител к гомологичным антигенам.
Выделяют следующие наиболее распространенные разновидности реакции преципитации:
-реакция кольцепреципитации;
-реакции преципитации в геле (реакция простой иммунодиффузии, реакция радиальной иммунодиффузии по Манчини и реакция встречной иммунодиффузии по Оухтерлони);
-иммуноэлектрофорез;
-реакция флоккуляции.
9.8.1.Реакция кольцепреципитации
Реакцию кольцепреципитации проводят в специальных узких преципитационных пробирках (диаметр 0,4-0,5 см, высота 7-8 см). В пробирку вносят 0,2-0,3 мл преципитирующей сыворотки. Затем на слой сыворотки осторожно по стенке пробирки в наклонном положении наслаивают такое же количество жидкости, содержащей растворимый антиген. После этого пробирку осторожно ставят вертикально в штатив. Через несколько секунд наблюдают образование белого кольца преципитата (рисунок 196).
Рисунок 196 – Схема постановки и результат реакции кольцепреципитации. Заимствовано из Интернет-ресурсов.
Разновидностью |
реакции |
кольцепреципитации |
является |
реакция |
термопреципитации |
Асколи на антигены возбудителя сибирской язвы. Реакция |
|||
Асколи позволяет |
обнаруживать |
антигены возбудителя сибирской язвы, |
||
192
экстрагированные кипячением из различного сельскохозяйственного сырья и объектов внешней среды (органы животных, шкуры, шерсть, войлок, мясо, почва и др.). Для постановки этой реакции готовят экстракт антигена из исследуемого материала: исследуемый материал кипятят в изотоническом растворе хлорида натрия в соотношении 1:10 в течение 5-10 минут или экстрагируют антиген карболовой или уксусной кислотой. Экстракт фильтруют через бумажный фильтр или асбестовую вату или центрифугируют при 1000-3000 об/мин. В узкую пробирку для преципитации вносят 0,2-0,3 мл иммунной преципитирующей противосибиреязвенной сыворотки и осторожно наслаивают на нее 0,2-0,3 мл испытуемого экстракта. В течение 10 минут на границе между сывороткой и экстрактом в положительных случаях появляется кольцо помутнения (кольцепреципитация).
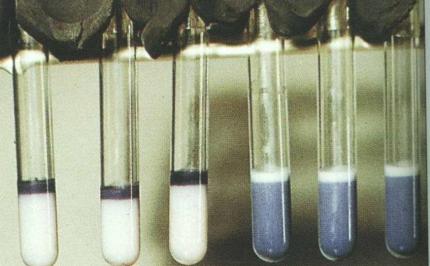
Реакция кольцепреципитации также позволяет выявлять антитела к возбудителю бруцеллеза в молоке животных (кольцевая проба Банга). Сущность кольцевой пробы Банга состоит в том, что при наличии в молоке специфических антител происходит их связывание с окрашенным бруцеллезным антигеном и образование окрашенного кольца. При постановке этой пробы в пробирку с 2 мл молоком вносят 0,1 мл антигена (взвесь убитых бруцелл, окрашенных гематоксилином). Смесь энергично встряхивают и выдерживают при температуре 37-38ОС в течение 1 часа. При наличии в молоке специфических антител происходит связывание бактерий с антителами и образование темно-синего кольца в верхнем слое сливок. При отсутствии антител молоко гомогенно окрашивается в синий цвет, а слой сливок остается белым или слегка желтоватым (рисунок 197).
Рисунок 197 – Положительная (три пробирки слева) и отрицательная (три пробирки справа) кольцевая проба Банга на присутствие бруцелл в молоке. Заимствовано из Интернет-ресурсов.
Кольцевая проба Банга используется для проверки благополучия стада по бруцеллезу крупного рогатого скота и при исследовании молока на наличие бруцелл. Необходимо учитывать, что молоко вакцинированных коров также дает положительную пробу Банга.
193
9.8.2. Реакции преципитации в геле
Реакции преципитации в геле основаны на том, что антигены и антитела, встречаясь в геле, образуют видимые невооруженным глазом белые линии преципитата. Для приготовления геля используют агар или агарозу в количестве 1,5- 2,0%.
Различают следующие разновидности реакций преципитации в геле:
-реакция простой иммунодиффузии;
-реакция радиальной иммунодиффузии по Манчини;
-реакция встречной иммунодиффузии по Оухтерлони.
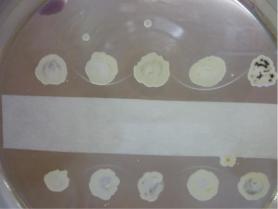
Реакция простой иммунодиффузии (реакция диффузионной преципитации) используется в диагностике дифтерии. При диагностике дифтерии все изоляты возбудителя необходимо тестировать на способность продуцировать дифтерийный экзотоксин. Для этого используют реакцию преципитации в агаре (тест Илека или Элека). При проведении этой реакции на поверхность агара в чашке Петри помещают полоску фильтровальной бумаги, пропитанной антитоксической дифтерийной сывороткой. Вдоль полоски производят посевы исследуемых культур в виде макроколоний (бляшек). Между бляшками исследуемых культур высевают контрольный (лабораторный) заведомо токсигенный штамм возбудителя дифтерии. Через 24-48 часов инкубирования при температуре 37ОС между бляшками и полоской фильтровальной бумаги, пропитанной антитоксической сывороткой, образуются тонкие линии преципитации, свидетельствующие о продуцировании данной культурой дифтерийного экзотоксина (рисунок 198).
Рисунок 198 – Определение токсигенности C. diphtheriae in vitro методом иммунодиффузии. Заимствовано из Интернет-ресурсов.
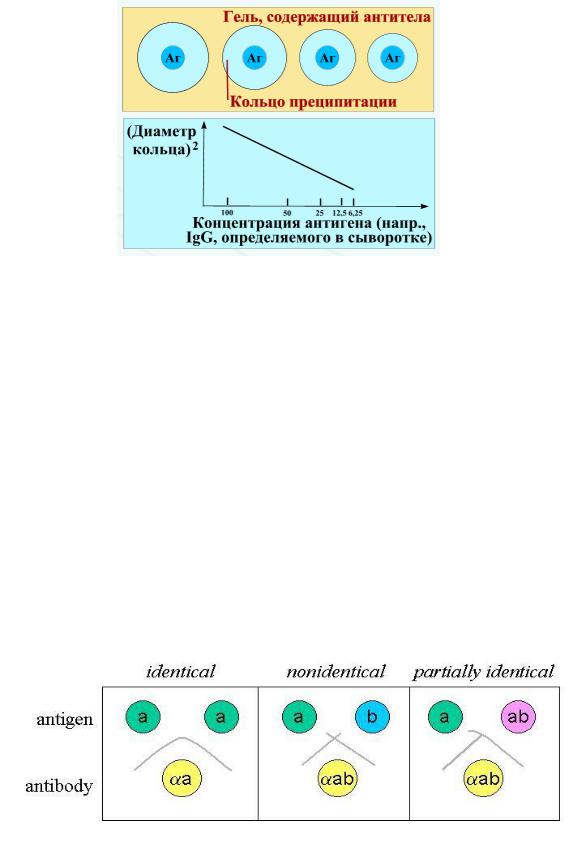
Реакция радиальной иммунодиффузии по Манчини осуществляется следующим образом. Иммунную сыворотку смешивают с расплавленным агаровым гелем и наливают тонким слоем на стеклянную пластину или в чашку Петри. После застывания в геле делают лунки, в которые вносят антиген в разных разведениях. Антиген диффундирует в гель и формирует с антителами кольцевые зоны преципитации вокруг лунок. Диаметр кольца преципитации пропорционален концентрации антигена (рисунок 199).
194
Рисунок 199 – Схема реакции радиальной иммунодиффузии по Манчини. Заимствовано из Интернет-ресурсов.
Реакцию радиальной иммунодиффузии по Манчини используют для определения в сыворотках крови иммуноглобулинов разных классов, компонентов комплемента.
Диаметр кольца преципитации прямо пропорционален количеству внесенного в лунки антигена. Количество антител устанавливают по калибровочной кривой.
Реакция встречной иммунодиффузии по Оухтерлони проводится на стеклянной пластинке. Для этого на пластинку наливают тонкий слой агарового геля и после застывания вырезают лунки. В одни лунки геля вносят антигены, а в другие лунки – иммунные сыворотки. Антигены и антитела диффундируют навстречу друг другу и в месте встречи образуют преципитат в виде белой полосы. У идентичных антигенов линии преципитата сливаются, а у неидентичных антигенов линии преципитации пересекаются (рисунок 200).
|
|
Частично |
Идентичные |
Неидентичные |
идентичные |
Антигены
Антитела
Рисунок 200 – Схема реакции встречной иммунодиффузии по Оухтерлони. Заимствовано из Интернет-ресурсов.

195
9.9. Реакция нейтрализации токсина антитоксином с биопробой на белых мышах
Реакция нейтрализации токсина антитоксином с биопробой на белых мышах предназначалась для выявления ботулинического и столбнячного токсинов. Однако в настоящее время эти реакции в лабораторной клинической практике не используются. Вместо реакции нейтрализации токсина антитоксином с биопробой на белых мышах используют РНГА (см. раздел 9.3).
Для обнаружения ботулинических токсинов для каждой исследуемой пробы используют 4 белых мышей. Первое животное подкожно заражают только исследуемым материалом, а остальных мышей - смесью исследуемого материала с 200 МЕ антитоксической ботулинической диагностической сыворотки типов А, В и Е. Предварительно смеси выдерживают при комнатной температуре в течение 40 минут дня нейтрализации токсина антитоксином. Наблюдение за животными проводят в течение 4 дней. При наличии в материале токсина в течение 4-5 часов погибают все животные, кроме той мыши, которой была введена смесь токсина и гомологичной антитоксической сыворотки (рисунок 201).
Смеси исследуемого материала с антитоксическими сыворотками
Рисунок 201 – Схема постановки биопробы на белых мышах при диагностике ботулизма. Заимствовано из Интернет-ресурсов.
При введении материала, содержащего ботулинический токсин, у мышей отмечается учащенное дыхание, полное расслабление мышц, развивается типичный симптом поражения - “осиная талия” и вытянутое в линию тело и хвост животного (рисунок 202).

196
Рисунок 202 – Внешнее проявление действия ботулинического токсина на белых мышей. Заимствовано из Интернет-ресурсов.
Для обнаружения столбнячного токсина также использовалась реакция биологической нейтрализации (РБН) на белых мышах. В настоящее время эта реакция не используется в клинических лабораториях. Для нейтрализации столбнячного токсина использовали специфическую антитоксическую сыворотку. Подкожное введение мышам фильтрата исследуемого материала при наличии столбнячного токсина наблюдается спазм мышц и искривление тела в сторону места введения токсина (рисунок 203).
Рисунок 203 – Биологическая проба на белых мышах при столбняке. Заимствовано из Интернет-ресурсов.
В настоящее время для обнаружения и идентификации ботулинического токсина используют РПГА с эритроцитарными иммуноглобулиновыми диагностикумами моноспецифическими типов А, В и Е или с диагностикумом ботулиническим эритроцитарным иммуноглобулиновым поливалентным типов А, В и Е. Иммуноглобулиновый (антительный) диагностикум представляет собой эритроциты, сенсибилизированные ботулиническим антитоксином (антитела против ботулинического токсина) соответствующего типа.
Для обнаружения столбнячного токсина также разработаны серологические реакции: реакция непрямой гемагглютинации (РНГА), иммуноферментный анализ (ИФА), реакция латекс-агглютинации и реакция коагглютинации.
197
9.10. Реакция связывания комплемента
Реакция связывания комплемента (РСК) предложена Ж. Борде и О. Жангу. Реакция включает две фазы.
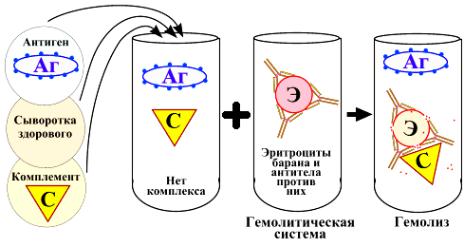
В первой фазе (специфической) искомый антиген (или антитело) реагирует с диагностической антисывороткой (или антигенным диагностикумом). При соответствии антигена и антитела образуется иммунный комплекс “антиген+антитело”. Этот комплекс через Fc-фрагмент антител связывается с комплементом. В случае несоответствия антигена и антитела иммунного комплекса не образуется, и комплемент остается свободным.
Во второй фазе (индикаторной) определяют наличие или отсутствие свободного комплемента путем внесения в реакционную смесь так называемой “гемолитической системы” (эритроцитов барана с антителами к этим эритроцитам). При наличии в смеси свободного комплемента он соединяется с “гемолитической системой” (комплексом “эритроциты+антитела к ним”) и вызывает гемолиз эритроцитов (феномен “лаковой крови”). Такую реакцию считают отрицательной, она характерна для здорового человека (рисунок 204).
Рисунок 204 – Отрицательная РСК (Воробьев А.А., Быков А.С., 2003).
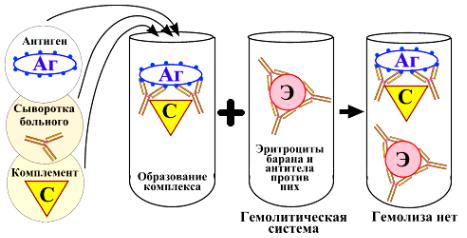
При отсутствии в смеси свободного комплемента разрушения эритроцитов (гемолиза) не наблюдается, эритроциты оседают на дно пробирки в виде осадка. Такую реакцию считают положительной (рисунок 205).
198
Рисунок 205 – Положительная РСК (Воробьев А.А., Быков А.С., 2003).
В РСК используются следующие компоненты:
-испытуемая сыворотка, инактивированная прогреванием при температуре 56ОС в течение 30 минут;
-антиген (взвесь убитых микробов, лизат микробов, полные антигены, гаптены, экстракты тканевых липидов);
-комплемент (свежая или высушенная сыворотка крови морских свинок; перед постановкой РСК проводят титрование комплемента в реакции гемолиза и определение рабочей дозы);
-гемолитическая сыворотка (прогретая при температуре 56ОС сыворотка крови кроликов, иммунизированных 50% взвесью эритроцитов барана);
-3% взвесь эритроцитов барана;
-физиологический раствор;
-контрольная сыворотка.
Основными недостатками РСК является сложность проведения и лабильность некоторых компонентов. Однако РСК до сих пор применяют в диагностике некоторых заболеваний, в частности, при диагностике сифилиса (реакция Вассермана), хронической гонореи (реакция Борде-Жангу), при идентификации бактерий.
Реакция Вассермана (RW) основана на способности сыворотки крови больного сифилисом человека (в отличие от сыворотки крови здоровых лиц) образовывать со специфическими антигенами (трепонемным и кардиолипиновым антигенами) комплекс, связывающий комплемент. При постановке РСК с трепонемным антигеном (РСКт) используется озвученный ультразвуком антиген, полученный из нескольких штаммов бледной трепонемы. При постановке РСК с кардиолипиновым антигеном (РСКк) применяют антиген, представляющий собой высокоочищенный спиртовой экстракт из мышц бычьего сердца.
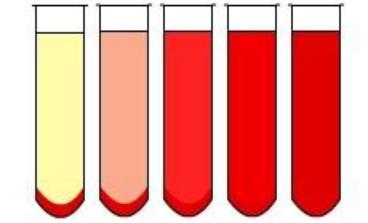
Реакция Вассермана оценивается по степени задержки гемолиза. Положительная реакция отмечается при частичной, выраженной и полной задержке гемолиза. Положительная реакция определяется по степени окрашивания содержимого пробирок от светло-розового до ярко-красного. Негемолизированные эритроциты впоследствии образуют осадок красного цвета (рисунок 206).
199
а б в г д Рисунок 206 – Оценка реакции Вассермана: а – полная задержка гемолиза (++++); б
– выраженная задержка гемолиза (+++); в – частичная задержка гемолиза (++); г – слабая задержка гемолиза (+); д – полный гемолиз (-). Заимствовано из Интернетресурсов.
Реакция Вассермана может быть отрицательной в первичном серонегативном
ивторичном рецидивном сифилисе, а также ложноположительной при токсикозах беременных, при злокачественных новообразованиях.
Внастоящее время при диагностике сифилиса используется реакция связывания комплемента с кардиолипиновым антигеном (РСКк).
Реакция Борде-Жангу используется для диагностики хронической гонореи с целью обнаружения антител к гонококку. В реакции используются две системы: основная система – сыворотка крови пациента, антиген (взвесь убитых гонококков)
икомплемент (сыворотка крови морской свинки); вспомогательная система (индикаторная или гемолитическая) – эритроциты барана и гемолитическая сыворотка (сыворотка кроликов, иммунизированных эритроцитами барана).
Вначале в 2 пробирки вносят испытуемую сыворотку. Затем в одну из них добавляют антиген, а в другую – физиологический раствор. После этого в обе пробирки добавляют комплемент. Компоненты реакции смешивают, и пробирки помещают в термостат при температуре 37ОС на 30 минут (либо в холодильник при температуре минус 4ОС на 18 часов). Затем в пробирки добавляют гемолитическую систему, и пробирки помещают в термостат на 2 часа. Предварительный результат учитывают по истечении времени инкубирования в термостате. Окончательный результат учитываю на следующий день после выдерживания пробирок при комнатной температуре. Степень интенсивности реакции оценивается в плюсах: полная задержка гемолиза – 4 плюса, неполная – три плюса, два плюса, один плюс, полный гемолиз обозначается минусом.
Реакцию Борде-Жангу становится положительной с 3-4 недели заболевания. При острой форме болезни она положительна у 35% больных, при хронической форме - у 65% (слабоположительная у 100%). В качестве антигена для РСК применяют гоновакцину или антиген из убитых гонококков. Однако реакция БордеЖангу имеет вспомогательное значение, она непригодна для доказательства гонококковой инфекции и установления излеченности. Поэтому в последние годы эта реакция используется крайне редко.
200
9.11. Иммунохроматографический анализ
Иммунохроматографический анализ (ИХА) представляет собой иммунохимический метод, основанный на принципе тонкослойной хроматографии и включающий реакцию между антигеном и соответствующим ему антителом. ИХА проводится с помощью специальных тест-полосок, панелей или тест-кассет. ИХА основан на современных технологиях получения моноклональных и поликлональных антител к специфическим антигенам. ИХА обладает относительно невысокой чувствительностью, но при этом крайне прост в исполнении, а учет результатов осуществляется визуально и не требует наличия сложных дорогих приборов и высокой квалификации исполнителя. Особенно удобен этот метод в условиях поликлинического звена.
Принцип метода состоит в том, что образец (цельная кровь, сыворотка крови, плазма крови, моча, экстракт тканей или фекалий), нанесенный на подложку, движется по мембране и доходит до зоны, где находятся специфически связывающиеся агенты (антитела или антигены). Здесь происходит специфическое связывание тестируемого белка (антигена), находящегося в образце, со специфическими антителами к нему. При наличии тестируемого белка в пробе на мембране появляются одна или две четко окрашенные полосы, свидетельствующие о негативном или позитивном результате теста (конкретная информация – в инструкциях к каждому тесту). Для визуализации комплексов “антиген - антитело” используются конъюгированные красители на основе коллоидного золота.
Преимущества использования иммунохроматографических тест-полосок:
-простота и удобство – метод позволяет получить результат (анализ и первичное представление о причине заболевания) без оборудования и специальных навыков;
-надежность – достоверность тестов достигает 100%, при этом каждый тест имеет встроенный внутренний контроль;
-анонимность – что особенно важно при выявлении заболеваний, передаваемых половым путем, других инфекционных заболеваний, а также при выявлении фактов употребления наркотических веществ;
-независимость – не требует предварительной медицинской консультации и рецепта врача.
Различают 2 варианта ИХА: прямой и конкурентный метод.
В прямом (сэндвичном) ИХА используется конъюгат антитела и метки, нанесенный на мембрану. На тестовой линии иммобилизованы антитела, специфические к данному аналиту, а на контрольной линии – антивидовые антитела, специфические к первичным антителам. При нанесении образца, содержащего анализируемое вещество, при попадании образца на мембрану с конъюгатом, происходит связывание аналита с конъюгатом антитела и метки. Затем иммунный комплекс попадает в тестовую зону, где он связывается со специфическими антителами, образуя “сэндвич” (антитело-антиген-антитело-метка). Избыток несвязавшегося конъюгата связывается с антивидовыми антителами на контрольной линии. Таким образом, выявление 2-х линий на тест-полоске является положительным результатом теста. При отсутствии аналита в образце конъюгат
