
Методы исследования в медицинской бактериологии
.pdf161
берут его пинцетом и прикасаются к поверхности предметного стекла (препаратотпечаток) или распределяют по стеклу тонким слоем.
После вскрытия труп животного утилизируют после автоклавирования. Все инструменты, кювету и доску для фиксации обрабатывают дезинфицирующими растворами или стерилизуют.
8.3. Определение вирулентности бактерий
При изучении свойств микроорганизмов в ряде случаев определяют их вирулентность. Это необходимо для характеристики возбудителей, выделенных от больных, бактерионосителей и из внешней среды, установления остаточной вирулентности живых вакцин, выявления напряженности иммунитета у животных и т. д.
Вирулентность выражают количественно в виде летальной или инфицирующей дозы:
-DLm (Dosis letalis minima) - минимальная летальная доза - минимальное количество возбудителя, вызывающее гибель 95% взятых в опыт лабораторных животных;
-DCL (dosis certae letalis) - абсолютно летальная доза - минимальное количество возбудителя, вызывающее гибель 100% взятых в опыт лабораторных животных;
-LD50 - минимальное количество возбудителя, вызывающее гибель 50% взятых в опыт лабораторных животных.
LD50 является более достоверным показателем вирулентности, так как в меньшей степени зависит от индивидуальной чувствительности животных. При
определении LD50 вид, пол, вес животных, условия содержания, кормления должны быть строго стандартизованными. Для определения LD50 из культуры бактерий готовят 10-кратные разведения, каждое из которых вводят не менее чем 5-10 животным. Через определенный промежуток времени отмечают количество погибших
животных в каждой группе и вычисляют LD50. Для вычисления LD50 существует несколько методов. Наиболее распространенным является расчет величины LD50 по методу Кербера в модификации И.П. Ашмарина по формуле:
lg LD50 = lgDmax – lgN·(ΣLi – 0,5), где
Dmax – максимальная из использованных доз; N – кратность разведения доз;
Li – отношение числа погибших от данной дозы животных к общему числу животных, которым была введена эта доза;
ΣLi – сумма отношений Li.
В настоящее время определение вирулентности бактерий проводят только в лабораториях научно-исследовательских организаций.
162
Многие патогенные свойства микроорганизмов коррелируют с легко выявляемыми in vitro фенотипическими признаками (маркерами вирулентности). Поэтому в ряде случаев для определения вирулентности достаточно обнаружить такие признаки у исследуемых культур. Так, у энтеропатогенных иерсиний (возбудителей иерсиниоза и псевдотуберкулеза) определяют кальций-зависимость роста при 37°С (на кальций-дефицитной среде), у возбудителей кишечных и мочевых эшерихиозов - соответствующие адгезины (в реакции агглютинации), у дифтерийной палочки - экзотоксин (в реакции иммунодиффузии) и т.д.
163
9. Иммунодиагностические реакции
Одним из широко применяемых в диагностике инфекций является серологический (лат. serum – сыворотка, logos – учение) метод, в основе которого лежит взаимодействие антигенов и антител. Этот метод позволяет выявлять неизвестные антигены микроорганизмов при взаимодействии с известными антителами или неизвестные антитела при взаимодействии с известными антигенами. Результатом взаимодействия антигенов и антител может быть образование осадка в результате склеивания частиц, лизис клеток, набухание капсул и др. Наибольшую ценность эти методы имеют в тех случаях, когда выделить возбудитель не представляется возможным, но можно определить наличие антигенов возбудителя.
В иммунологической диагностике применяют специфические препараты – диагностические сыворотки и диагностикумы.
Диагностические сыворотки представляют собой иммунные сыворотки, содержащие антитела известной специфичности в известном титре. Диагностические сыворотки получают путем иммунизации (гипериммунизации) животных соответствующими антигенами.
Диагностикумы представляют собой взвесь в физиологическом растворе известных микроорганизмов или извлеченных из них антигенов.
Иммунологическая диагностика инфекционных заболеваний проводится с целью обнаружения в сыворотке крови антител или для обнаружения в биологических жидкостях, в тканях или в пробах из внешней среды антигенов возбудителей.
Для иммунологического исследования используют сыворотки крови пациентов, чистые культуры микроорганизмов, выделенные от больного или из объектов внешней среды, патологический материал от больного (соскобы, пунктаты) для экспресс-обнаружения антигенов микроорганизмов.
Достоинства иммунологического исследования:
-высокая специфичность (способностью антигенов взаимодействовать только с гомологичными антителами);
-высокая чувствительность (реакция агглютинации выявляет 100 мг антител
в1 л, ИФА и РИА выявляют до 0,00001 мг антител в 1 л);
-возможность проведения ретроспективных эпидемиологических исследований на основании обнаружения антител;
-быстрота получения результатов (результаты при реакции агглютинации на стекле выявляются через 5 минут, результаты ИФА, РИА – через 4 часа, РП в геле – через 24 часа).
Выявление и идентификацию возбудителей по их антигенным свойствам проводят в реакциях агглютинации (ориентировочной агглютинации, коагглютинации, латексной агглютинации), преципитации и ее модификациях, иммунофлюоресценции (прямой или непрямой варианты).
Антитела к возбудителю определяют в таких серологических реакциях как развернутая реакция агглютинации, реакция непрямой гемагглютинации, реакция преципитации, реакция связывания комплемента, иммуноферментный анализ и др.
164
Широкое распространение в настоящее время в лабораторной практике получили методы латекс-агглютинации и серологические реакции с использованием метки (реакция иммунофлюоресценции - РИФ, иммуноферментный анализ - ИФА и иммуноблоттинг - ИБ).
9.1. Реакция агглютинации и ее разновидности
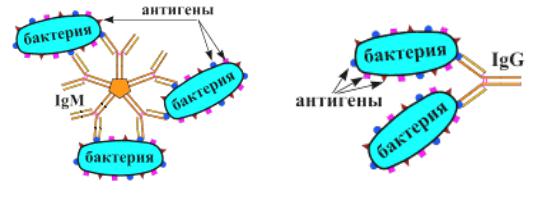
Реакция агглютинации (лат. agglutination – склеивание) позволяет выявлять корпускулярные антигены, то есть антигены, локализованные на поверхности крупных частиц (микроорганизмов, клеток различного происхождения, неорганических частиц). Механизм реакции агглютинации (РА) заключается в том, что антитело взаимодействует одним активным центром с антигенной детерминантой одной молекулы антигена, а другим активным центром - с антигенной детерминантой второй молекулы антигена. В результате подобного взаимодействия образуется агглютинат (рисунок 164).
Рисунок 164 – Варианты реакции агглютинации бактерий с различными антителами. Заимствовано из Интернет-ресурсов.
Реакция агглютинации проявляется склеиванием корпускулярных антигенов (агглютиногенов) с антителами (агглютининами) и реализуется в изотоническом растворе электролита, например в 0,9% растворе хлорида натрия. Реакция агглютинации проявляется выпадением осадка (агглютината). Реакция агглютинации проводится либо на стекле (ориентировочная или пластинчатая реакция агглютинации), либо в пробирках (развернутая реакция агглютинации).
9.1.1. Ориентировочная (пластинчатая) реакция агглютинации на стекле
Ориентировочная (пластинчатая) реакция агглютинации позволяет идентифицировать возбудителя с помощью известной сыворотки или определить антитела в сыворотке крови с помощью известных антигенов (бактерий). При определении возбудителя используют агглютинирующую диагностическую сыворотку, а при определении антител – антигенный диагностикум.
165
Диагностические агглютинирующие сыворотки содержат известные антитела. Их получают путем многократной иммунизации (гипериммунизации) лабораторных животных (чаще всего - кроликов) соответствующими антигенами. В качестве антигенов выступают либо целые микробные клетки, убитые нагреванием или обработкой формалином, либо очищенные отдельные антигены бактерий (О, К, Н). Для получения антитоксической диагностической сыворотки иммунизацию осуществляют соответствующим анатоксином. Гипериммунизацию животных проводят внутривенно, подкожно или внутрибрюшинно взвесью убитых бактерий, начиная с дозы 200 млн., затем 500 млн., 1 млрд., 2 млрд. микробных тел в 1 мл, с интервалами 5 дней. Через 7-8 дней после последней инъекции у животных забирают кровь и определяют титр антител. Титром агглютинирующей сыворотки называется то максимальное разведение сыворотки, при котором происходит агглютинация с соответствующим антигеном.
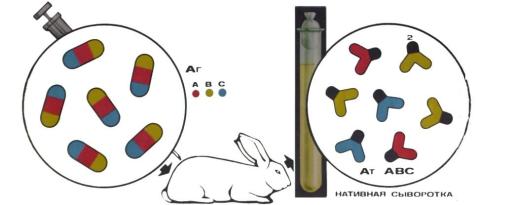
После гипериммунизации сыворотка животных содержит антитела ко всем антигенам бактерий, поэтому ее называют “нативной” или “неадсорбированной” сывороткой (рисунок 165).
Антигены А В С
Нативная сыворотка Антитела А В С
Рисунок 165 – Получение нативной сыворотки. Заимствовано из Интернет-ресурсов.
Нативная сыворотка способна агглютинировать все бактерии той же группы (семейства, рода). Групповая агглютинация затрудняет определение вида выделенного микроба и серологическую диагностику заболевания. Неадсорбированные агглютинирующие сыворотки обладают высоким титром - до
1:12800 - 1:25600.
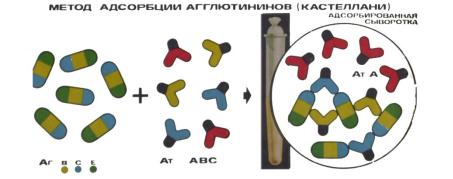
Для выделения из нативной сыворотки антител к отдельным антигенам используют метод адсорбции по Кастеллани. Метод адсорбции по Кастеллани состоит в том, что при добавлении к нативной агглютинирующей сыворотке родственных бактерий происходит адсорбция (связывание) групповых антител при свободном состоянии видовых специфических антител. В зависимости от полноты истощения групповых агглютининов можно получить монорецепторные сыворотки (сыворотки, имеющие антитела только к одному антигену) или поливалентные сыворотки (сыворотки, дающие реакцию агглютинации с двумя - тремя родственными бактериями). В качестве адсорбента могут применяться живые или убитые бактерии. Наилучшей адсорбционной способностью обладает живая культура. Вначале нативная сыворотка выдерживается с адсорбентом в термостате
166
при 37ОС в течение 2-18 часов, затем в холодильнике в течение 6-20 часов. Истощаемая сыворотка после каждой адсорбции проверяется в реакции агглютинации на стекле как с культурами того вида, которыми ведется истощение, так и с родственными культурами.
Адсорбированные моновалентные (монорецепторные) сыворотки содержат антитела только к одному виду антигенов (рисунок 166).
Антитела А
Антигены |
|
В С Е |
Антитела АВС |
|
Рисунок 166 – Метод адсорбции агглютиногенов по Кастеллани. Заимствовано из Интернет-ресурсов.
Полностью адсорбированные сыворотки освобождаются от микробных клеток путем центрифугирования. Затем к ней добавляют консервант и фильтруют через стерилизующий бактериальный фильтр. После выдерживания в течение 2 суток при комнатной температуре сыворотка проверяется на стерильность, специфичность и величину титра.
Агглютинирующие сыворотки наиболее широко применяются при диагностике заболеваний, вызываемых бактериями семейства Enterobacteriaceae. Например, при идентификации эшерихий используются поливалентные и типовые ОК-сыворотки. При дифференциации сальмонелл используют набор сывороток. В частности, агглютинирующая адсорбированная поливалентная сальмонеллезная О- сыворотка (групп А, В, С, Д, Е) предназначена для определения принадлежности к отдельным группам рода Salmonella. В случае положительного результата определяют серологическую группу отдельно с каждой сывороткой (входящей в смесь), а затем устанавливают серологический тип выделенного возбудителя с монорецепторными Н-сыворотками сальмонелл, входящих в данную группу.
Антигенные диагностикумы содержат известные антигены бактерий. Антигенные диагностикумы представляют собой инактивированные нагреванием или воздействием формалина цельные микробные клетки (корпускулярные антигены), или выделенные тем или иным способом и очищенные антигенные субстанции микробов (молекулярные антигены), сорбированные на частицах нейтрального носителя (эритроциты, латекс, целлюлоза и др.). Антигенные диагностикумы используются при постановке серологических реакций (прямых или непрямых). Они предназначены для определения антител к возбудителям инфекционных заболеваний в пробах сыворотки крови.
Для постановки ориентировочной реакции агглютинации при идентификации бактерий необходимо 3 компонента: антиген (агглютиноген, неизвестный микроб), антитело (агглютинин, диагностическая агглютинирующая сыворотка) и электролит

167
(изотонический раствор хлорида натрия). Ориентировочная реакция агглютинации проводится на предметном стекле при комнатной температуре. Для этого на обезжиренное предметное стекло пастеровской пипеткой наносят каплю диагностической сыворотки в разведении 1:10 - 1:20 и каплю раствора хлорида натрия (контроль). Бактериологической петлей берут чистую культуру исследуемого микроорганизма с поверхности скошенного агара (или часть изолированной колонии, или каплю бульонной культуры), переносят как в каплю сыворотки, так и в каплю раствора хлорида натрия и перемешивают. Результат реакции учитывают визуально через 3-5 минут или с помощью лупы (увеличение х5). При положительной реакции в капле прозрачной сыворотки отмечают появление хлопьев (крупных или мелких), особенно хорошо видимых на темном фоне при покачивании предметного стекла. В случае отрицательной реакции жидкость остается равномерно мутной (рисунок 167).
Рисунок 167 - Ориентировочная реакция агглютинации на стекле. Заимствовано из Интернет-ресурсов.
В зависимости от природы антигена (О-антиген или Н-антиген) различают О- агглютинацию и Н-агглютинацию. Соматические О-антигены термостабильные и выдерживают кипячение в течение 2 часов. При взаимодействии с антителами образуют мелкие плотные зерна. О-агглютинация проявляется медленно. Н- антигены (жгутиковые) термолабильные, быстро разрушаются при 100°С, а также под действием этанола. В реакциях с Н-антисывороткой Н-антигены образуют рыхлые крупные хлопья (образованы бактериями, склеившимися между собой посредством антител, прикрепившихся к жгутикам). Н-агглютинация проявляется
быстро (рисунок 168). |
|
О-агглютинация |
Н-агглютинация |
а б Рисунок 168 – О-агглютинация (а) и Н-агглютинация (б) бактерий. Заимствовано из
Интернет-ресурсов.
168
При определении антител в сыворотке крови с помощью известных антигенов можно использовать О-диагностикум и Н-диагностикум. О- диагностикум представляет собой взвесь бактерий, убитых нагреванием. Н- диагностикум представляет собой взвесь бактерий, убитых формалином. При обработке формалином сохраняется Н-антиген (жгутиковый антиген бактерий).
Разновидностями реакции агглютинации для выявления антител являются кровяно-капельная проба на туляремию и реакция Хаддльсона на бруцеллёз.
Кровяно-капельная проба на туляремию представляет собой реакцию агглютинации на стекле. В качестве антигена используют туляремийный диагностикум. При наличии у больного антител к возбудителю туляремии при смешивании сыворотки крови с антигеном на стекле немедленно наступает реакция агглютинации.
Реакция Хаддльсона на бруцеллёз представляет собой метод экспрессдиагностики бруцеллеза. Для проведения этой реакции каплю сыворотки крови помещают на предметное стекло и смешивается с бруцеллезным диагностикумом. В контроле капля сыворотки смешивается с физраствором. Положительная реакция проявляется образованием хлопьев (агглютината).
9.1.2. Развернутая реакция агглютинации
Развернутая реакция агглютинации может использоваться как для определения антител и установления их титров в сыворотке крови, так и для определения антигенов (возбудителя).
Для определения антител и их титров в сыворотке крови больного развернутую реакцию агглютинации проводят следующим образом. К серии разведений сыворотки крови добавляют антигенный диагностикум - взвесь известных убитых микроорганизмов или частицы с сорбированными на них известными антигенами. Максимальное разведение, дающее агглютинацию антигена, называют титром сыворотки крови. При постановке развернутой реакции агглютинации в ряд агглютинационных пробирок вносят по 1 мл физиологического раствора. В первую пробирку прибавляют равный объем исследуемой сыворотки крови. Готовят последовательные двукратные разведения сыворотки (титрование сыворотки), после чего в каждую пробирку вносят по 2 капли взвеси инактивированных бактерий (антигенный диагностикум), содержащей до 3 млрд. микробных тел в 1 мл. Пробирки помещают на 2 часа в термостат при температуре 37ОС. Реакция протекает с образованием мелких хлопьев, невидимых невооруженным глазом, поэтому учет результатов проводят под небольшим увеличением, используя для этого иногда специальный прибор –
агглютиноскоп (рисунок 169).

169
Рисунок 169 – Агглютиноскоп. Заимствовано из Интернет-ресурсов.
Интенсивность агглютинации учитывают по системе “четыре плюса”: полная агглютинация обозначается 4+, частичная агглютинация – 3+ или 2+, сомнительный результат - +. В контрольных пробирках агглютинации не должно быть. За титр антител в исследуемой сыворотке принимают последнее разведение, в котором наблюдается агглютинация на 2+ (рисунок 170).
Агглютинация |
Контроль |
Контроль |
|
|
|
|
сыворотки |
антигена |
Рисунок 170 - Развернутая РА для определения титра антител в сыворотке крови. Заимствовано из Интернет-ресурсов.
При определении возбудителя к разведениям агглютинирующей сыворотки добавляют взвесь бактерий, выделенных от больного. Положительная реакция проявляется образованием хлопьевидного осадка.
Реакцию агглютинации в пробирках (развернутую реакцию агглютинации) проводят для определения титра антител к возбудителям брюшного тифа и паратифов (реакция Видаля), бруцеллеза (реакции Райта).
Реакция Видаля предназначена для определения титра антител в сыворотке крови к возбудителям брюшного тифа и паратифов. Реакцию проводят следующим образом. Сыворотку крови разводят изотоническим раствором хлорида натрия (например, 1:20, 1:40, 1:80 и так далее). Затем к разведениям сыворотки крови добавляют О-диагностикум (культура бактерий, убитая спиртом или кипячением) или Н-диагностикум (культура бактерий, убитая формалином). Реакция Видаля с Viантигеном не используется, так как Vi-агглютинины появляются в сыворотке
170
больного нерегулярно и в невысоких титрах. Результаты Н-агглютинации учитываются через 2 часа инкубирования в термостате, а результаты О- агглютинации – через 2 часа пребывания в термостате и 18-24 часа – при комнатной температуре. Диагностическим титром реакции Видаля считают разведение сыворотки 1:200.
Реакция Райта предназначена для определения титра антител в сыворотке крови больных бруцеллезом. Сыворотку крови разводят изотоническим раствором хлорида натрия (например, 1:50, 1:100, 1:200 и так далее). К разведениям сыворотки крови добавляют единый бруцеллезный диагностикум (взвесь убитых бруцелл), содержащий в 1 мл 1 млрд. микробных клеток. Диагностическим считается титр выше 1:200.
9.1.3. Реакция коагглютинации
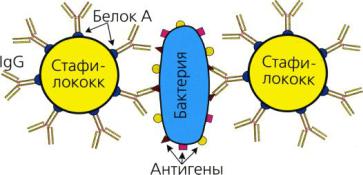
Реакция коагглютинации (РКоА) основана на способности белка А золотистого стафилококка неспецифически связывать Fc-фрагменты иммуноглобулинов, оставляя свободными их Fab-фрагменты. На этом принципе основано изготовление диагностикумов, состоящих из стафилококков с сорбированными на их поверхности известными антителами. При добавлении к такому диагностикуму соответствующих антигенов происходит их связывание с активными центрами антител (Fab-фрагментами). В результате такой коагглютинации образуются хлопья, состоящие из стафилококков, антител диагностической сыворотки и антигенов исследуемого микроба (рисунок 171).
Рисунок 171 – Схема реакции коагглютинации (Воробьев А.А. и др., 2006).
Реакцию коагглютинации используют для определения вида шигелл. Эту реакцию можно проводить уже на второй день исследования при наличии на среде с лактозой лактозонегативных колоний. С этой целью на типичную колонию наносят каплю суспензии белка А стафилококка, сенсибилизированного антителами против шигелл. Чашку осторожно покачивают и через 15 минут под микроскопом наблюдают появление агглютината.
Реакция коагглютинации используется также для идентификации холерных вибрионов. В этом случае она проводится на стекле с помощью диагностикумов, коагглютинирующих О1 и О139 холерные вибрионы. Эти
