
Методы исследования в медицинской бактериологии
.pdf
41
При исследовании на кишечную и тифо-паратифозную группу (сальмонеллы, шигеллы) применяют мазок из прямой кишки. В этом случае забор материала производят в пробирку со средой Кэри-Блейр.
При отборе испражнений из судна стараются отобрать слизь, гной, фибриновые пленки. При отборе испражнений петлей или тампоном целесообразно сразу же сделать посев материала на питательную среду. При невозможности проведения посева у постели больного допускается смыть материал с петли или тампона в пробирку со стерильным физраствором для отправки в лабораторию.
Желчь (10–20 мл) отбирают во время дуоденального зондирования. В отдельные пробирки собирают все три порции желчи (А, В и С). Конец зонда предварительно обрабатывают спиртом, затем после выделения 1–2 мл желчи (для исследования не используется) наполняют пробирки непосредственно через зонд или с помощью стерильного шприца.
Мочу (20–30 мл) собирают в стерильную, плотно закрывающуюся посуду при помощи стерильного катетера после предварительного обмывания половых органов с мылом и ополаскивания их стерильным физраствором. Для бактериологического исследования мочи используют среднюю порцию мочи в количестве 20-40 мл. Для сбора мочи на бакпосев используют также вакуумную систему для сбора мочи и систему UriSwab с тампоном-губкой (рисунок 34).
а б
Рисунок 34 – Емкости для отбора мочи (а) и система UriSwab с тампоном-губкой (б). Заимствовано из Интернет-ресурсов.
Трупный материал забирается при вскрытии трупа. Для этого поверхность внутренних органов прижигают раскалённым пинцетом, затем вырезают кусочки органов 1–2 см3.
При подозрении на анаэробную инфекцию (неприятный запах отделяемого, гнилостный характер поражения, экссудат серо-зеленого цвета, наличие газа в тканях и др.) материал отбирают во время вскрытия или дренирования очага в строго анаэробных условиях. Содержимое замкнутых полостей пунктируют стерильным шприцем, и материал вносят во флакон с бескислородной газовой смесью либо в специальную транспортную среду для анаэробов. При анаэробной инфекции не допускается отбор проб с помощью тампонов и с поверхности ран.

42
Для транспортировки исследуемого материала в лабораторию используют специальные транспортные среды: Эймса, Кэри-Блейр, Стюарта. Среды выпускаются в индивидуальных упаковках, стерилизованы оксидом этилена, стик (палочка) полистироловый, тампон вискозный.
Транспортная среда Эймса (Amies) содержит агар и набор солей (натрия хлорид, динатрия гидрофосфат, калия дигидрофосфат, калия хлорид, магния хлорид, натрия тиогликолят). Она используется для транспортировки широкого круга биоматериалов: отделяемого из наружного уха (на аэробные и факультативно анаэробные микроорганизмы), слизи и пленок из носа и зева (на возбудителя дифтерии, стафилококк, возбудителей коклюша и паракоклюша, гемолитический стрептококк и др.), отделяемого раневых поверхностей (на аэробные и факультативно анаэробные микроорганизмы), отделяемого урогенитального тракта (на гонококк) и др. Среда Эймса позволяет более 3 дней поддерживать жизнеспособность таких микроорганизмов как Neisseria, Haemophilus,
Corynebacterium, Streptococcus, Enterobacteriaceae (рисунок 35).
Рисунок 35 – Транспортная среда Эймса. Заимствовано из Интернет-ресурсов.
Транспортная среда Кэри-Блейр (Cary-Blair) содержит агар и соли (натрия хлорид, динатрия гидрофосфат, кальция хлорид, натрия тиогликолят). Среда предназначена для транспортировки возбудителей кишечных инфекций (рисунок 36). Среда Кэри-Блейр позволяет сохранять большинство патогенов, включая требовательные микроорганизмы (Neisseria sp., Haemophilus sp., Streptococcus sp.).
Данная среда является стандартной для транспортировки анаэробов.

43
Рисунок 36 – Транспортная среда Кэри-Блейр. Заимствовано из Интернет-ресурсов.
Транспортная среда Стюарта (Stuart) содержит агар, натрия тиогликолят, натрия глицерофосфат, кальция хлорид и метиленовый синий. Среда предназначена для сохранения и транспортировки широкого спектра патогенных бактерий
(Neisseria gonorrhoeae, Haemophilus influenzae, Corynebacterium diphtheriae и др.).
Наиболее требовательные микроорганизмы сохраняются в данной среде сутки, остальные – несколько дней. Наличие в среде тиогликолата натрия подавляет ферментативную активность бактерий, а отсутствие азота предотвращает их размножение (рисунок 37).
Рисунок 37 – Транспортная среда Стюарта. Заимствовано из Интернет-ресурсов.
Материал для микробиологического исследования от пациента может быть отобран в лаборатории, в процедурном кабинете или в кабинете лечащего врача. Отобранный материал отправляют в лабораторию не позднее 24 часов с момента забора в биксах или в специальных контейнерах (рисунок 38).

44
УКП-50-1 |
УКП-50-2 |
УКП-120 |
Рисунок 38 – Укладка-контейнер для доставки биоматериалов в лабораторию. Заимствовано из Интернет-ресурсов.
Транспортировку биологического материала в лабораторию проводят при соблюдении температурного режима. При невозможности быстрой доставки пробы в лабораторию материал хранят в холодильнике при температуре плюс 4ОС. Материал без консерванта допускается хранить в холодильнике при температуре +4ОС в течение 1-2 суток, а консервированные в 50% глицерине кусочки органов – в течение нескольких недель.
При необходимости транспортировку биологического материала в лабораторию осуществляют в термоконтейнерах (рисунок 39).
Рисунок 39 – Медицинский термоконтейнер. Заимствовано из Интернет-ресурсов.
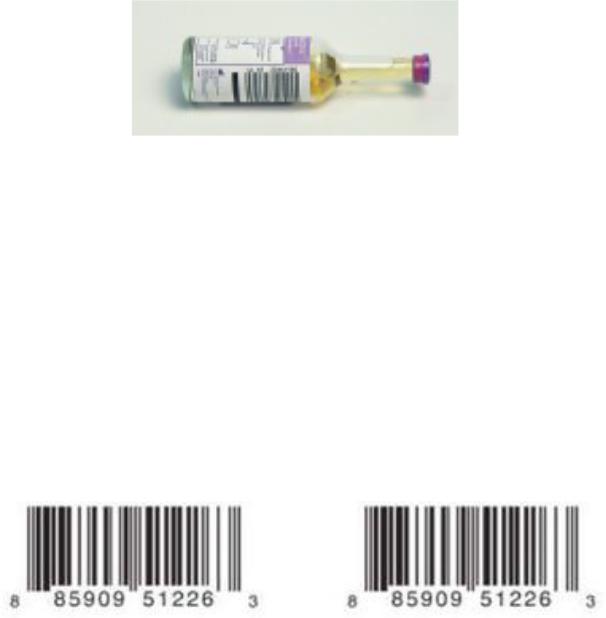
Материал, содержащий анаэробные бактерии, транспортируют в условиях, исключающих воздействие кислорода. Для взятия такого материала используют специальные флаконы, заполненные бескислородной газовой смесью и специальной транспортной средой (рисунок 40).
45
Рисунок 40 – Флаконы для культивирования анаэробов. Заимствовано из Интернетресурсов.
Не подлежат исследованию на анаэробы отделяемое поверхностных ран и язв, мазки из зева, носа и ротовой полости, мазки из влагалища и цервикального канала, мокрота и бронхиальные смывы, фекалии (за исключением предполагаемой Clostridium difficile-ассоциированной диареи).
На транспортировочной таре должна быть этикетка с указанием фамилии больного и даты забора материала. В сопроводительном документе (направлении) обязательно указывают название медицинского учреждения, направившего материал, вид материала, цель исследования, фамилию больного, возраст больного, предполагаемый клинический диагноз.
В настоящее время маркировка бланка-направления и пробы с биологическим материалом унифицирована. Для маркировки используют 2 штрихкода с одинаковым номером (рисунок 41).
Рисунок 41 – Штрих-коды для маркировки направления и пробы. Заимствовано из Интернет-ресурсов.
Один штрих-код наклеивают на бланк-направление в специально предназначенное для этого место, а другой штрих-код наклеивают на пробу. К маркировке бланка-направления и пробы предъявляются определенные требования, которые необходимо строго соблюдать (рисунок 42).

46
Рисунок 42 – Маркировка флаконов и пробирок. Заимствовано из Интернетресурсов.
Для маркировки предметных стекол используют специальные уменьшенные штрих-коды. При этом штрих-код наносится на шлифованную часть стекла.
При взятии материала для проведения бактериологического исследования необходимо соблюдать следующие правила:
-биологический материал для исследования отбирается непосредственно из очага инфекции; в случае отсутствия четко выраженного очага исследуют жидкости организма (кровь, мочу, спинномозговую жидкость);
-материал для исследования отбирают до начала антибактериальной терапии или через определенный промежуток времени, необходимый для выведения антимикробного препарата из организма (от 8 часов до 3 суток в зависимости от препарата и предполагаемого возбудителя);
-отбор материала производят во время наибольшего содержания в нем возбудителя заболевания (например, кровь для выделения гемокультуры при повышении температуры в начале периода озноба);
-при отборе материала необходимо соблюдать правила асептики во избежание контаминации пробы представителями нормальной микробиоты организма и микроорганизмами из окружающей среды;
-отбор материала производят стерильными ватными тампонами, шприцами, другими специальными приспособлениями (петлями, трубками) в стерильную посуду. Материал для выделения строгих анаэробов получают из патологического очага путем пункции шприцем, из которого предварительно удален воздух. При отборе образцов тканей их берут из глубины очага. При использовании тампонов их после отбора пробы погружают в транспортную среду;
-количество материала должно быть достаточным для повторного исследования в случае необходимости;
-транспортировку проб материала в лабораторию производят в максимально короткие сроки для предотвращения размножения посторонних микроорганизмов;
-к направляемой в лабораторию пробе прилагают сопроводительный документ, содержащий сведения о больном, предполагаемом диагнозе, характере материала, названии учреждения или отделения, номере истории болезни, предшествующей антимикробной терапии, дате и времени взятия материала, подпись врача, направляющего материал для исследования.
47
При отборе проб для микробиологического исследования строго соблюдают правила асептики для предотвращения заражения людей и среды обитания микробами, находящимися в пробах, а также загрязнения проб посторонними микроорганизмами. При отборе материала исключают попадание в него антибиотиков, антисептиков, дезинфектантов.
Для отбора проб с объектов внешней среды используют стерильные емкости для образцов (пробирки, колбы, флаконы, пакеты), стерильные приспособления для отбора проб (пинцеты, шпатели, пипетки). После отбора проб образцы помещают в стерильные емкости, а приспособления для отбора проб дезинфицируют.
Поступающий в лабораторию для исследования материал регистрируют в специальном журнале. На пробирках (чашках Петри, колбах) пишут номер экспертизы. В микробиологической лаборатории поступивший на исследование материал сохраняют до конца исследования, а по окончании исследования остатки материала уничтожают путем автоклавирования, посуда и инструменты, бывшие в контакте с биоматериалом, обеззараживаются.
48
4. Отбор и анализ проб с объектов внешней среды
4.1. Отбор и анализ проб почвы
Микробиологическое исследование почвы проводят для ее санитарной оценки, изучения процессов обезвреживания отбросов и самоочищения почвы, при определении пригодности участков для строительства, а также при эпидемиологических и эпизоотологических обследованиях с целью выяснения путей заражения почвы и продолжительности сохранения в ней патогенных микробов.
Цели санитарно-микробиологического исследования почвы:
-санитарная оценка почвы населенных пунктов и новых участков для заселения и размещения зданий;
-решение вопросов водоснабжения, канализации и очистки населенных
пунктов;
-санитарная оценка почвы, загрязненной химическими веществами;
-контроль процессов самоочищения почвы, подвергшейся биологическому загрязнению;
-эпидемиологическое обследование почвы для выяснения путей ее заражения.
В зависимости от поставленной задачи применяют краткий или полный санитарно-микробиологический анализ почвы.
Краткий санитарно-микробиологический анализ почвы предусматривает определение общего микробного числа (ОМЧ), количества бактерий группы кишечной палочки (БГКП), энтерококков, Clostridium perfringens, термофильных бактерий, нитрифицирующих бактерий. Полученные результаты позволяют оценить наличие и степень фекального загрязнения почвы. Краткий анализ почвы осуществляют при проведении текущего санитарного надзора за состоянием почвы.
Полный санитарно-микробиологический анализ почвы включает определение всех показателей краткого анализа, а также общей численности сапрофитов, общего числа споровых микроорганизмов, количества актиномицетов
игрибов, количества аэробных бактерий, разрушающих клетчатку, и бактерийаммонификаторов. Полный анализ проводят при осуществлении предупредительного санитарного надзора и при первичном обследовании почвы с целью выбора территории для размещения некоторых объектов (оздоровительных лагерей, детских учреждений и т. д.).
Обнаружение патогенных микробов в почве проводят только при расследовании вспышек инфекционных заболеваний. В качестве косвенных показателей возможного загрязнения окружающих объектов (в том числе и почвы) патогенными микроорганизмами служат санитарно-показательные микроорганизмы
(СПМ).
Основные характеристики санитарно-показательных микроорганизмов:
-СПМ должны постоянно обитать в организме человека или животных и постоянно выделяться во внешнюю среду;
-СПМ не должны размножаться на объектах окружающей среды;
49
-длительность выживания СПМ во внешней среде должна соответствовать длительности выживания патогенных микроорганизмов;
-методы идентификации и дифференциации СПМ должны быть простыми и надежными.
Количество СПМ выражают в титрах и индексах.
Титр СПМ – это наименьший объём (в мл) или весовое количество (в г) исследуемого материала, в котором еще присутствует хотя бы одна особь СПМ.
Индекс СПМ – это количество клеток СПМ, обнаруженных в определённом объёме или весовом количестве исследуемого материала.
Для выявления общей микробной обсемененности определяют общее микробное число (ОМЧ) путем подсчета всех колоний микроорганизмов, выросших на питательной среде при посеве 1 г или 1 мл исследуемого материала.
Санитарно-микробиологическая оценка почвы регламентируется руководящими документами, в частности МУ 2.1.7.730-99 “Гигиеническая оценка качества почвы населенных мест” и СанПиН 2.1.7.1287-03 “Санитарноэпидемиологические требования к качеству почвы”.
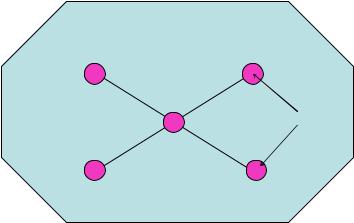
Отбор проб почвы производят с квадратного участка (не менее 5x5 м) из 5 точек - из каждого угла и центра квадрата (“метод конверта”). Образцы почвы отбирают с соблюдением правил асептики с глубины 20-30 см. Общий объем отобранной пробы составляет 1 кг (рисунок 43).
Обследуемая территория
Точки отбора
Рисунок 43 – Схема отбора проб почвы.
Доставленную в лабораторию почву освобождают от крупных включений (камней, корней и др.). Навеску почвы заливают стерильной водопроводной водой в соотношении 1:10. Полученную суспензию встряхивают, отстаивают и готовят 10кратные разведения от 1:10 до 1:100 при исследовании чистых почв или до 1:10000 при исследовании сильно загрязненных почв.
Для определения общего микробного загрязнения почвенные разведения высевают в 1,5% мясопептонный агар. Для этого 1 мл почвенной суспензии (разведения) переносят на дно стерильной чашки Петри. Из каждого разведения проводят посев в 2 чашки. Затем в каждую чашку вливают 15-20 мл питательного агара, предварительно расплавленного и остуженного до температуры 45ОС. Чашки Петри с агаром и почвенной суспензией осторожно тщательно перемешивают.
50
Посевы инкубируют при температуре 37ОС в течение 24 часов. После инкубации подсчитывают выросшие колонии и проводят перерасчет на 1 г сухой почвы.
Для определения БГКП используют метод мембранных фильтров. При этом через стерильные мембранные фильтры профильтровывают 5-10 мл почвенной суспензии. По окончании фильтрования фильтры пинцетом переносят на поверхность среды Эндо, разлитой в чашки Петри. В одну чашку помещают до 4 фильтров. Чашки инкубируют при температуре 37ОС в течение 24 часов.
Для определения в почве Cl. perfringens почвенные разведения (до 1:10000000) по 1 мл переносится в 2 ряда пробирок. Один ряд пробирок прогревают при температуре 80ОС в течение 15 минут или при температуре 90ОС в течение 10 минут. Затем во все пробирки вносят по 9-10 мл среды Вильсона-Блэра (или сульфит-полимиксин-неомициновой среды). Посевы инкубируют при 37ОС в течение 24 часов. Наличие Cl. perfringens проявляется образованием колоний черного цвета.
Определение термофильных бактерий, свойственных почвам,
загрязненным навозом или компостом, производят на мясопептонном агаре. Посев проводят из разведений 1:10 – 1:10000000. Посевы инкубируют при температуре 60ОС в течение 24 часов.
Присутствие нитрифицирующих бактерий в почве указывает на степень органического загрязнения, скорость и окончание распада органики в почве. Определение нитрификаторов проводят путем посева разведений почвенной суспензии в тонкий слой минеральной среды Виноградского во флаконах. Посевы инкубируют при температуре 28ОС в течение 14-15 суток. При размножении нитрифицирующих бактерий в среде появляются азотистая и азотная кислоты. Для их определения используют качественную пробу с дифениламином. Для этого несколько капель содержимого флаконов переносят на стеклянную пластинку и добавляют несколько капель раствора дифениламина в концентрированной серной кислоте. Появление синего окрашивания свидетельствует о присутствии нитратов (результат размножения нитрифицирующих бактерий).
Показатели чистоты почв по санитарно-показательным микроорганизмам представлены в таблице 4.
Таблица 4 – Показатели чистоты почв по СПМ
Категория почвы |
Коли-титр |
Перфрингенс-титр |
Количество |
|
|
|
термофильных |
|
|
|
бактерий в 1 г |
Чистая |
1,0 и выше |
0,01 и выше |
102-103 |
Загрязненная |
0,9-0,01 |
0,009-0,0001 |
103-105 |
Сильно загрязненная |
0,009 и ниже |
0,00009 и ниже |
От 105 до 4х106 |
Наличие в почве бактерий группы кишечной палочки свидетельствует о ее свежем фекальном загрязнении. На свежее фекальное загрязнение почвы указывают не только высокие титры БГКП, но и низкие титры нитрификаторов и термофилов, а также относительно высокое содержание вегетативных форм Cl. perfringens. Появление нитрифицирующих бактерий указывает на развитие процесса самоочищения, так как они завершают цикл разложения
