
Ocherki_klinicheskoy_biokhimii
.pdf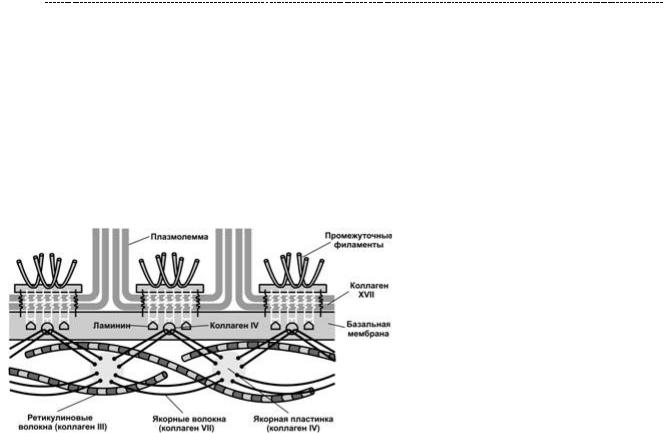
261
Миграционный потенциал фибронектина важен и для привлечения фибробластов в очаг повждения, что необходимо для заживления ран и некротических участков (в
часто виде фиброза, но тем не менее).
Ламинин также является важным адгезивным белком, и его особенность в том, что он составляет важный компонент базальной мембраны во всех органах и тканях организма, в том числе гломерулярный барьер почки.
Исходя из схемы, ты видишь, что базальная мембрана обеспечивает связывание клеток эпителиальной природы к подлежащей соединительной ткани, что обеспечивает нормальную архитектонику ткани. Ламинин является связующим звеном между коллагеном IV типа,
протеогликанами и клетками, позволяя существовать базальной мембране как единое целое.
Важное значение ламинину придают и в морфогенетических процессах: так,
считается, что рост и регенерация аксонов нейронов осуществляется вдоль ламининовых волокон, секретируемых шванновскими клетками (клетка глии).
Примечательно, что эпителий не может существовать без базальной мембраны.
И без подлежащей соединительной ткани. Ни одна рана на теле не сможет эпителизироваться, пока на месте повреждения не будет сформирована соединительная ткань и построена базальная мембрана. Во многом это обусловлено и интегриновыми рецепторами, которые, при связывании с внеклеточным матркисом, способны запускать сигнальные каскады в клетке,
приводящие к её пролиферации. Иногда это имеет и патологическое значение.
262
16.1.4. Интегрины. Сигнальная функция интегринов
В отношении морфогенеза и клеточной адгезии, а во многих аспектах – и
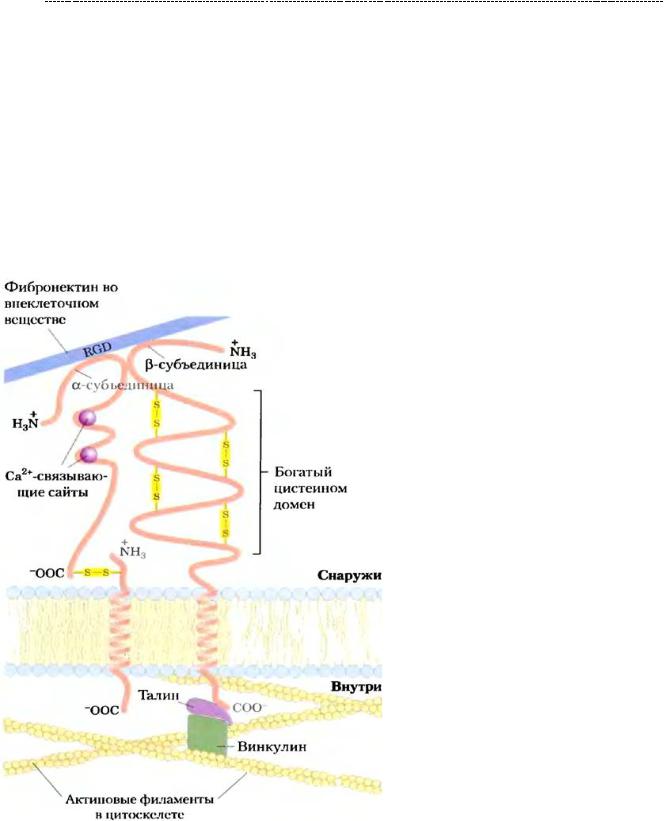
клеточные функции (в том числе пролиферации) очень важное значение имеют интегрины. Это трансмембранные гликопротеиды, состоящие из различной комбинации a и b – цепей, на основе разнообразия сочетания которых выделяют множество видов этих интегринов. На данном рисунке продемонстрировано взаиморасположение интегрина с другими компонентами соединительной ткани.
(источник Биохимия Ленинджера, том 1)
Так,фибронектинсвязываетсясцистеиновымдоменоминтегринаспомощьюRGD - (Аrg-Glу-Аsр) – участка с внеклеточным доменом интегрина, устанавливая тем самым связь внеклеточного матрикса с клеткой. Но для более прочной адгезии,
внутриклеточный домен интегрина связан с цитоскелетом клетки посредством талина и винкулина. Помимо прочности адгезии, такая тесная связь интегрина с цитоскелетом позволяет первому
263
осуществлять регуляцию клеточных функций, во многом(но не во всём) именно через изменения цитоскелета. Таким образом, посредством интегринов, клетка реагируют на тончайшие изменения внеклеточной среды.
Интегрины обусловливают очень много клеточных эффектов, и их функции выходят за пределы клеточной адгезии. Хотя, безусловно, это важный аспект. Мы поделим их функции следующим образом:
1.Адгезивнаяфункция.Помимоуказанноговыше,добавлю,чтонекоторыевиды интегринов (αIIbß3.) обеспечивают тромбоцитарный гемостаз за счёт
способности связывать фибриноген, цепью переброшенный между
тромбоцитами. Это обусловливает адгезию тромбоцитов между собой с формированием сгустка.
Взаимодействие интегринов с ICAM – молекулами лейкоцитов обеспечивает адгезию лейкоцитов и их проникновение в очаг повреждения ткани.
2. Сигнальная функция интегринов. *
Под сигнальной функцией интегринов понимается их способность опосредовать влияние внеклеточного матрикса на внутриклеточные процессы, которые модифицируют поведение клеток. Приведу наиболее важные аспекты сигнальной функции интегринов
-миграционные процессы клеток в эмбриогенезе (фибронектин – специфичный интегрин а5в1 и ряд других)
-αvβ3 и α9β1 – интегрины способны опосредовать проведение митогенных сигналов, приводящих к активации циклинов А и D1 и их мРНК
(матрикс-опосредованнаяактивациирецепторов).Интегриныприизменениисвоей конформации в результате взаимодействия со своими лигандами, обеспечивают активацию специальной протеинкиназы. Этим ферментом оказалась фосфокиназа клеточного контакта (FAK-focal adhesion kinase).
* - СТРУКТУРА И СИГНАЛЬНЫЕ ФУНКЦИИ ИНТЕГРИНОВ Обзор. © 2003 г. А.Е. Берман*,
Н.И. Козлова, Г.Е. Морозевич
264
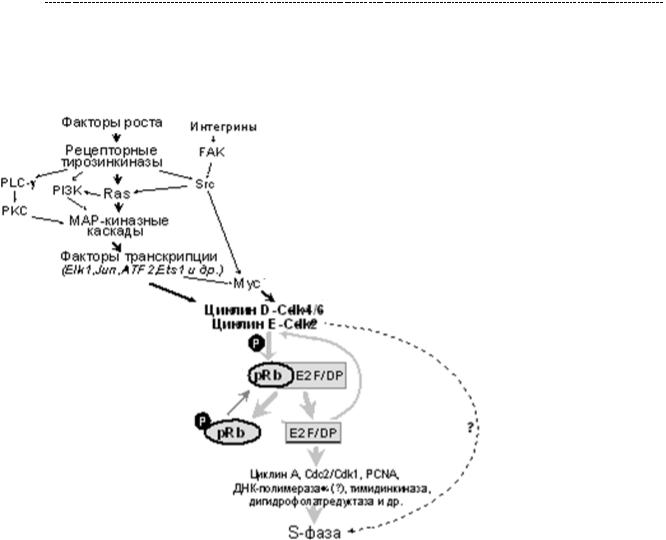
Ниже предаставлена доля участия интегринов в митогенных каскадах клетки.
(источник иллюстрации: Механизмы действия онкогенов и опухолевых супрессоров. Обзор
Копнин Б.П.
НИИ канцерогенеза),
Как видно из схемы, интегрины запускают активацию FAk – киназы, которая, в
свою очередь, активирует киназу SRC. Через серию фосфорилирования других протеинкиназ, это приводит к экспрессии циклинов и ЦЗК, обеспечивающих продвижение клетки по клеточному циклу. Чуть позже мы коснёмся клинического значения данного факта.
16.1.5.Основное вещество межуточного матрикса. Протеогликаны,
гликозаминогликаны.
Данный компонент матрикса представляет из себя своего рода гель или цемент, в
который погружены остальные компоненты соединительной ткани. Он имеет колосальное значение как в норме, так и при заболеваниях.
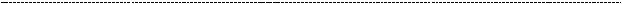
265
Протеогликаны представляют собой углеводно (95%) – белковые (5%)
комплексы, основу которых составляет гиалуроновая кислота. Последняя является одним из 5 важнейших гликозаминогликанов (аминированных сахаров),
составляющих основу межуточного матрикса.
В качестве типовых структурных блоков гликозаминогликаны содержат аминосахара и уроновые кислоты (глюкуроновая, галактуроновая, идуроновая кислоты), последние из которых являются продуктом окисления моносахаридов.
Большинство полисахаридов этой группы в различной степени этерифицировано остатками серной кислоты, которые усиливают их кислотные свойства.
К важнейшим гликозаминогликанам (ГАГ) относят сульфатированные ГАГ -
дерматансульфат, гепарин, кератансульфат и хондроитинсульфат, а также несульфатированные ГАГ – гиалуроновая кислота. Они все способны притягивать многочисленные ионы, которые, в свою очередь, связывают воду. Это позволяет придавать соединительной ткани определённую форму, что становится понятным,
если вспомнить о несжимаемости воды.
Биосинтез ГАГ начинается на этапе формирования углеводного компонента, а
именно–двухкомпонентныхкирпичиков–аминированногосахараигексуроновой кислоты.
Синтезгликозаминогликанов(ГАГ)осуществляетсяпосредствомметаболического насилиянадD–глюкозой. ОднимизважныхаспектовсинтезаГАГявляетсясинтез глюкозамин 6 – фосфата. Синтез глюкозамин - 6 - фосфата начинается со структурной перестройки глюкозы-6-фосфата в фруктозу-6-фосфат под действием
глюкозо 6 – фосфатизомеразы (см. гликолиз), чтобы облегчить взаимодействие с аминокислотой глутамином. Фермент глюкозаминсинтетаза облегчает перемещениеамиднойгруппы(NH3)отглутаминакфруктозе-6-фосфату.Фермент
глюкозо-6-фосфатизомераза изомеризирует это соединение, чтобы сформировать глюкозамина 6-фосфат. Образовавшаяся молекула является предшественником всех гексозаминов и их производных.

266
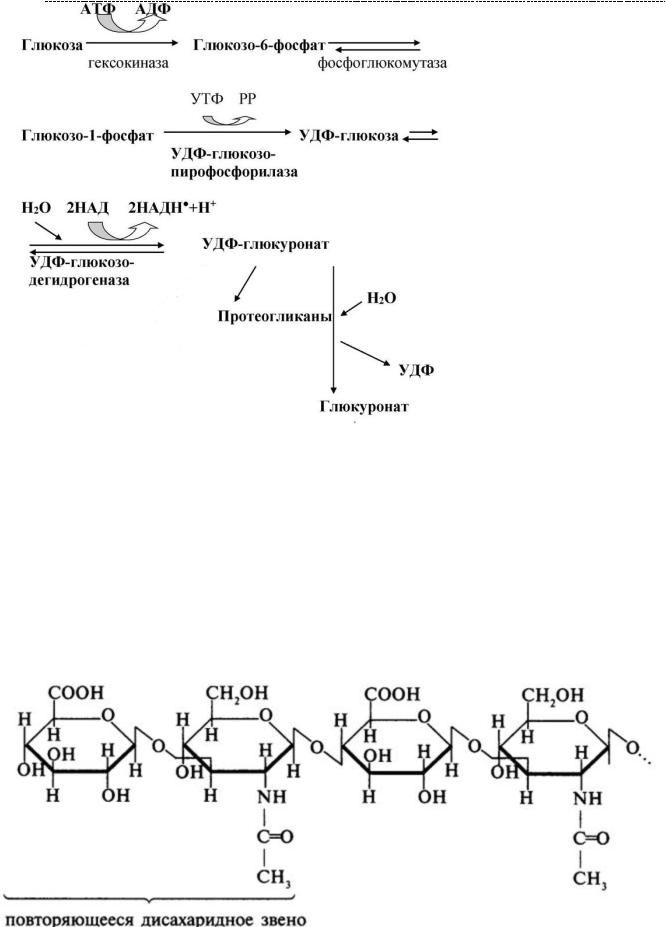
Глюкозамина 6-фосфат затем ацетилируется коэнзимом А, что приводит к формированию N-ацетилгликозамина, который может впоследствии быть
преобразован в N-ацетилгалактозамин* (http://www.plaintest.com/miscellaneous/osteoarthrosis-
glycosamine)
Помимо N-ацетилгликозамина, в качестве аминосахара может выступать и N –
ацетилгалактозамин, претерпевающий сульфатирование. (что наблюдается сульфатированных ГАГ, их основу составляет именно N –ацетилгалактозамин).
Сульфатирование мономерных звеньев ГАГ (для образования сульфатированных ГАГ) происходит за счет сульфатных группировок активной серной кислоты – ФАФС (фосфоаденозинфосфосульфата) при участии витамина А. Синтез ФАФС,
как тебе известно, осуществляется из нуклеотидов (глава 1).
267
Помимо N – ацетилглюкозамина, составной частью ГАГ является глюкуроновая кислота. Её синтез также сопрежён с превращениями глюкозы в клетки, в данном случае – в УДФ – глюкуронат (метаболически активная форма глюкуроновой кислоты). Ранее мы касались глюкуроновой кислоты, когда обсуждали роль УДФ
– глюкуроната в детоксикации ксенобиотиков (глава 1).
Получив эти два соединения, мы получаем составной кирпичик ГАГ
Слева направо: глюкуроновая кислота а – 1,4 – гликозидной связью с N - ацетилглюкозамином
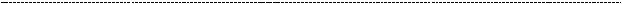
268
Получивздоровенный углеводныйкомпонент,клеткаприсоединяетегокбелковой части в рамках посттрансляционной модификации. Здесь ничего сложного.
Синтез ГАГ протекает интенсивно не только в соединительной ткани: большие количества ГАГ обнаруживаются в мышечных и нервных клетках, эритроцитах,
эндотелиоцитах. Это объясняет множественность нарушений при мукополисахаридозах (см. далее).
Про распад ГАГ я могу сказать куда меньше. Он осуществляется под действием строго специфичных лизосомальных гликозидаз. Их в организме чрезвычайно много, для каждого ГАГ существует своя гликозидаза. Мы поговорим о них в параграфе, посвящённому нарушению метаболизма ГАГ, т.к. в их основе лежит именно нарушения катаболизма ГАГ.
Строение |
Гексуроно-вая |
Гексозамин |
Тип связи |
важнейших |
кислота |
|
|
ГАГ |
|
|
|
гепарин |
глюкуронат-2- |
NN-- |
α11.-α41-4 |
|
сульфат |
ацетилгалактоза |
2. α 1-4 |
|
|
мин-6-6-сульфат- |
|
|
|
|
|
гиалуроновая |
Глюкуро-новая |
N- |
1.β 1-3 |
кислота |
|
ацетилглюкозам |
2. β 1-4 |
|
|
ин |
|
хондроитин-6- |
Глюкуро-новая |
N- |
1.β 1-3 |
сульфат |
|
ацетилгалактоза |
2. β 1-4 |
|
|
мин-6-сульфат |
|
хондроитин-4- |
Глюкуро-новая |
N- |
1.β 1-3 |
сульфат |
|
ацетилгалактоза |
2. β 1-4 |
|
|
мин-4-сульфат |
|
Дерматансуль- |
Идуроно-вая |
N- |
1.β 1-3 |
фаты |
|
ацетилгалактоза |
2. β 1-4 |
|
|
мин-4-сульфат |
|
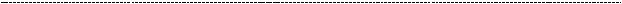
269
16.2. Коллагенопатии
16.2.1. Несовершенный остеогенез. Коллаген I составляет почти 90 % всего коллагена в организме и занимает свою нишу в коже и в костях. Как уже было отмечено ранее, при синтезе коллагена используется очень много аминокислоты глицина (того самого, которым экс – министр Скворцовав своё время предлагала лечить ишемический инсульт, прости господи). По большому счёту, весь коллаген построен из триплетов, в каждом из которых мы, ткнув наугад, найдём глицин.
Заменив глицин на любую другую аминокислоту в a – цепи коллагена (что возможно в результате точечной мутации в соответствующих генах COL1A1 или
COL1A2), мы получим дефект (качественный или количественный) выработки коллагена I типа. Описаны ещё около 18 мутаций, но они встречаются настолько редко, что нет смысла о них говорить.
Дефект выработки коллагена I типа приводит к ломкости костей и предрасположенности к переломам костей и иным деформациям ещё в самом раннем возрасте. Это ожидаемо, ведь именно коллаген I типа составляет органическую основу матрикса костной ткани. являясь по сути, её структурообразующим протеиновым элементом, который обеспечивает её прочность при растяжении. Однако, не всё так просто.
Клинический фенотип при несовершенном остеогенезе чрезвычайно вариабелен,
что определяется характером мутации. Так, изолированный дефект в гене COL1A1
при I типе несовершенного остеогенеза, приводит лишь к количественным дефектам синтеза коллагена, когдатак наличие мутаций в обоихгенахCOL1A1/А2
приводит ещё ик качественным дефектам при II – IVтипах, которые, закономерно,
протекают более тяжело, как правило, с ранней инвалидизацией и смертью больных детей. Выраженность клинических проявлений также определяется соотношением нормальных и дефектных цепей в коллагене, а также на какую аминокислоту произошла замена глицина.
270
В условиях реальной жизни, диагностика таких состояний будет сугубо клиническая. Именно тебе, юное дарование, возможно, придётся диагностировать такую штуку. О несовершенном остеогенез стоит подумать,
если:
- наследственный анамнез по переломам (актуально в силу аутосомно – доминантного, реже аутосомно – рецессивного механизма наследования данной проблемы)
-переломы при минимальном механическом воздейсвтии на ребёнка. Переломов может быть очень много за непродолжительный (6 – 12 мес) промежуток времени
-отставание в физическом развитии по длине тела
-внекостные проявления в виде голубых склер, нарушение формирования дентина зубов (они любят выпадать), тугоухость
-дисплазия тазобедренного сустава в виде протрузии (внедрении, впячивании)
ацетабулярной впданиы (места, куда помещается головка бедренной кости) в
полость малого таза с нарушениями походки
- частые компрессионные переломы позвоночника, трубчатых костей, реже – костей черепа и рёбер. Переломы находятся на разных стадиях формирования
- денситометрия (если знаешь, что это) – снижение плотности костей,
коррелирует с риском переломов
Одним словом, дефект коллагена I типа приводит к нарушению остеогенеза. Но не стоит забывать, что это, к счастью, не самая частая ситуация. И существует ещё множество заболеваний, способные привести к нарушению костеобразования. И
все их стоит держать на уме, никогда не знаешь, с чем встретишься.
