
Александров Ю.И., Анохин К.В. - Нейрон. Обработка сигналов. Пластичность. Моделирование_ Фундаментальное руководство (2008)
.pdf
Ðèñ. 10.1. Нейроны центральных ганглиев виноградной улитки. Красным окрашен один из командных нейронов (LPa3), темным — пресинаптические нейроны. Внизу слева представлен участок отростка командного нейрона с отходящими от него дендритами. Реконструкция изображений серийных срезов ганглиев (внизу справа) позволила выявить несколько контактов между отростками нейрона-детектора и командного нейрона (по: Палихова и др., 1992). (Калибровка: 10 мкм соответствует 1000 мкм и 200 мкм на верхних рисунках).
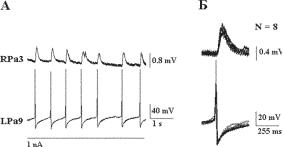
Идентификация нейронов открывает возможность определить локальное рецептивное поле нейрона-детектора и границы гигантского рецептивного поля командного нейрона (Шехтер и Аракелов, 1985; Палихова и Аракелов, 1990). Ввод электродов одновременно в сенсорный и командный нейроны позволил наносить электрическое раздражение на детектор, вызывая всего один потенциал действия, и одновременно регистрировать унитарный ВПСП в командном нейроне (рис. 10.2). Ответ сенсорного нейрона при действии импульсов деполяризующего тока состоит из деполяризации, переходящей в одиночный потенциал действия, за которым следует волна гиперполяризации, переходящая в устойчивый сдвиг деполяризации. При наложении эти реакции сенсорного нейрона точно совпадают друг с другом (рис. 10.2 Б).
Реакции командного нейрона на последовательность потенциалов действия сенсорного нейрона характеризуются убывающей амплиту-
270
дой ВПСП. При этом одинаковые потенциалы действия нейрона-детек- тора вызывают в командном нейроне разные по амплитуде, скачкообразно изменяющиеся ВПСП. Это означает, что отдельные потенциалы действия активируют каждый раз разное число активных зон, вызывая в каждой из них высвобождение одного пресинаптического пузырька. Такой квантовый характер изменения амплитуды ВПСП говорит о пресинаптическом механизме этого процесса.
Ðèñ. 10.2. Скачкообразные изменения амплитуды ВПСП. Единичные ВПСП в командном нейроне возникают в ответ на одиночные потенциалы действия в пресинаптическом сенсорном нейроне. À — толчки деполяризующего тока 1нА, подаваемые в сенсорный нейрон (LPa9) с интервалами в 30 сек., вызывают прогрессивно уменьшающиеся по амплитуде ВПСП в командном нейроне (RPa3). Á — наложение ВПСП командного нейрона RPa3, вызванных подачей импульсов деполяризующего тока (1 nA) в сенсорный нейрон LPa9, состоят из деполяризационного сдвига, инициирующего одиночный потенциал действия. Реакции сенсорного нейрона при наложении точно совпадают друг с другом. В это время ВПСП командного нейрона скачкообразно уменьшаются в ходе повторных стимуляций сенсорного нейрона. При этом величина скачкообразного снижения амплитуды ВПСП остается постоянной. Такое скачкообразное снижение амплитуды ВПСП отражает уменьшение числа активных зон на пресинаптических бутонах нейрона LPa9, ведущее к редукции мобилизованных квантов медиатора.
Сенсорный нейрон формирует несколько пресинаптических бутонов на отростках командного нейрона, но не все пресинаптические бутоны содержат активные зоны (Bailey, Chen, 1991). При привыкании или сенситизации число пресинаптических бутонов, формирующих активные зоны, меняется. Это хорошо согласуется с представлением о «молчащих синапсах», которые рассматриваются как один из механизмов пластичности мозга (Atwood and Wojtowicz, 1999).
271

Пресинаптическая пластичность выражается в привыкании в виде систематического уменьшения амплитуды ВПСП, связанного с уменьшением входа кальция в пресинаптический бутон и с уменьшением числа вовлеченных в реакцию активных зон (рис. 10.3 А).
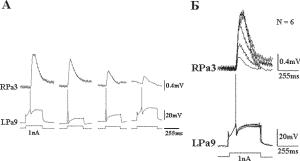
Ðèñ. 10.3. Привыкание и сенситизация ВПСП. À — при исходно высоком уровне мобилизации активных зон пресинаптических бутонов повторная стимуляция сенсорного нейрона ведет к привыканию. Á — при исходно низком уровне мобилизации активных зон на пресинаптических бутонах повторные потенциалы действия, возникающие в сенсорном нейроне с частотой около 2 Гц в ответ на постоянно действующий деполяризующий ток (1nA), вызывают сенситизацию, выражающуюся в возрастании амплитуды ВПСП командного нейрона. Наложение нескольких потенциалов нейрона LPa9 и соответствующих ВПСП в командном нейроне RPa3 показывает скачкообразный, квантовый характер изменения амплитуды ВПСП. Сенситизация связана с увеличе- нием числа вовлеченных в реакцию активных зон пресинаптических бутонов нейрона LPa9. При этом сенсорный нейрон генерирует каждый раз только один потенциал действия.
Постсинаптическая пластичность, связанная с градуальным изменением активных рецепторов на постсинаптической мембране дендритного шипика, демонстрируется в виде постепенного изменения амплитуды ВПСП (Рис. 10.4).
272
Ðèñ. 10.4. Постсинаптическая пластичность. Устойчивая амплитуда ВПСП командного нейрона RPa3 при деполяризации сенсорного нейрона. При изменении длительности интервалов между потенциалами действия пресинапти- ческого нейрона LPa9 происходит изменение амплитуды ВПСП в постсинапти- ческом командном нейроне.À — генерация пейсмекерных волн и спайков при деполяризации сенсорного нейрона, вызванной инъекцией постоянного тока (1 nA). Á — наложение нескольких (N = 10) пресинаптических потенциалов действия иллюстрирует плавное, не квантовое изменение амплитуды ВПСП в командном нейроне.
Плавное изменение амплитуды унитарного ВПСП свидетельствует о постсинаптическом механизме, связанном с фосфорилированием или дефосфорилированием молекул рецепторного белка на шипиках постсинаптической клетки. Однако управление кальциевыми каналами на пресинаптическом уровне и процессы фосфорилирования — дефосфорилирования рецепторов на постсинаптическом уровне не могут обеспечить долговременной памяти. Ее формирование требует структурных изменений. Вместе с тем долговременная память включает мгновенное запечатление объектов и событий. Это достигается за счет экспрессии генов под влиянием внешних воздействий (Gall and Lauterborg, 1991).
Экспрессия генов включает два этапа. На первом этапе включаются ранние гены, продукты синтеза которых образуют факторы экспрессии более поздних структурных генов. Транскрипция структурных генов ведет к образованию информационной РНК, на которой образуются структурные белки. Белки транспортируются затем к тем участкам нейрона, которые подверглись действию медиатора. Это, прежде всего, шипики дендритов, которые таким образом поддерживаются или возникают вновь. Кроме транспорта структурных белков к шипикам дендритов может перемещаться информационная РНК, а синтез белка происходит локально за счет механизма трансляции, присутствующего в
273
шипиках. Энергетическое обеспечение трансляции осуществляется митохондриями шипиков. Одновременно происходит рост дендритов, обеспечивающих формирование новых шипиков. Таким образом, структурно долговременная память представлена увеличением количества дендритов и расположенных на них шипиков.
Образование новых синаптических связей при формировании памяти предполагает структурные изменения не только пост-, но и пресинаптических структур. Существуют данные о разрастании аксонных терминалей в процессе обучения Такие изменения показаны для неассоциативного научения, привыкания и сенситизации морского моллюска Aplysia (Bailey and Chen, 1991). При привыкании количество синаптических пузырьков в области активных зон и количество формирующих активные зоны пресинаптических бутонов уменьшается. При сенситизации наблюдаются противоположные изменения. Долговременная сенситизация сопровождается увеличением числа аксонных терминалей, формирующих пресинаптические бутоны, количество которых с течением времени (три недели) уменьшается, но к своему исходному значению не возвращается. Эти данные хорошо согласуются с поведенческой специализацией, происходящей в процессе консолидации при формировании долговременной памяти.
Кроме роста дендритного и аксонного аппарата, у взрослых организмов существует нейрогенез — образование новых нейронов из неспециализированных стволовых клеток. Нейрогенез особенно выражен в гиппокампе — структуре мозга, связанной с памятью. Вновь образованный нейрон, достигая целевой клетки, завершает свою дифференциацию и встраивается в нейронную сеть, образуя синапсы на целевых клетках и получая синаптические контакты от соответствующих элементов нейронной сети и необходимые для выживания нейронов и синапсов факторы, нейротрофины. Вместе с тем нейроны, не востребованные в опыте организма, подвергаются апоптозу — программируемой смерти. Таким образом, индивидуальное развитие предстает перед нами как отбор клеточных групп, напоминающий естественный отбор, но принципиально отличный от него по своим механизмам.
Долговременная память предполагает адресное перемещение макромолекул от подверженного действию медиатора дендритного шипика к специфическому локусу ДНК в ядре клетки, а также от места трансляции белка в цитоплазме к тому дендриту, который был подвергнут действию медиатора. Такое адресное перемещение макромолекул
274
осуществляется при участии микротубулярного аппарата цитоскелета нейрона. Важнейшая роль в транслокации макромолекул принадлежит микротрубочкам, представляющим собой полые цилиндры диаметром около 25 нанометров. Микротрубочки связаны между собой наподобие ступеней веревочной лестницы мостиками из ассоциированного с микротрубочками белка.
Направление движения диктуется специальными сигнальными белковыми молекулами. Наиболее подробно изучен транспорт органелл по микротрубочкам в аксонах. Антероградный транспорт осуществляется белком-мотором кинезином, а ретроградный — белком дикенином. Перемещение макромолекул и органелл (пузырьков с биологи- чески активными веществами) происходит с затратой энергии, которая черпается из АТФ при переходе его в АДФ.
Однако в настоящее время рассматривается другая функция микротрубочек, а именно информационная, связанная с генерацией в них когерентных биофотонов (Пенроуз и др., 2004; Hameroff et al., 1993; Hagan et al., 1994). Это подобное лазерному излучение не требует «подкачки» световыми вспышками. Оно возникает в результате взаимодействия диполей молекул воды с квантованным электромагнитным полем. В результате, с некоторой вероятностью, возникает упорядоченная группа молекул воды, находящихся на высоком энергетическом уровне. Под влиянием случайных тепловых флуктуаций они совместно переходят на более низкий энергетический уровень, что приводит к генерации когерентных фотонов, которые в импульсном режиме распространяются без потери энергии вдоль микротрубочки подобно тому, как это происходит в оптических волокнах (Prigogine, 1994; Пригожин, Стенгерс, 2000). Достигая критических участков, фотоны поглощаются, запуская активацию рецепторов в дендритных шипиках или молекул калмодулина в пресинаптических бутонах.
Таким образом, нейрон приобретает в дополнение к ионным механизмам передачи сигналов внутриклеточную сеть сверхскоростной оптической сигнализации. Такая оптическая сигнализация позволяет объяснить целесообразное поведение таких одноклеточных организмов, как парамеция, демонстрирующая приближение к пищевым объектам и уход от вредных объектов. Кроме того, парамеция обнаруживает способность к элементарному научению в форме привыкания, сенситизации и выработки ассоциаций.
Заключая, можно сказать, что механизм памяти распределен в локальных взаимодействиях пресинаптических бутонов с дендритными
275
шипиками постсинаптической клетки. Пресинаптическая пластичность выражается в мобилизации — демобилизации активных зон на пресинаптической решетке бутонов аксонных терминалей, определяющей квантовый состав выброса медиатора. Долговременные процессы сопровождаются изменениями числа аксонных терминалей и включением в сеть новых нейронов, формирующихся из стволовых клеток. На постсинаптическом уровне пластичность определяется соотношением фосфорилированных — дефосфорилированных молекул рецепторного белка. Кратковременные процессы дополняются структурными перестройками, включающими экспрессию ранних и поздних структурных генов, что требует передачи информации от дендритного шипика к ядру нейрона и транспорта синтезированных белков из цитоплазмы к шипику дендрита. Этот перенос макромолекул осуществляется микротубулярным аппаратом. В литературе обсуждается гипотеза о том, что микротрубочки реализуют также функцию световодов, связывающих между собой отдельные синапсы нейрона.
Выводы
•«Нейронаука» призвана объединить отдельные области биологии, связанные с функциями нервной системы. «Нейроника» фокусирует свое внимание на нейроне, привлекая по мере необходимости данные из других дисциплин. «Нанонейроника» нацелена на изучение нанообъектов, определяющих функции клетки на молекулярном и субмолекулярном уровнях.
•К нанообъектам принадлежат «пресинаптический бутон» и «шипик дендрита».
•Пресинаптический бутон представляет собой окончание аксона, расширяющееся в месте его контакта с целевой клеткой и отделенное от нее синаптической щелью.
•Шипик дендрита представляет собой «грушеобразное выпячивание», оканчивающееся плотно упакованными рецепторами, на которые воздействует медиатор, высвобождающийся из синаптического бутона
âсинаптическую щель.
•Механизм памяти распределен в локальных взаимодействиях пресинаптических бутонов с дендритными шипиками постсинаптической клетки.
•Пресинаптическая пластичность выражается в мобилизации — демобилизации активных зон на пресинаптической решетке бутонов аксонных терминалей, определяющей квантовый состав выброса медиатора.
276
•На постсинаптическом уровне пластичность определяется соотношением фосфорилированных — дефосфорилированных молекул рецепторного белка.
•Кратковременные процессы дополняются структурными перестройками, включающими экспрессию ранних и поздних структурных генов, что требует передачи информации от дендритного шипика к ядру нейрона и транспорта синтезированных белков из цитоплазмы к шипику дендрита. Этот перенос макромолекул осуществляется микротубулярным аппаратом.
•В литературе обсуждается гипотеза о том, что микротрубочки реализуют также функцию световодов, связывающих между собой отдельные синапсы нейрона.
•В ряде случаев долговременные процессы сопровождаются не только изменениями числа аксонных терминалей, но и включением в сеть новых нейронов, формирующихся из стволовых клеток.
Цитированная литература
Рекомендуемая
1.Николлс Дж. Г., Мартин А. Р., Валлас Б. Дж., Фукс П. А. От нейрона к мозгу. М.: Едиториал УРСС. 2003. 672 с.
2.Палихова Т. А., Аракелов Г. Г. Моносинаптические связи в центральной нервной системе виноградной улитки: рецептивные поля пресинаптических нейронов // Журн. высш. нерв. деят. 1990. Т. 40. ¹ 6. С. 1186-1189.
3.Палихова Т. А., Маракуева И. В., Аракелов Г. Г. Моно- и полисинапти- ческие связи между идентифицированными нейронами в системе пассивнооборонительного рефлекса виноградной улитки // Журн. высш. нерв. деят. 1992. Т. 42. ¹ 6. Ñ.1170-1179.
4.Пенроуз Р., Шимони А., Картрайт, Н., Хокинг С. Большое, малое и человеческий разум. Москва: Мир. 2004.
5.Пригожин И., Стенгерс И. Время, хаос, квант: К решению парадокса времени. М.: Едиториал УРСС. 2000.
6.Шехтер Е. Д., Аракелов Г. Г. Рецептивное поле командного нейрона // Вопросы кибернетики. Нейрокибернетический анализ механизмов поведения.
Å.Н. Соколов и Л. А. Шмелев (Ред.). М.: Наука. 1985. С. 64-84.
Дополнительная
1. Arakelov G. G., Marakujeva I. V., Palikhova T. A. Structural and functional analysis of monosynaptic connections between identified neurones of Helix lucorum // In: Simpler nervous systems. D.A. Sakharov, W. Winlow (Eds.). Manchester University Press. Studies in Neuroscience. 1991. ¹ 13. Ch.16. PP. 258-269.
277
2.Atwood H. L. and Wojtowicz, J. M. Silent synapses in neural plasticity: current evidence // Learning and Memory. 1999. Vol. 6. ¹ 6. PP. 542-571.
3.Bailey C. H. and Chen M. The anatomy of ling-term sensitization in Aplysia: morphological insights into learning and memory // In: Memory: organisation and locus of change. L. R. Squire, N.M. Weinberger, G. Lynch, J. McGanyh (Eds.), New York — Oxford, Oxford University Press, 1991. PP. 273-300.
4.Eccles J. C. Evolution of complexity of the brain with emergence of consciouness // In: Rethinking neural networks: quantum fields and biological data. K.H. Pribram (Ed.). Hillsdale, Lawrence Erlbaum Associates, Publishers. 1993. PP. 3-28.
5.Gall Ch. M., Lauterborn J. C. Activity-dependent neuronal gene expression: a potential memory mechanism? // In: Memory: organisation and locus of change. L. R. Squire, N. M. Weinberger, G. Lynch, J. McGanyh (Eds.), New York — Oxford, Oxford University Press. 1991. PP. 301-329.
6.Hagan S., Jibu M.,Yasue K. Consciousness and anasthesia: an hypothesis involving biophoton emission in the microtubular cytosceleton of the brain // In: Origins: brain and self-organization. K. H. Pribram (Ed.). Hillsdale, Lawrence Erlbaum Associates, Publishers. 1994. PP.153-171.
7.Hameroff S., Dayhoff J.E., Lahoz-Bettra R., Rasmussen S., Insina E. M.., and Coruga D. Nanoneurology and cytoskeleton: quantum signaling and protein conformational dynamics as cognitive substrate // In: Rethinking neural networks: quantum fields and biological data. K. H. Pribram (Ed.), Hillsdale, Lawrence Erlbaum Associates, Publishers. 1993. PP. 319-365.
8.Marakujeva I. V., Palikhova T. A., Trepakov V. V., Arakelov G. G. Identified synapses in the snail’s brain // Neuroinformatics and Neurocomputers. RNNS/ IEEE, Rostov-on-Don. 1992. V.1. PP. 497-508.
9.Prigogine I. Mind and matter: Beyond the Cartesian dualism // In: Origins: brain and self-organization. K. H. Pribram (Ed.), Hillsdale, Lawrence Erlbaum Associates, Publishers. 1994. PP. 3-15.
10.Sokolov E. N. Local plasticity in neuronal learning // In: Memory: organization and locus of change. L. R. Squire, N. M. Weinberger, G. Lynch,
J. McGanyh (Eds.), New York — Oxford, Oxford University Press. 1991. PP. 364-391.
278
Раздел IV. ОРГАНИЗАЦИЯ И ФУНКЦИОНИРОВАНИE
РАЗЛИЧНЫХ ТИПОВ НЕЙРОЦИТОВ (СЕНСОРНЫЕ РЕЦЕПТОРЫ, ПЕЙСМЕКЕРНЫЕ НЕЙРОНЫ, ГЛИЯ)
