
Александров Ю.И., Анохин К.В. - Нейрон. Обработка сигналов. Пластичность. Моделирование_ Фундаментальное руководство (2008)
.pdfКроме того, электрические контакты между колбочками с различ- ной спектральной чувствительностью хотя и снижают способность к цветоразличению (Hornstein е.а., 2004), но улучшают соотношения сигнал/шум (DeVries е.а., 2002) и увеличивают яркостную чувствительность (Hornstein е.а., 2004). Полагают, что электрические связи между фоторецепторами являются одним из факторов, обеспечивающих высокую разрешающую способность зрительной системы в условиях фотопической адаптации (Goran e.a., 2005).
12.2.Физиология фоторецепторов
12.2.1.Реакция фоторецептора на свет. Молекулярные механизмы
12.2.1.1.Общая характеристика фоторецепторных реакций на свет и механизмов их генгерации
Внутриклеточные исследования реакций фоторецепторов на свет показали, что в темноте мембранный потенциал фоторецепторной клетки очень мал — около -30 мВ. Вспышка света вызывает гиперполяризацию, сопровождающуюся уменьшением проводимости мембраны (рис. 12.4). Амплитуда гиперполяризации, вызванной светом, увели- чивается в течение 50–100 мс и, достигнув максимальной величины (до -60 — -65 мВ), начинает уменьшаться, возвращая мембранный потенциал к темновому уровню.
Амплитудно-временные характеристики реакции фоторецептора на свет зависят от физических параметров светового стимула. Так, при увеличении интенсивности (или диаметра) светового пятна, освещающего фоторецептор, амплитуда светового ответа возрастает до уровня насыщения, то есть, достигнув максимальной величины, амплитуда перестает увеличиваться, несмотря на усиление светового воздействия. Изменения амплитуды сопровождаются уменьшением времени достижения максимума ответа и увеличением времени возвращения мембранного потенциала к темновому уровню.
У палочек и колбочек амплитудно-временные характеристики реакций на свет неодинаковы. Так, у палочек, обладающих высокой световой чувствительностью, гиперполяризация, сопоставимая по амплитуде с ответом колбочек, возникает при меньших интенсивностях света. Однако время достижения максимума гиперполяризационного ответа и время возвращения мембранного потенциала к темновому уровню у колбочек меньше, чем у палочек.
300
Таким образом, максимальной величине светового ответа фоторецептора соответствует мембранный потенциал нормального нейрона в состоянии покоя. В темноте наоборот — фоторецептор деполяризован так же, как другие нейроны во время активации и, следовательно, выделяет медиатор (Trifonov, 1968). Медиатором в фоторецепторах позвоночных животных является глутамат (Copenhagen, Jahr, 1989).
В настоящее время известно, что деполяризация фоторецептора, регистрируемая в темноте, обусловлена катионами, постоянно входящими в наружный сегмент фоторецептора. Этот вход катионов (натрия и кальция) (так называемый «темновой ток») осуществляется через каналы, управляемые циклическими нуклеотидами (в данном случае циклическим гуанозин-монофосфатом (цГМФ-чувствительные каналы), расположенные на мембране наружного сегмента фоторецептора (Fesenko e.a., 1985). Свет уменьшает число открытых каналов, управляемых цГМФ, и, следовательно, снижает вход в клетку катионов, обеспечивая, таким образом, гиперполяризацию мембраны фоторецептора.
Постоянный вход в клетку натрия и кальция через открытые в темноте цГМФ-управляемые каналы приводит к росту внутриклеточной концентрации этих катионов. Избыток внутриклеточного Na+ постоянно удаляет из клетки Na-K АТФ-аза внутреннего сегмента, а избыток кальция выводится из клетки Na+ /Ca2+-K+ белком — обменником (NCKX — Na/Ca,K exchanger), представленным почти исключительно на мембране наружного сегмента фоторецептора (Krizaj, Copenhagen, 1998). Вывод кальция из клетки является электрогенным процессом и приводит к возникновению дополнительного входного тока катионов через мембрану фоторецептора (Yau, Nakatani, 1984), поскольку выход из клетки одного катиона Ca2+ и одного катиона К+ сопровождается входом четырех катионов Na+ (Cervetto å.à., 1989).
Регуляция концентрации кальция в наружном и во внутреннем сегментах фоторецептора осуществляется через разные механизмы. Так, на мембране внутреннего сегмента палочек не обнаружен Na+/ Ca2+-K+ обменник, но выявлена Са2+-АТФ-аза, обеспечивающая удаление избытка внутриклеточного кальция в этой части клетки, но отсутствующая в наружном сегменте фоторецептора (Krizaj, Copenhagen, 1998).
Сведения о содержании и изменении кальция в колбочках мало- численны. Однако данные, полученные на сетчатке саламандры, свидетельствуют о том, что концентрация кальция в колбочках меньше,
301
чем в палочках этого животного, но переход к световой адаптации вызывает в колбочках большее изменение внутриклеточного кальция, чем в палочках (Sampath е.а., 1999).
Освещение фоторецептора не только угнетает вход катионов в клетку через цГМФ-управляемые каналы, но и вызывает снижение внутриклеточной концентрации кальция. Это происходит потому, что Na+/ Ca2+-K+ обменник, нечувствительный к свету (Yau, Nakatani, 1985), продолжает удалять кальций их клетки, несмотря на вызванное светом прекращение входного тока этого катиона.
Светозависимые изменения внутриклеточной концентрации кальция играют решающую роль в процессах световой адаптации, поскольку эти катионы модулируют фототрансдукцию на разных этапах
12.2.1.2. Понятие фототрансдукции
Фототрансдукция — это последовательность событий, приводящих к изменению трансмембранных токов наружного сегмента фоторецептора, она начинается с попадания света на молекулу зрительного пигмента. При захвате фотона молекула родопсина (R) становится энзиматически активной (R*) (приобретает активность фермента) и вызывает переход G-белка трансдуцина в активную форму (G*). Трансдуцин, в свою очередь, активирует фосфодиэстеразу (phosphodiesterase — PDE). Активная фосфодиэстераза (PDE*) вызывает гидролиз цГМФ, что приводит к снижению концентрации этого внутриклеточного медиатора и, как следствие, к закрытию cГМФ-управляемых каналов и прекращению входа катионов в клетку. В результате этого мембранный потенциал становится более негативным, чем в темноте, то есть возникает «гиперполяризация» мембраны.
12.2.1.3. Активация зрительного пигмента
Зрительные пигменты (родопсин и пигменты колбочек) относятся к суперсемейству рецепторов, связанных с G-белками (Sakmar, 1998). Как все рецепторы этого типа, пигменты состоят из внеклеточного, внутриклеточного и семи трансмембранных доменов (Н1-Н7) (рис. 12.5). В отличие от других рецепторов, связанных с G-белками, зрительные пигменты состоят из собственно белка — опсина и хромофора. В зрительных пигментах большинства позвоночных, включая млекопитающих, хромофором является 11-цис-ретиналь (А1), а у водных животных — 11-цис-3,4-дигидроретиналь (А2). (Dartnall, Lythgoe, 1965).
302
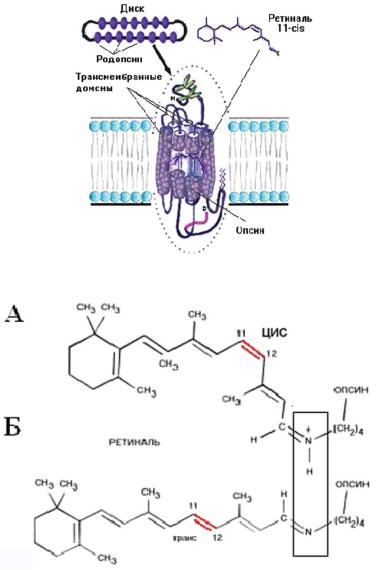
Ðèñ. 12.5. Схематическое изображение молекулы родопсина, расположенного в мембране диска (по Hargrave, 1995).
Ðèñ. 12.6. Структурная формула ретиналя, связанного с опсином. А — в темноте цис-форма ретиналя связана с опсином через протонированное Шифово основание. Б — транс-форма ретиналя после изомеризации, вызванной светом. Шифово основание выделено прямоугольником.
303
Хромофор (ретиналь) ковалентно связан с опсином через протонированное Шифово основание (рис. 12.6). Наличие протонированной формы опсина в зрительных пигментах позвоночных животных обеспечивает чувстивительность рецептора в средневолновой области спектра. Это связано с тем, что свободный ретиналь либо ретиналь, связанный с опсином в непротонированной форме, имеет максимум поглощения в ультрафиолетовом диапазоне (λ=380 нм). Протонизация Шифова основания сдвигает чувствительность пигмента в средневолновый диапазон. Стабилизацию пигмента с протонированным Шифовым основанием, имеющим позитивный заряд, обеспечивает отрицательно заряженный остаток карбоксильной кислоты, расположенный в третьем трансмембранном сегменте и выступающий в качестве первичного контриона (антииона) (Zhukovsky, Oprian, 1989).
Âтемноте 11-цис-ретиналь (хромофор) выполняет функцию сильного антагониста, определяя инактивированное состояние родопсина.
Родопсин имеет крайне низкий уровень спонтанной активности — около 0,031 молекулы/с. Расчеты показывают, что при общем числе молекул 2х109 время ожидания спонтанной изомеризации одной конкретной молекулы составляет около 2000 лет. Высокая стабильность молекулы родопсина обеспечивает незначительный уровень шума при высокой концентрации этого пигмента в дисках палочек (Ratto е.а., 1979).
Захват фотона 11-цис-ретиналем приводит к изомеризации ретиноида из цис-формы в полностью транс-форму (рис. 12.6, Б). Эта изомеризация является единственным светозависимым событием (Wald, 1968). За несколько миллисекунд лиганд из сильного антагониста превращается в сильного агониста, а родопсин (λ=500 нм) (через ряд промежуточных производных с различными спектральными характеристиками — батородопсин, люмиродопсин, метародопсин I — Meta I) превращается в метародопсин II (Meta II). Мета II является активной формой родопсина (R*), характеризуется депротонированным Шифовым основанием и спектральной чувствительностью в коротковолновой области (λ=380 нм) (Menon e.a., 2001).
Âсвою очередь, метародопсин II превращается в неактивную форму — метародопсин III (Meta III). (Okada е.а., 2001). Переход активной формы колбочкового пигмента в неактивную (Meta II в Meta III) происходит в 50 раз быстрее, чем у родопсина (Imai е.а., 1997).
304
В основе активации родопсина лежит механизм «включения контриона», заключающийся в передаче протонов отрицательно заряженному первичному контриону. В результате такого перераспределения заряда, происходящего на стадии люмиродопсина, положение первич- ного контриона, стабилизирующего позитивный заряд протонированного Шифова основания, изменяется (Yan е.а., 2003).
12.2.1.4. Инактивация зрительного пигмента происходит в два этапа: 1) фосфорилирование пигмента, приводящее к снижению активности, 2) связывание фосфорилированного, но еще активного зрительного пигмента с белком аррестином, приводящее к подавлению остаточной активности (Kuhn, Wilden, 1987).
Необходимый уровень инактивации родопсина достигается фосфорилированием нескольких сайтов С-терминали (Mendez e.a., 2000), каждый из которых обеспечивает свой, независимый от других сайтов уровень инактивации пигмента. Предполагается, что множественное фосфорилирование может обеспечивать возможность регуляция времени жизни активированной молекулы родопсина (Doan e.a., 2006).
Фосфориллирование колбочкового пигмента также является необходимым этапом его инактивации. Так, предотвращение фосфорилирования пигмента красных колбочек человека (с помощью точечных мутаций во всех сайтах фосфорилирования) приводит к значительному удлинению светового ответа фоторецептора (Kefalov e.a., 2003).
Фосфорилирование зрительных пигментов осуществляется киназами рецепторов, связанных с G-белками (G-protein Receptor Kinase — GRK). Родопсин киназа (GRK1) и так называемая «киназа колбочкового пигмента» (GRK7) фосфорилируют родопсин и зрительный пигмент колбочек, соответственно. Интересно, что у грызунов (мыши, крысы) один тип киназы (GRK1) представлен как в палочках, так и в колбочках (Lyubarsky e.a., 2000), тогда как у многих видов, включая человека, колбочки содержат два типа киназ (GRK7 и GRK1) (Weisse.a., 2001).
Активность (Tachibanaki e.a., 2005) и концентрация (Wada e.a., 2006) протеин-киназ, обеспечивающих фосфорилирование зрительного пигмента, в колбочках значительно выше, чем в палочках. Полагают, что эти различия могут обусловливать более низкую чувствительность и более быстрое, по сравнению с палочками, выключение колбочек.
305
Активность киназ-рецепторов, связанных с G-белками (GRK) и осуществляющих фосфорилирование активированных зрительных пигментов, регулируют низкомолекулярные белки, связывающие кальций и, в частности, рековерин (Rec) (Chen e.a., 1995; Klenchin e.a., 1995). Буду- чи связанными с кальцием, эти белки угнетают активность киназ. Предполагается, что в темноте, когда внутриклеточная концентрация свободного кальция достаточно велика, связанный с кальцием рековерин подавляет активность родопсин-киназы, предотвращая или угнетая, таким образом, фосфорилирование активированного родопсина (R*). Снижение внутриклеточной концентрации кальция, обусловленное светом, вызывает диссоциацию рековерина и кальция. Свободный от кальция рековерин не оказывает угнетающего влияния на родопсин-кина- зу, что приводит к началу либо усилению фосфорилирования активного родопсина.
Полагают, что в условиях темновой адаптации, когда концентрация внутриклеточного кальция достаточно велика, рековерин усиливает фоточувствительность палочек за счет удлинения времени жизни активированного (фотолизированного) родопсина, поскольку этот белок, в связанной с кальцием форме угнетающий родопсин-киназу, замедляет инактивацию пигмента. Свет, вызывая снижение уровня внутриклеточного кальция, приводит к преобладанию рековерина в форме, свободной от кальция, что ускоряет восстановление пигмента за счет более быстрого фосфорилирования и инактивации родопсина (Hurley, 1995).
Вторая стадия инактивации зрительных пигментов заключается в связывании малоактивного фосфорилированного пигмента с аррестином.
Пигмент, связанный с аррестином, выводится из каскада фототрансдукции. В отработавшем пигменте хромофор отделяется от белка и поглощается пигментным эпителием. Каскад реакций (зрительный цикл), происходящих в клетках пигментного эпителия, преобразует хромофор из полностью trans-формы в полностью cis-форму. (McBee е.а., 2001).
В палочках выявлены две формы аррестина (р48 — полномерная — длинная и р44 — укороченная), возникающие в результате альтернативного сплайсинга и отличающиеся длинной С-конца (Smith e.a., 1994). Обе формы взаимодействуют с фосфорилированным родопсином, но длинная форма аррестина (р48) способна уменьшать активность пигмента, связываясь с активированным родопсином без предварительного фосфорилирования родопсин-киназой (Burns e.a., 2006).
306
Локализация аррестина в фоторецепторе зависит, как и у некоторых других белков, участвующих в фототрансдукции (Whelan,, McGinnis, 1988; Elias е.а., 2004), от адаптации. Интересно, что в светозависимом перераспределении аррестина в фоторецепторе основная роль принадлежит, видимо, длинной форме этого белка (р48), покидающей наружный сегмент палочки при темновой адаптации (Mangini, Pepperberg, 1988).
12.2.1.5. Трансдуцин
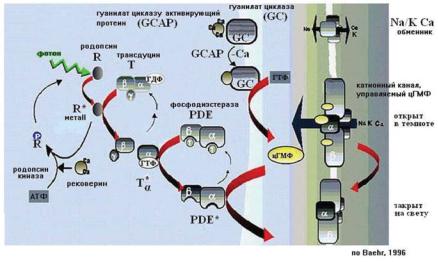
Молекула активированного зрительного пигмента, как и другие рецепторы, связанные с G-белками, взаимодействует с определенным типом G-белка. Таким белком для зрительных пигментов является трансдуцин. Подобно другим G-белкам, трансдуцин состоит из трех глобулярных субъединиц — Gα, Gβ, Gγ и является, таким образом, гетеротримером. Альфа-субъединица G-белка имеет сайт, взаимодействующий с рецептором, и сайт, связанный с гуанозин-дифосфатом (ГДФ — GDP) либо с гуанозин-трифосфатом (ГТФ — GTP) у не активированного и, соответственно, у активированного G-белка. Замену ГДФ на ГТФ вызывает активация рецептора (в данном случае зрительного пигмента), связанного с G-белком (рис. 12.7).
Ðèñ. 12.7. Активация светом родопсина. Последовательность реакций, возникающих при активации (красные стрелки) и при инактивации (черные стрелки) каскада фототрансдукции (по Baehr, 1996).
307
Взаимодействие с трансдуцином молекулы зрительного пигмента, активированной при поглощении фотона, вызывает замену ГДФ, связанного с альфа-субъединицей, на ГТФ. Альфа-субъединица вместе с ГТФ (Тα-GTP) отделяется как от двух других субъединиц G-белка (Gβγ), так и от активированной молекулы зрительного пигмента (R*) и является активной формой трансдуцина (Т* = Тα-GTP = Тα*), передающей сигнал следующему внутриклеточному посреднику — фосфодиэстеразе циклического гуанозин-монофосфата (фосфодиэстераза цГМФ = cGMP PDE = PDE).
Освободившаяся молекула активного зрительного пигмента способна активировать новые молекулы трансдуцина, обеспечивая, таким образом, усиление передаваемого сигнала. По данным разных исследований, одна молекула активного зрительного пигмента способна активировать 20–100 молекул трансдуцина (подробнее в обзорах Fain e.a., 2001; Fu, Yau 2007).
Активность трансдуцина, взаимодействующего с фосфодиэстеразой, прекращается тогда, когда связанный с альфа-субъединицей трансдуцина ГТФ гидролизуется до ГДФ. Сам трансдуцин имеет слабую ГТФ-азную активность, но ее значительно увеличивают белки, активирующие ГТФ-азную активность (GTPase activaiting protein — GAP). Среди этих белков основным является белок, относящийся к семейству «регуляторов сигнальных G-белков» (regulator of G-protein-signaling — RGS) (He e.a., 1998), образующий комплекс с двумя другими белками (Makino e.a., 1999), один из которых связывает комплекс с мембраной (Hu, Wensel, 2002). Активацию этого белкового комплекса вызывают, в частности, некаталитические α-субъединицы фосфодиэстеразы цГМФ после ее взаимодействия с трансдуцином (Angleson,Wensel, 1994).
Трансдуцин в палочках отличается от трансдуцина в колбочках способностью к перемещению из наружного сегмента фоторецептора во внутренний при переходе от темновой адаптации к яркому свету (Brann, Cohen, 1987).
Механизм светозависмого перераспределения трансдуцина в палочках не известен, но обусловлен, видимо, особенностями изоформ субъединиц трансдуцина, представленных в колбочках (Gαt2Gβ3γ8) и в палочках (Gαt1Gβ1γ1) (Lerea е.а., 1986), отличающихся, в частности, набором жирных кислот, обеспечивающих связь с мембраной диска. Полагают, что относительная непрочность этой связи у изоформ субъединиц трансдуцина в палочках определяет возможность перемещения белка (Kassai е.а., 2005).
308
Недавние исследования показали, что перераспределение трансдуцина в палочках зависит от способности комплекса белков, активирующих ГТФ-азную активность трансдуцина, обеспечить инактивацию связанного с ГТФ трансдуцина. Полагают, что, когда клетка не способна инактивировать весь трансдуцин, связанный с ГТФ, оставшаяся часть активного трансдуцина может отделиться от мембраны и выйти из наружного сегмента (Lobanova e.a., 2007; см. обзор Calvert e.a., 2006).
Перераспределение трансдуцина рассматривается как возможный механизм, обеспечивающий выключение высокочувствительных пало- чек при переходе к колбочковому зрению в условиях больших интенсивностей света (Sokolov е.а., 2002; Elias е.а., 2004; Calvert e.a., 2006; Lobanova e.a., 2007).
12.2.1.6. Фосфодиэстераза цГМФ (cGMP PDE)
Третьим компонентом фототрансдукции является фосфодиэстераза цГМФ, активруемая при взаимодействии с активным трансдуцином. Фосфодиэстераза цГМФ состоит из двух каталитических субъединиц α и β и двух одинаковых γ-субъединиц (Baehr е.а., 1979; Hurley, Stryer, 1982). В темноте гамма-субъединицы блокируют активность каталити- ческих единиц, предотвращая гидролиз цГМФ. На свету с каждой гам- ма-субъединицей фосфодиэстеразы взаимодействует альфа-субъединица трансдуцина, связанная с ГТФ. В результате этого взаимодействия происходит смещение некаталитических γ-субъединиц, приводящее к разблокированию каталитических α- и β-субъединиц фосфодиэстеразы (Catty е.а., 1992). Активированная фосфодиэстераза цГМФ (PDE*) обладает высокой каталитической активностью и осуществляет гидролиз сГМФ с предельно высокой скоростью (сопоставимой со скоростью диффузии воды) — около 2000 мол/с (Leskov е.а., 2000). Благодаря такой высокой активности фосфодиэстеразы, усиление передаваемого сигнала происходит и на этом этапе фототрансдукции, несмотря на то что для активации одной молекулы фермента необходимо две молекулы активированного трансдуцина.
Следует отметить, что усиление сигнала происходит при количе- ственном уменьшении каждого последующего компонента фототрансдукции. Количественно три основных компонента фототрансдукции — родопсин, трансдуцин, фосфодиэстераза — соотносятся как 100:10:1.
309
