
Александров Ю.И., Анохин К.В. - Нейрон. Обработка сигналов. Пластичность. Моделирование_ Фундаментальное руководство (2008)
.pdfсвойствам и кинетике активации (инактивации). Большинство Ca2+-ка- налов активируется при деполяризации от –20 до –10 мВ. Эти каналы
проводят токи IL, IN è IP.
Высокопороговые Ca2+-каналы добавляют порцию деполяризации при генерации ПД, но более важное их значение состоит в том, что Ca2+, попадая в клетку, активирует Ca2+-зависимые K+-токи, которые
обеспечивают реполяризацию мембраны.
IL (Long-lasting, продолжительный) имеет высокий порог актива-
ции (около –10 мВ).
IN (Neither, ни тот, ни другой; имеется в виду ни IT, íè IL; когда был открыт IN, были известны только IT è IL) активируется при –20 мВ, инактивируется при поддерживающейся деполяризации и модулируется разными медиаторами. В некоторых типах клеток IN вовлекается в
процесс высвобождения медиатора из синаптической терминали.
IP (Purkinje) впервые зарегистрирован в клетках Пуркинье (рис. 6.35), активируется при относительно высоком уровне деполяризации. Этот ток обеспечивает генерацию дендритических Ca2+-спайков, которые модулируют частоту разряда нейрона, прерывая тоническую последо-
вательность соматических Na+/K+ ÏÄ.
Единственный низкопороговый Са2+-òîê IT (transient, фазический) обеспечивает ритмический разряд (пачки) ПД. Этот ток активируется при –65 ì (Na+/K+ ПД имеет порог –55 мВ) и инактивируется при устойчивой деполяризации. IT обеспечивает длительные Ca2+-спайки продолжительностью 50-100 мс. Такая деполяризация снижает порог для Na+/K+ ПД, и нейрон генерирует высокочастотные пачки импульсов.
Ê+-òîêè
Поскольку эти токи выходящие, они обеспечивают не только реполяризацию мембраны, но и влияют на вероятность генерации П. K+-токи разделяют по их чувствительности к величине мембранного потенциала, кинетике активации и инактивации, а также блокаде фармакологическими агентами.
IK (задержанный, выпрямленный К+-ток) активируется при -40 мВ, а затем медленно инактивируется. Его активация наступает несколько позже, чем активация фазического INa,t-тока, ответственного за генерацию ПД. IK обеспечивает реполяризацию и следовую гиперполяриза-
цию мембраны после развития ПД.
Ñà2+-активируемые Ê+-òîêè (IK,Ca) активируются при увеличе- нии внутриклеточной концентрации Са2+. Выделяют два Са2+-зависи-
ìûõ òîêà.
180
IC увеличивается с деполяризацией мембраны. Регулирует частоту ПД при продолжительной деполяризации, обеспечивая гиперполяризацию после каждого ПД. Поскольку IC зависит от потенциала, он инактивируется сразу после реполяризации мембраны. Инактивация ограничивает временной интервал влияния IC до 10 мс или меньше.
IAHP (AfterHyperPolarization, следовая гиперполяризация) в отли- чие от IC значительно медленнее и слабо зависит от потенциала. Обеспечивает длительную следовую гиперполяризацию после серии высокочастотных ПД, уменьшая частоту разряда нейрона при устойчивой деполяризации, тем самым обеспечивая частотную адаптацию импульсной активности.
IA (фазический К+-ток) активируется при –60 мВ и быстро инактивируется. Инактивация этого тока устраняется после реполяризации мембраны. IA задерживает процесс генерации первого ПД, а также снижает частоту разряда нейрона при устойчивой деполяризации.
IM (мускарин-чувствительный К+-ток) активируется при –65 мВ, не инактивируется со временем и блокируется стимуляцией мускариновых холинергических рецепторов. Из-за медленной кинетики активации и умеренной амплитуды не влияет существенно на форму ПД, но вносит вклад в медленную адаптацию частоты спайкового разряда при устойчивой деполяризации. В мембранах нейронов найден аналогич- ный ток IS , который блокируется стимуляцией серотониновых метаботропных рецепторов.
Ih, обозначаемый также IQ èëè If, активируется при гиперполяризации мембраны, возвращая потенциал к более позитивному уровню. Ih относительно медленный и переносится ионами К+ è Na+. Активация Ih приводит к медленной деполяризации, после которой развивается пейсмейкерный разряд (например, в нейронах уздечки), приводящий к активации Na+/Ê+- è/èëè Ñà2+-спайков.
IK,leak (ток утечки) обеспечивает вклад в ПП мембраны. Блокирование этого тока нейромодуляторами может приводить к длительному изменению мембранного потенциала.
6.8.11. Молекулярная структура потенциал-зависимых каналов
Na+- è Ñà2+-каналы
Методами биохимии и молекулярной биологии была определена аминокислотная последовательность белка потенциал-зависимого Na+-канала электрического органа угря и клонирована ДНК, кодирующая этот белок.
181
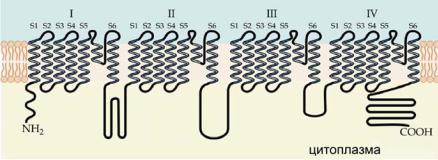
Na+-канал представляет собой белковую молекулу, состоящую из 1832 аминокислот, с четырьмя доменами (I-IV), соединенными внутриклеточ- ными петлями (рис. 6.37). Каждый домен, состоящий из 300-400 аминокислотных остатков, имеет шесть трансмембранных участков (S1-S6). Домены Na+-канала располагаются кольцом вокруг поры ионного канала. Структура, формирующая ионую пору, располагается между 5-м и 6-м сегментами. Сегмент S4, который имеется во всех четырех доменах, несет положительно заряженный аргининовый или лизиновый остаток в каждой третьей позиции трансмембранного сегмента. Предполагается, что это свойство обеспечивает чувствительность канала к электрическому полю, и оно имеется у всех потенциал-зависимых ионных каналов.
Ðèñ. 6.37. Молекулярная структура Na+-канала. Канал представляет собой белковую молекулу с четырьмя доменами (I-IV), соединенными внутриклеточными петлями. Каждый домен имеет шесть трансмембранных участков (S1-S6). Структура, формирующая ионую пору, располагается между 5-м и 6-м сегментами.
Аналогичные белки-каналы были найдены и в других тканях: в мозге млекопитающих, в скелетной и сердечной мышцах. Потенциалзависимые Са2+-каналы имеют такую же структуру и те же функциональные участки, что и Na+-каналы.
Ê+-каналы
Имеется два больших класса K+-каналов, определяемых с помощью трансмембранной топологии:
—Kv-каналы (voltage-gated, потенциал-зависимые) состоят из одинаковых доменов (тетрамеры), каждый из которых представлен шестью трансмембранными участками белка (S1-S6);
—Kir–каналы (inward-rectifier, внутреннего выпрямления) состоят из четырех одинаковых доменов (тетрамеры), каждый из которых пред-
182
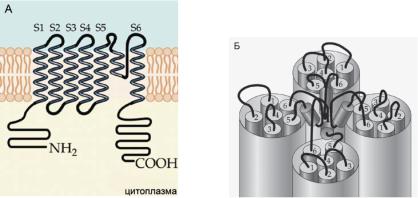
ставлен двумя трансмембранными участками белка M1 и M2, аналогичными трансмембранным петлям S5 и S6 доменов других потенци- ал-зависимых каналов.
Kv-каналы
Kv-канал является тетрамером и представлен ансамблем из четырех субъединиц (рис. 6.38). Каждая субъединица К+-канала похожа на одиночный домен Na+-канала. Так же, как и у Na+-каналов, структура, формирующая ионую пору, располагается между 5-м и 6-м сегментами, а сегмент S4 обеспечивает чувствительность канала к электрическому полю.
Ðèñ. 6.38. (А) Молекулярная структура субъединицы КV-канала. Субъединица КV-канала похожа на одиночный домен Na+-канала. (Б) Предполагаемая трехмерная структура канала. Канал представлен ансамблем из четырех субъединиц (тетрамер).
Kir-каналы
Выделено, по крайней мере, пять разновидностей этих каналов. Некоторые из них активируются через метаботропные рецепторы с участием G-белков, цАМФ и Ca2+. Кроме того, фосфорилирование и дефосфорилирование этих каналов влияет на механизм их активации. Каналы из этого класса обеспечивают ток ионов К+ в клетку, когда мембранный потенциал отрицателен по отношению к равновесному потенциалу К+ (каналы, пропускающие ток Ih). По структуре эти каналы являются тетрамерами, ионная пора у которых сформирована трансмембранными участками M1 и M2 (рис. 6.39).
183
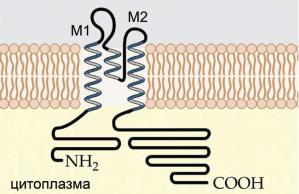
Ðèñ. 6.39. Молекулярная структура субъединицы КIR-канала. Трансмембранные участки М1 и М2 субъединицы КIR-канала гомологичны S5 и S6 петлям субъединиц других каналов. КIR-канал так же, как и КV-канал, представлен ансамблем из четырех субъединиц (тетрамер).
6.8.12. Транспортные системы в мембране нейронов
Различают два механизма транспорта: системы активного транспорта с использованием энергии гидролиза АТФ и обменники, работающие за счет ионных электрохимических градиентов (главным образом, ионов Na+).
6.8.12.1. Механизм активного транспорта
Количество ионов, которые входят в клетку и выходят из нее во время генерации ПД, в действительности очень мало по сравнению с числом ионов, имеющихся в клетке. Например, во время генерации одного ПД гипотетическим сферическим нейроном диаметром 25 мкм концентрация внутриклеточного Na+ изменяется примерно на 6 мкМ (от 15 мМ до 15,006 мМ). Однако даже такие малые изменения концентрации ионов Na+, сопровождающиеся также постоянной «утечкой» ионов К+ в покое, нарушают соотношение концентраций ионов и таким образом приводят нейрон в нефункциональное состояние. Чтобы компенсировать такие нарушения концентраций ионов, нейронные мембраны обладают специализированными белковыми макромолекулами, известными как ионные насосы.
Механизм активного транспорта переносит через мембрану ионы против их пассивного потока по электрохимическому градиенту и обес-
184
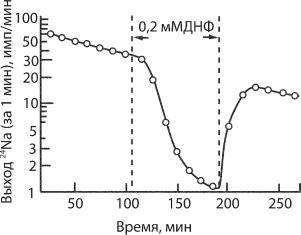
печивает трансмембранную разность потенциалов (ПП). В 1950-х гг. Дж. Скоу показал, что АТФаза в нерве краба выполняет роль Na+/Ê+- насоса. В этих исследованиях после длительной стимуляции аксона, погруженного в раствор с радиоактивным изотопом 24Na+, через равные интервалы времени измеряли выход этого иона из аксона (рис. 6.40). При действии блокатора реакции окислительного фосфорилирования (с участием фермента АТФазы) динитрофенола выход 24Na+ резко снижался. После того как препарат отмывали от блокатора, выход 24Na+ возобновлялся.
Ðèñ. 6.40. Выход из аксона 24Na+ в присутствии блокатора реакции окислительного фосфорилирования (с участием фермента АТФазы) динитрофенола (ДНФ). При добавлении в среду 0,2 мМ ДНФ выход 24Na+ резко снижался. После того как препарат отмывали от ДНФ, выход 24Na+ возобновлялся.
На основе этих и дальнейших экспериментов была разработана модель работы Na+/Ê+-АТФазы (рис. 6.41). Переносчик (Na+/K+-на- сос) выводит из клетки три иона Na+ и вводит в нее два иона К+, то есть удаляет из клетки положительные заряды, внося прямой вклад в поддержание ПП. На внутренней стороне мембраны переносчик расщепляет АТФ, связывается с остатком фосфата и тремя ионами Na+ и переносит их наружу. На внешней стороне мембраны переносчик теряет остаток фосфата, связывается с двумя ионами К+ и переносит их внутрь клетки.
185
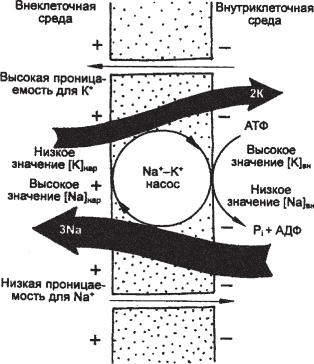
Ðèñ. 6.41. Принцип работы Na+/K+-насоса. Объяснения в тексте.
Другим примером активного ионного транспорта являются АТФазы, выводящие Са2+ из цитоплазмы. Са2+-АТФазы плазматической мембраны выкачивают Са2+ во внеклеточное пространство. Са2+-АТФазы эндоплазматического (в нейронах) и саркоплазматического (в мышцах) ретикулумов, а также митохондрий закачивают кальций из цитоплазмы во внутриклеточные мембранные структуры. В мембране клеточных органелл Са2+-АТФаза связывается со стороны цитоплазмы с двумя ионами Са2+. При ее фосфорилировании происходит перенос ионов Са2+ внутрь ретикулума, после освобождения переносчик дефосфорилируется и возвращается в исходное положение. В отличие от Са2+- АТФазы мембран клеточных органелл Са2+-АТФаза плазматической мембраны переносит только один Са2+.
В мембране везикул протонный насос с использованием энергии АТФ переносит внутрь везикул Н+, поддерживая низкий уровень PH.
186
6.8.12.2. Ионные обменники
Ограничимся лишь перечислением транспортных систем без подробного анализа их работы. Концентрация внутриклеточного Са2+ также регулируется Na+/Ca2+-обменником, то есть Са2+ выводится из клетки за счет градиента ионов Na+, направленного внутрь клетки. Причем этот обменник при некоторых физиологических условиях (при значи- тельной деполяризации) может работать в противоположном направлении.
Другой обменник, переносящий Са2+, найден в мембранах фоторецепторов сетчатки. Этот обменник дополнительно к градиенту Na+ использует градиент ионов К+ и при переносе Са2+ наружу вместе с ним переносится и К+.
Концентрация Cl– поддерживается благодаря работе хлорид-бикар- бонатного насоса, который обменивает ион Cl– (наружу) на ион Na+ (внутрь) и ион HCO3– (внутрь). Еще один механизм транспорта Cl– — ýòî Ê+/Cl– котранспорт (Cl– выводится вместе с К+).
Внутриклеточный уровень РН поддерживается благодаря Na+/Í+- насосу, обменивающему один Н+ (наружу) на один Na+ (внутрь).
Транспорт медиаторов из внеклеточного пространства в нейрон также обеспечивается перемещением ионов. Транспорт глутамата сопряжен с входом двух ионов Na+ и выходом одного иона К+, при этом из клетки выводится один ион ОН- (èëè ÍÑÎ3-). ГАМК, глицин и моноамины (норадреналин, дофамин и серотонин) транспортируются за счет входа в нейрон двух ионов Na+ и одного иона Cl-. После гидролиза ацетилхолина в синаптической щели холин закачивается в аксонную терминаль так же, как ГАМК, глицин и моноамины.
Транспорт нейромедиаторов из цитоплазмы внутрь везикул основан на перемещении протонов. Моноамины и ацетилхолин транспортируются в везикулу за счет энергии двух протонов, выходящих из нее. Аминокислоты ГАМК, глицин и глютамат транспортируются в везикулу в обмен на один протон, при этом вместе с глютаматом в везикулу входит один ион Cl-.
6.9. Проведение потенциала действия по нервному волокну
Клетки сообщаются друг с другом посредством лишь двух типов сигналов — градуальных и импульсных. Градуальные потенциалы возникают в мембранах чувствительных окончаний сенсорных рецепторов и в мембранах нейронов, а ПД — в проводящих
187
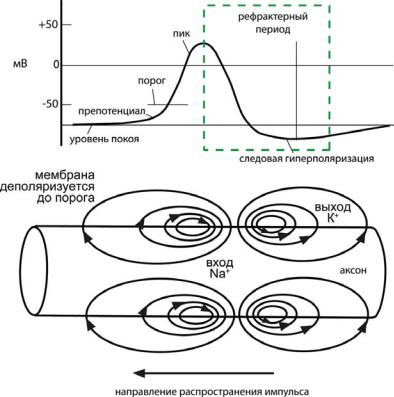
структурах: аксонах и иногда в дендритах. Рецепторные потенциалы пассивно распространяются по окончаниям нервных клеток за счет кабельных свойств мембран и постепенно затухают. Поэтому эти потенциалы не могут распространяться на большие расстояния. Для передачи информации на большие расстояния в ЦНС генерируются ПД.
Ðèñ. 6.42. Генерация ПД в локальном участке волокна. Объяснения в тексте.
6.9.1. Проведение ПД в немиелинизированных аксонах
Передача ПД по немиелинизированному нервному волокну зависит от пассивного распространения тока в соседние участки мембраны. Размер участка, который деполяризован пришедшим ПД, зависит от его длительности и скорости проведения возбуждения по мембра-
188
не. Если в соседнем участке мембраны потенциал на переднем фронте ПД достигает порога, активируются потенциал-зависимые Na+-ка- налы, что приводит к возникновению мощного входящего тока и генерации ПД в данном участке (рис. 6.42). Позади от пика ПД активируется потенциал-зависимая К+-проводимость, которая вызывает реполяризацию мембраны до уровня ПП. ПД обычно движется в одну сторону, так как инактивация Na+-каналов препятствует повторной
деполяризации мембраны.
Скорость распространения ПД в немиелинизированных аксонах определяется величиной тока, генерируемого в активном уча- стке, и кабельными свойствами волокна. Скорость распространения тока прямо зависит от λ и обратно зависит от τ. Как было показано выше (параграф 6.7), λ пропорциональна квадратному корню диаметра волокна, поэтому толстые волокна проводят возбуждение быстрее, чем тонкие. Постоянная времени τ, как произведение удельного сопротивления и удельной емкости мембраны (RmCm), не зависит от размера волокна.
6.9.2. Миелинизированные аксоны и сальтаторная проводимость
Нервные волокна позвоночных обычно миелинизированы. Миелиновую оболочку вокруг аксонов в ЦНС образуют олигодендроциты, а в периферических нервах — шванновские клетки. Миелинобразующие клетки плотно облегают аксоны нейронов, формируя тесно упакованные ламели (рис. 6.43), число которых достигает нескольких десятков. Миелиновая оболочка создает высокое сопротивление мембраны, при этом существенно снижается и мембранная емкость.
Миелиновая оболочка прерывается участками без миелина (перехватами Ранвье). Расстояние между соседними перехватами до 100 раз превосходит внешний диаметр волокна. Благодаря изолирующей функции миелиновой оболочки, ток при возбуждении миелинизированных аксонов протекает, главным образом, по перехватам, «перескакивая» покрытые миелином участки (рис. 6.44). Такое скачкообразное (сальтаторное от лат. saltore — прыгать) возбуждение значительно повышает скорость распространения ПД по аксону. При этом генерация ПД может происходить сразу в нескольких перехватах. Миелинизированные аксоны способны проводить нервные импульсы с более высокой частотой в течение длительного периода. При активации небольшого
189
