
Александров Ю.И., Анохин К.В. - Нейрон. Обработка сигналов. Пластичность. Моделирование_ Фундаментальное руководство (2008)
.pdf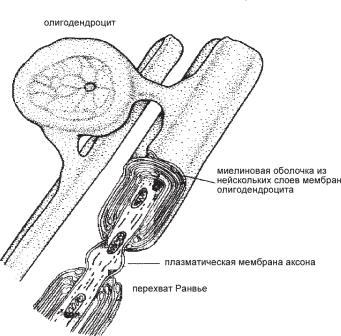
межперехватного участка через мембрану проходит меньшее число катионов, и энергозависимая система активного транспорта переносит меньше ионов, успевая полностью восстановить исходные концентрационные градиенты.
Ðèñ. 6.43. Миелиновая оболочка (в разрезе), образованная олигодендроцитом вокруг аксона нейрона мозга.
6.9.3. Скорость проведения в миелинизированных волокнах
Скорость проведения ПД в миелинизированных аксонах, измеренная у многих объектов, составляет от нескольких до 200 м/с. Скорость проведения любого электрического кабеля зависит от соотношения поперечного и продольного сопротивления. Утолщение миелиновой оболочки приводит к увеличению сопротивления мембраны аксона. В то же время с увеличением толщины миелиновой оболочки уменьшается площадь поперечного сечения аксоплазмы, что приводит к увеличению ее внутреннего продольного сопротивления. Первое влечет за собой ускорение проведения, второе, на-
190
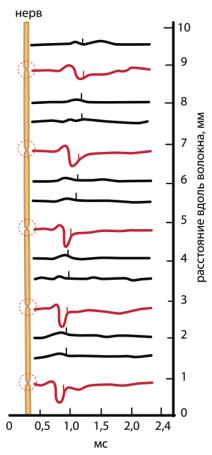
Ðèñ. 6.44. Возбуждение миелинизированного волокна с перехватами Ранвье. При активации аксона регистрирующий электрод перемещали вдоль нервного волокна от участка стимуляции (0 на шкале расстояния). Импульсы регистрировались только от участков (выделены), свободных от миелина. Метод позволяет измерять как входящие токи в перехватах, так и продольные токи в межперехватных участках, предоставляя возможность определить положение перехватов Ранвье и расстояния между ними.
против, — его замедление. Оптимальная толщина миелина достигается, когда диаметр аксона составляет около 0,7 от внешнего диаметра волокна, в периферических нервах млекопитающих это отно-
191
шение варьирует от 0,6 до 0,8. Оптимальное расстояние между перехватами, обеспечивающее максимальную скорость, превосходит диаметр аксона примерно в 100 раз.
6.9.4.Ионные каналы в миелинизированных волокнах
Âмиелинизированных волокнах Na+-каналы сконцентрированы в перехватах Ранвье, а К+-каналы локализованы в приперехватных областях оболочки. Как показали специальные исследования, при возбуждении в перехватах Ранвье возникает лишь потенциал-зависимый входящий Na+-ток, а реполяризация обеспечивается не за счет потенциалзависимой К+-проводимости, а в результате быстрой инактивации Na+-каналов и тока утечки с высокой проводимостью. После очистки от миелина участка, соседнего с перехватом Ранвье, в нем был зарегистрирован выходяший К+-òîê, à Na+-ток отсутствовал.
6.9.5. Фактор надежности проведения ПД
Фактор надежности проведения — это отношение амплитуды деполяризации, которую создает ток активированного перехвата в следующем перехвате, к пороговому уровню активации потенциал-зави- симых Na+-каналов. В миелинизированных периферических волокнах позвоночных фактор надежности примерно равен 5. На участках, где исчезает миелиновая оболочка (в непосредственной близости от аксонной терминали аксона мотонейрона), ток из последнего перехвата распределяется на существенно большую площадь немиелинизированной мембраны нервного окончания. Снижение плотности тока на мембране производит меньшую деполяризацию, чем в перехватах Ранвье. По-видимому, по этой причине последние межперехватные участки перед немиелинизированным окончанием обычно укорачи- ваются. Благодаря этому, большее количество одновременно активированных перехватов создает достаточную плотность токов для деполяризации нервного окончания.
6.9.6. Проведение ПД в дендритах
Дендритные ПД, вызываемые потенциал-зависимыми Na+- è Ñà2+- токами, обнаружены во многих типах нервных клеток. Как было показано, в удаленных от сомы дендритах клеток Пуркинье мозжечка генерируются Са2+-спайки. Такие же спайки возникают и в дендритах корковых пирамидных нейронов (рис. 6.45).
192
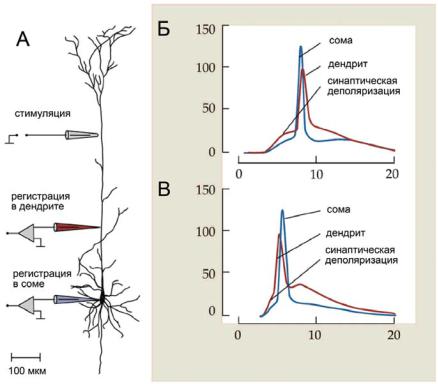
Ðèñ. 6.45. Проведение ПД в пирамидном нейроне коры мозга. (А) Схема расположения электродов для стимуляции и регистрации. (Б) Умеренная деполяризация в результате активации дистального дендрита пассивно распространяется к соме и вызывает соматический ПД. (В) Более высокий уровень деполяризации вызывает Са2+-ПД в дендрите.
Умеренная синаптическая активация вызывает деполяризацию дендритов, которая пассивно распространяется к соме и вызывает сомати- ческий ПД (рис. 6.45, Б). Этот ПД распространяется обратно в дендрит и регистрируется там сразу после соматического. Более сильная синаптическая активация приводит к генерации Са2+-ПД в дендрите, который регистрируется раньше соматического (рис. 6.45, В).
Следует отметить, что распространение ПД в дендрите представляет собой гораздо более сложный процесс, чем в аксоне. Во-первых, в мембране аксона подпороговые изменения потенциала не влияют на
193
пассивные свойства мембраны. В мембранах дендритов, кроме обыч- ных Na+/Ê+- è Ñà2+-механизмов генерации ПД, обнаружен целый ряд потенциал-зависимых проводимостей. Кроме того, на мембранах дендритов оканчиваются многочисленные синапсы, при активации которых генерируются ПСП. Поэтому функциональное значение и механизмы генерации ПД в дендритах требуют дальнейшего исследования.
Выводы
•Потенциал покоя определяется, главным образом, разностью концентраций К+ по обе стороны мембраны, поскольку в покое мембрана проницаема главным образом для ионов К+. При уравнивании сил диффузии (К+ выходит наружу по концентрационному градиенту) и электрического поля (К+ движется в цитоплазму под действием притяжения органическими ионами) на мембране устанавливается равновесный потенциал для иона К+.
•В потенциал покоя вносят вклад концентрационные градиенты других ионов (Na+, Ñà2+, Cl– è H+), а также транспортные системы, которые переносят ионы против их концентрационных градиентов с использованием энергии АТФ или энергии концентрационных градиентов некоторых ионов.
•Под действием некоторых медиаторов ионнотропные рецепторы открывают ионные каналы (прямая синаптическая передача), через которые течет смешанный катионный ток (Na+/K+-ток и иногда Ca2+- ток), который называют возбуждающим постсинаптическим током (ВПСТ). В результате в нейронах и мышечных волокнах генерируются возбуждающие постсинаптические потенциалы (ВПСП), которые деполяризуют мембрану.
•ВПСТ деполяризует мембрану до уровня потенциала реверсии, который в случае одного иона равен его равновесному потенциалу, а в случае нескольких ионов складывается из суммы равновесных потенциалов для каждого иона.
•Некоторые ионотропные рецепторы при взаимодействии с медиатором открывают каналы, через который течет Cl--ток, который гиперполяризует мембраны нейронов. Этот ток называют тормозным постсинаптическим током (ТПСТ), а потенциалы, которые генерируются при его действии, — тормозными постсинаптическими потенциалами (ТПСП).
•Тормозные синапсы могут присутствовать на пресинаптических мембранах. Их тормозное действие проявляется в ослаблении или ус-
194
транении деполяризации аксонной терминали, что приводит к ослаблению Са2+-токов и уменьшению выделения медиатора.
•При активации метаботропных рецепторов (непрямая синапти- ческая передача) в мембранах нейронов и различных эффекторов возникают постсинаптические потенциалы, обусловленные, главным образом, выходящими Ê+-токами. Эти токи производят тормозный эффект, препятствуя деполяризации мембраны.
•Иногда активация метаботропных рецепторов приводит, напротив, к закрытию Ê+-каналов, что является возбуждающим эффектом, устраняющим торможение. Возбуждающим эффектом метаботропных рецепторов является также устранение инактивации потенциал-зави- симых Са2+-каналов (глава 5).
•Пассивные электрические свойства мембран нейронов и их отростков (сопротивление и емкость мембраны, а также сопротивление цитоплазмы) способствуют распространению электрических потенциалов.
•Кабельные свойства мембран влияют на возбудимость нейронов,
àтакже на проведение потенциалов по их отросткам. Кроме того, на проведение потенциалов оказывает влияние пространственная конфигурация нейронных отростков.
•Потенциалы, возникающие в сенсорных рецепторах, и постсинаптические потенциалы распространяются по мембранам на небольшие расстояния, постепенно уменьшаясь по амплитуде.
•Потенциал действия генерируется при деполяризации мембраны аксона до порогового уровня активации потенциал-зависимых Na+- каналов.
•Потенциал-зависимый процесс инактивации Na+-каналов, а также открытие потенциал-зависимых К+-каналов приводят к реполяризации мембраны.
•Процесс инактивации Na+-каналов определяет свойство рефрактерности возбудимых мембран.
•В мембранах нейронов обнаружены многочисленные потенциалзависимые каналы, проводящие катионные токи. Эти токи оказывают влияние на процесс генерации потенциалов действия и на рефрактерность мембран.
•В дендритах некоторых нейронов потенциал действия генерируется и распространяется при активации потенциал-зависимых Са2+-каналов.
•Потенциал-зависимые Na+- è Ñà2+-каналы состоят из четырех белковых субъединиц, каждая из которых представлена шестью трансмембранными участками. Потенциал-зависимые К+-каналы состоят также
195
из четырех белковых субъединиц, но для разных видов каналов субъединица представлена двумя или шестью трансмембранными участками.
•Ионные градиенты между цитоплазмой нейрона и внеклеточной средой (или средой внутриклеточных органелл) поддерживаются транспортными системами. Механизм активного транспорта обеспечивается АТФазами — ионными насосами, использующими энергию АТФ. Эти насосы перекачивают ионы Na+, Ê+, Ñà2+ è Í+ (внутрь везикул) против их концентрационных градиентов.
•Ионные обменники переносят через мембраны ионы, медиаторы
èдругие вещества с использованием ионных градиентов Na+ è H+.
•Потенциал действия распространяется по волокнам без миелина с большой скоростью на большие расстояния. Скорость распространения зависит от кабельных свойств аксона и увеличивается с диаметром волокна.
•В миелинизированных волокнах скорость проведения потенциала действия существенно увеличивается в результате «перескакивания» ионных токов через изолированные миелином участки.
Цитированная литература
Рекомендуемая
1.Ашмарин И. П. Биохимия мозга. СПб.: Изд-во С.-Петербургского ун-та,
1999.
2.Николс Дж. Г., Мартин А. Р., Валлас Б. Дж., Фукс П. А. От нейрона к мозгу. М.: Едиториал УРСС, 2003.
3.Смит К. Биология сенсорных систем. М.: Бином. Лаборатория знаний,
2005
4.Шульговский В. В. Физиология центральной нервной системы. М.: МГУ,
1997.
5.Эккерт Р., Рэнделл Д., Огастин Дж. Физиология животных. Механизмы
èадаптация. М.: Мир, 1991.
Дополнительная
1.Гранит Г. Основы регуляции движений. М.: Мир, 1973.
2.Катц Б. Нерв, мышца, синапс. М.: Мир, 1968.
3.Костюк П. Г., Крышталь О. А. Механизмы электрической возбудимости нервной клетки. М.: Наука, 1981.
4.Руководство по физиологии. Общая физиология возбудимых мембран. Л.: Наука, 1973.
5.Ходжкин А. Нервный импульс. М.: ИЛ, 1965.
6.Хухо Ф. Нейрохимия. Основы и принципы. М.: Мир, 1990.
196
Глава 7. СИНАПТИЧЕСКАЯ ПЕРЕДАЧА СИГНАЛОВ
В главе рассматриваются механизмы передачи сигналов между нервными клетками и их мишенями, основные принципы строения и функционирования синаптических связей. Включено краткое описание истории формирования клеточной теории строения мозга, нейронной доктрины и теории химической синаптической передачи.
Особый акцент в тексте главы делается на многообразие типов синапсов. Общие принципы строения и функционирования химических синапсов дополняются данными, полученными на идентифицируемых нейронах и синапсах. Подчеркивается сходство общих принципов синаптической передачи у беспозвоночных и высших позвоночных животных, проявляющееся и на нейронном, и на молекулярном уровнях.
7.1. История теории химической передачи нервного импульса
В XIX веке морфологи и гистологи добились больших успехов в изучении тонкого строения нервных тканей. Ян Пуркинье в 1836 году впервые описал в мозжечке клетки, которые сегодня известны как «клетки Пуркинье». Дейтерс (1865) дал название «протоплазматическим отросткам», «осевому цилиндру» и «аксонному холмику». Гис (1886) описал эмбриогенез клеток мозга, а Форель (1887) показал, что клетки мозга могут повреждаться индивидуально. Эти достижения были в большой степени связаны с использованием новых методов окраски нервных тканей, наиболее известным из которых является окраска (импрегнация) солями серебра. Именно этим методом получены данные, подтвердившие правильность клеточной теории и в отношении нервных тканей, хотя создатель метода был с этим не согласен.
Импрегнацию серебром придумал и впервые применил для окрашивания тканей нервной системы (НС) известный итальянский нейрогистолог Камилло Гольджи (1973). Он опробовал этот метод на обонятельной луковице (1875), а в 1885 году вышла монография по тонкой анатомии структур центральной нервной системы (ЦНС), иллюстрации для которой были подготовлены по результатам использования метода окраски солями серебра (рис. 7.1). Сегодня метод импрегнации серебром так и называется «импрегнация по Гольджи», или «окраши-
197
вание по Гольджи» (Golgi impregnation, Golgi staining). Многие современные знания о нервной системе получены с использованием этого метода и его модификаций.
A |
Á |
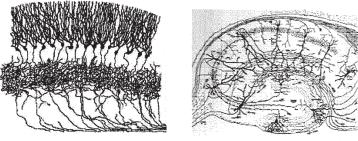
Ðèñ. 7.1. Окрашенные по Гольджи ткани мозжечка (A) и гиппокампа (Б) (Golgi C., 1885. A monograph on the fine anatomy of the central nervous organs).
Важное преимущество импрегнации, по Гольджи, заключается в возможности индивидуального окрашивания клеток нервной ткани. Достижения Гольджи не ограничились изобретением метода. Камилло Гольджи описал морфологию глиальных клеток и связь между отростками глии и сосудами. Термин «нейрон» (от греч, neuron — нерв) стал использоваться после описания Гольджи двух типов нервных клеток, известных сегодня как нейроны Гольджи типа I и типа II. По современной номенклатуре эти клетки чаще называют «проекционными нейронами» и «нейронами локальных цепей», или «интернейронами» (рис. 7.2).
Таким образом, в конце XIX века все предвещало торжество клеточ- ной теории над ретикулярной и в отношении нервной системы. Но даже Камилло Гольджи не признавал правильность клеточного подхода для нервных тканей, что и было им продемонстрировано во время чтения Нобелевской лекции в 1906 году в Страсбурге. Вторым лауреатом Нобелевской премии 1906 года в области физиологии и медицины стал испанский нейрогистолог Сантьяго Рамон-и-Кахаль. В отличие от Гольджи, Кахаль был сторонником клеточной теории и считается создателем «нейронной доктрины». Метод Гольджи был по достоинству оценен и взят на вооружение Рамон-и-Кахалем, и им были получены неоспоримые, как он считал, экспериментальные данные (1988), подтверждающие клеточную теорию строения мозга (рис. 7.3).
198
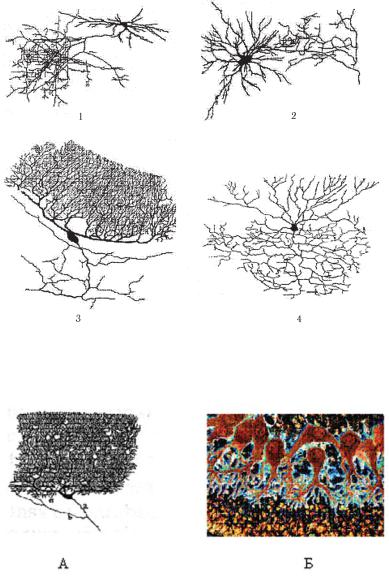
Ðèñ. 7.2. Камилло Гольджи (1885. A monograph on the fine anatomy of the central nervous organs). Два основных типа нервных клеток: нейроны Гольджи типа I (1, 2) и типа II (3, 4). По современной номенклатуре эти нейроны известны как проекционные нейроны и нейроны локальных сетей, или интернейроны.
Ðèñ. 7.3. (А) Изображенная Кахалем окрашенная методом Гольджи клетка Пуркинье (Кахаль, 1985) и (Б) фотография клеткок Пуркинье мозжечка мыши, окрашенных иммуно-гистохимическими методами (2003).
199
