
Александров Ю.И., Анохин К.В. - Нейрон. Обработка сигналов. Пластичность. Моделирование_ Фундаментальное руководство (2008)
.pdfВ действительности в реальных нейронах потенциалы имеют зна- чительно более сложную конфигурацию. В реальных нейронах проведение потенциалов определяется большим числом дополнительных параметров: неоднородность внеклеточной среды, сложная конфигурация дендритов, вариации их размера, наличие разных синапсов, активирующих лиганд-зависимые каналы и метаботропные рецепторы, наличие разных потенциал-зависимых проводимостей и проч.
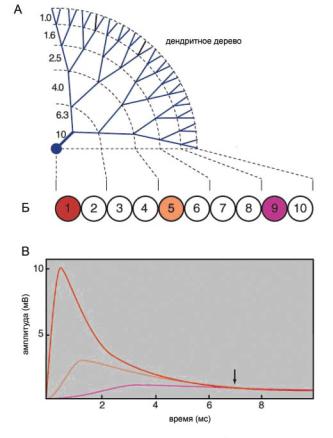
Такое число факторов затрудняет (или делает невозможным) анализ проведения возбуждения по таким сложным нервным волокнам. Особенности проводимости потенциалов обычно исследуют с использованием упрощенных моделей. Одной из таких моделей является модель Ролла с дихотомическим ветвлением дендритов, которая учитывает относительно сложную конфигурацию нейронных волокон (рис. 6.19). Слои дихотомического дендритного дерева формируют последовательно соединенные ячейки с условием, что диаметры дендритов в каждой ячейке удовлетворяют уравнению Σdi3/2=const. Каждая ячейка представляет собой электрический модуль, включающий мембранную емкость, источники возбудительных и тормозных синаптических влияний, а также потенциал покоя. По модели рассчитывали ВПСП сомы нейрона при разном удалении места стимуляции. Оказалось, что чем дальше удалены активируемые синапсы от сомы нейрона, тем медленнее развивались потенциалы, а их амплитуда существенно падала.
Такие модельные представления нашли свое подтверждение в исследованиях ВПСП, регистрируемых в мотонейронах спинного мозга кошки (рис. 6.20). Амплитуда ВПСП, вызванных стимуляцией ближних дендритов, нарастала быстрее и была больше, чем амплитуда ВПСП при стимуляции дистальных дендритов.
6.8.Механизм генерации потенциала действия
6.8.1.Натриевая гипотеза генерации потенциала действия
Согласно теории Ю. Бернштейна, при возбуждении клетки ее мембрана повреждается, и ионы К+ вытекают из клетки по концентрационному градиенту до тех пор, пока потенциал мембраны не становится равным нулю. Затем мембрана восстанавливает свою целостность, и потенциал возвращается к уровню ПП.
Частичное подтверждение теория Ю. Бернштейна получила в результате исследований возбудимости клеточных мембран, выполненных в 1930-х г.г. К. Коулом и Х. Куртисом. Авторы сделали фундамен-
160
тальное открытие, заключающееся в том, что во время развития ПД в мембране аксона кальмара существенно падает сопротивление мембраны (от 1000 до 25 ом см2), и, соответственно, возрастает проводимость. Такое большое возрастание проводимости указывало на то, что при возбуждении через мембрану текут токи, переносимые ионами.
Ðèñ. 6.19. (А) Модель нейрона с дендритами (модель Ролла), числа слева — диаметры дендритов в условных единицах модели. (Б) На схеме показано формальное преобразование слоев дендритов в эквивалентную цепь одинаковых «ячеек». В модели ВПСП «регистрировали» в соме (отсек 1).
(В) Графики отражают расчетные ВПСП сомы нейрона при «синаптической стимуляции» 1, 5 и 9 отсеков. Несмотря на различия в начальной фазе, все ВПСП сливаются на нисходящей фазе (отмечено стрелкой).
161
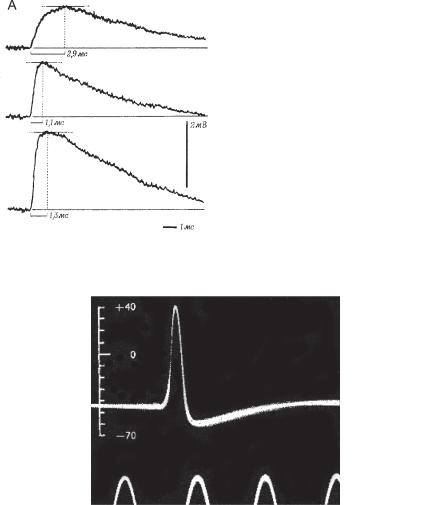
Ðèñ. 6.20. (А) Примеры ВПСП мотонейрона спинного мозга кошки в ответ на стимуляции разных дендритов ВПСП. Числа указывают время нарастания ВПСП. (Б) ВПСП на стимуляцию ближних и (В) дальних дендритов.
Ðèñ. 6.21. Первая иллюстрация потенциала действия из оригинальной работы А. Ходжкина и А. Хаксли.
Дальнейшие исследования возбудимости мембраны аксонов кальмара, выполненные А. Ходжкиным и А. Хаксли, показали, что на максимуме ПД действия мембрана не разряжается до нуля, а заряжается положительно относительно окружающей среды (рис. 6.21). Оказалось, что амплитуда ПД зависела от концентрации ионов Na+ во внеклеточ-
162
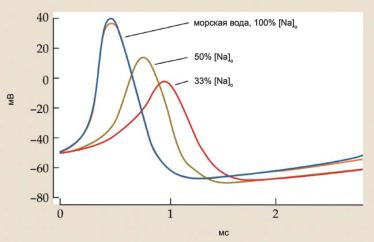
ном растворе, в который помещали аксон во время записи биоэлектри- ческой активности (рис. 6.22). На основании своих результатов авторы высказали предположение, что ПД является результатом кратковременного, но значительного увеличения проводимости мембраны для Na+. Концентрация ионов Na+ во внеклеточной среде примерно в 10 раз выше, чем внутри клетки (табл. 6.1), поэтому ENa+ составляет 50-60 мВ. Абсолютное значение потенциала на вершине ПД в экспериментах А. Ходжкина и А. Хаксли находилось в этих пределах. Это означает, что амплитуда ПД определяется равновесным потенциалом для Na+ и описывается уравнением Нернста для Na+-электрода:
|
RT |
[Na+]out |
||
ENa+ = |
|
ln |
|
, |
|
|
|||
|
nF |
[Na+]in |
||
ãäå [Na+]in è [Na+]out — концентрации Na+, соответственно, внутри клетки и в окружающей среде.
Ðèñ. 6.22. Зависимость амплитуды ПД от концентрации Na+ [Na+]o во внеклеточном растворе. Числами указано разведение исходного (100%) раствора.
Реполяризация мембраны происходит за счет кратковременного увеличения К+-проводимости из аксона в раствор по концентрационному градиенту. Чтобы доказать, что в основе ПД лежат изменения проводимостей для Na+ è Ê+, необходимо напрямую измерить эти показатели. Однако, чтобы решить эту задачу, необходимо преодолеть две проблемы. Во-пер-
163
вых, токи, протекающие через мембрану, приводят к изменению мембранного потенциала, что в свою очередь вызывает изменения проводимостей. Эта проблема была решена при использовании методики фиксации потенциала, разработанной К. Коулом. При неизменном уровне потенциала токи будут отражать изменения проводимости мембраны. Во-вторых, чтобы исследовать токи Na+ è Ê+ в отдельности, их надо разделить. В ранних исследованиях Na+ во внешнем растворе заменяли на катион большого размера (холин), не проникающий через мембрану. Затем стали использовать селективные блокаторы для каждого канала.
6.8.2. Методика фиксации потенциала
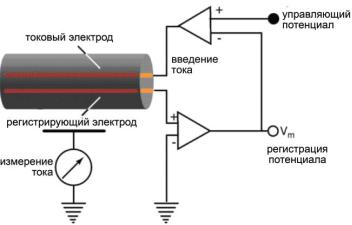
Принцип работы электрической схемы для фиксации потенциала заключается в следующем. Разность потенциалов по разные стороны мембраны мгновенно фиксируется с помощью электронной системы с обратной связью (рис. 6.23). При этом потенциал можно ступенчато изменять на любую величину. Метод позволяет измерять ионные токи, протекающие через мембрану через каналы, которые активируются при изменении потенциала. В соответствии с законом Ома, при постоянном напряжении на мембране изменения тока однозначно связаны с изменениями проводимости, которые в свою очередь связаны с процессами открытия и закрытия ионных каналов.
Ðèñ. 6.23. Электрическая схема для фиксации потенциала в мембране гигантского аксона кальмара. Объяснения в тексте.
При помощи усилителя-регулятора внутриклеточный потенциал сравнивают с управляющим потенциалом. Отклонение мембранного
164
потенциала от управляющего усиливается, и на выходе усилителя возникает управляющий ток. Этот ток течет через электроды, расположенные по разные стороны мембраны, в том направлении, при котором мембранный потенциал вновь становится равным управляющему.
В ответ на ступенчатую деполяризацию открываются натриевые (или какие-либо другие) каналы, соответствующие ионы входят в аксон по электрохимическому градиенту и переносят с собой электри- ческие заряды. Эти заряды сдвигают мембранный потенциал в сторону деполяризации, однако это отклонение компенсируется в результате удаления из клетки избыточных зарядов с помощью усилителя-регуля- тора. При этом регистрируется ток, который подается усилителем для поддержания мембранного потенциала на необходимом уровне. Этот противоположный по знаку ток равен по абсолютной величине ионному току, протекающему через мембрану.
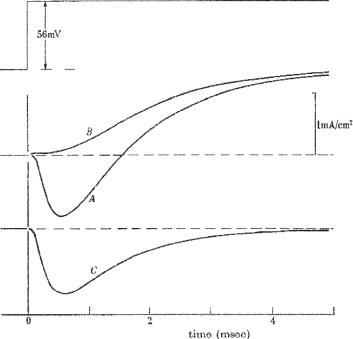
Ðèñ. 6.24. Ионные токи, протекающие через мембрану при генерации ПД (оригинальные иллюстрации из работы А. Ходжкина и А. Хаксли). А — общий ток, B — выходящий ток, C — входящий ток (получен путем вычитания выходящего тока из общего).
165
6.8.3. Ионные токи во время генерации ПД в аксоне кальмара
Методом фиксации потенциала в 1952 г. А. Ходжкин, А. Хаксли и Б. Катц впервые измерили ионные токи, проходящие через мембрану во время возбуждения (рис. 6.24). В нормальных условиях, когда аксон погружен в морскую воду, при деполяризации мембраны регистрируется ток, состоящий из раннего входящего и позднего выходящего компонентов (рис. 6.24, А). При замене Na+ во внешнем растворе на ионы холина входящий компонент тока исчезает, и регистрируется только выходящий ток (рис. 6.24, В). Входящий ток получен путем вычитания выходящего тока из общего (рис. 6.24, С). На основании таких результатов авторы сделали вывод о натриевой природе входящего тока.
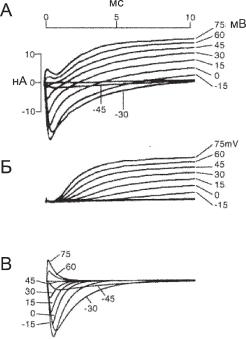
Ðèñ. 6.25. Фармакологическое разделение входящих и выходящих токов при генерации ПД. (А) В контроле конфигурация суммарных токов зависит от уровня фиксированного потенциала (отмечено числами справа, мВ), по мере деполяризации мембраны уменьшается входящий и увеличивается выходящий компоненты тока. (Б) Применение ТТХ (блокатора Na+-проводимости) устраняет входящий компонент. (В) Применение ТЕА (блокатора К+-проводимости) устраняет выходящий компонент.
166
Позже эксперименты с использованием специфических блокаторов ионных каналов подтвердили такие результаты (рис. 6.25). Так, при использовании тетродотоксина (TTX, блокатора Na+-проводимости) во внешнем растворе входящий компонент исчезал, в то время как выходящий регистрировался (рис. 6.25, Б). Напротив, при использовании тетраэтиламмония (TEA, блокатора К+-проводимости), перфузированного внутрь аксона, исчезал выходящий компонент (рис. 6.25, В). На основании таких результатов был сделан вывод о калиевой природе выходящего тока.
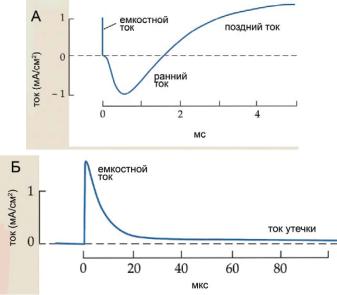
Ðèñ. 6.26. (А) Емкостной ток и ток утечки на фоне высокоамплитудных потен- циал-зависимых токов и (Б) в отдельности (в другом масштабе по оси времени).
Необходимо отметить, что первоначальный кратковременный ток выходящего направления представляет собой емкостной ток, обусловленный изменением заряда мембранной емкости (рис. 6.26). Продолжительность этого тока составляет около 20 мкс. Этот ток сменяется небольшим по амплитуде, но устойчивым током выходящего направления. Этот ток связывают с проводимостью через каналы утечки (главным образом К+-каналы), имеющей место при ПП. Ток утечки в аксоне кальмара имеет малую амплитуду и при возбуждения аксона маскируется высокоамплитудными потенциал-зависимыми токами. На других исследованных объектах (в мембране перехвата Ранвье миелини-
167
зированных аксонов позвоночных) величина тока утечки сопоставима с величиной потенциал-активируемого выходящего К+-òîêà.
6.8.4. Инактивация натриевой проводимости
Как показали исследования токов при деполяризации мембраны аксона, входящий Na+ достигает своего максимума через 0,5 мс и в последующие 3 мс спадает до нуля, несмотря на то, что мембрана еще деполяризована. Быстрый спад Na+-тока называют инактивацией Na+-проводимости.
Используя методику фиксации потенциала, А. Ходжкин и А. Хаксли количественно исследовали процесс инактивации Na+-проводимости. Они исследовали влияние де- и гиперполяризации мембраны на амплитуду Na+–токов (рис. 6.27). Относительно продолжительная (около 30 мс) гиперполяризация (кондиционирующий стимул) перед деполяризующим тестовым толчком вызывают увеличение амплитуды Na+-тока (рис. 6.27, А, б) по сравнению с деполяризацией, применяемой при ПП (рис. 6.27, А, а). Деполяризующие кондиционирующие стимулы снижают амплитуду Na+-тока (рис. 6.27, А, в, г). Количественная выраженность инактивации натриевой проводимости представлена на рисунке 6.27 (Б). При кондиционирующей деполяризации около -30 мВ Na+-ток почти равен нулю (полная инактивация). Кондиционирующая гиперполяризация до -95 мВ и ниже вызывает существенное (на 70%) увеличение Na+-тока. В мембране аксона кальмара инактивация при ПП составляла почти 40% от максимального значения. Инактивация Na+-каналов при ПП и деполяризации мембран характерна для всех нейронов.
6.8.5. Воротные механизмы потенциал-зависимых Na+-каналов
А. Ходжкин и А. Хаксли предположили, что активация Na+-каналов связана с открыванием специальных «ворот», представляющих собой заряженные частицы (диполи). Они исследовали амплитуду емкостного тока (рис. 6.28, А) при деполяризации и гиперполяризации. Токи, обусловленные процессами зарядки и разрядки емкости мембраны, должны быть симметричными, т.е. разными по знаку и равными по абсолютной величине. Токи, связанные с активацией Na+-ворот, должны генерироваться только при включении и выключении деполяризующего, но не гиперполяризующего скачка потенциала. Токи в ответ на деполяризацию (рис. 6.28, А, а) по абсолютной амплитуде оказались больше токов в ответ на гиперполяризацию (рис. 6.28, А, б). При сложении этих токов был получен воротный ток (рис. 6.28, А, в), который отражает поворот воротной частицы (диполя). Чтобы исключить воротный ток, связанный с выходящим К+-током, К+-каналы заблокировали ТЕА.
168
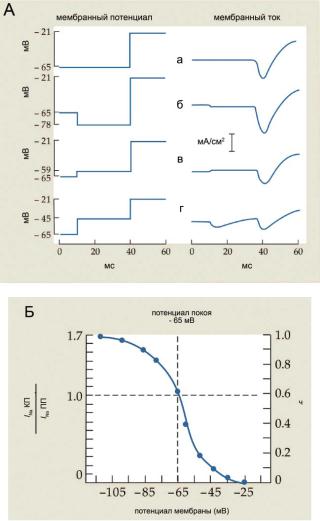
Ðèñ. 6.27. (А) Влияние мембранного потенциала на амплитуду Na+-òîêà.
(а) Ток при ПП. (б) Увеличение тока после кондиционирующей гиперполяризации. (в, г) Уменьшение тока после кондиционирующей деполяризации. (Б) Зависи-
мость пронормированного Na+-òîêà (INa,ÊÏ/INa,ÏÏ), КП — кондиционирующая поляризация, ПП — потенциал покоя) от уровня кондиционирующей поляризации.
Шкала справа отражает степень инактивации Na+-тока (h, доля неинактивированных Na+-каналов), «0» — полная инактивация, «1» — отсутствие инактивации.
169
