
Александров Ю.И., Анохин К.В. - Нейрон. Обработка сигналов. Пластичность. Моделирование_ Фундаментальное руководство (2008)
.pdfнивалась с экспрессией клеток СХЯ, находящихся в культуре ткани. Исследования показали, что часы по-разному включаются в генерацию молекулярных и метаболической ритмичности и в регуляцию специфических пространственных выходов, которые контролируют ритми- ческие процессы в NIH/3T3 клеток (Allen et al., 2004). Активность отдельных нейронов и утилизация глюкозы исследовалась на СХЯ срезах золотистых хомячков (Shibata, Moore, 1988). Наблюдались четкие циркадные ритмы и в активности нейронов, и в утилизации глюкозы. Эти наблюдения показывают, что срезы мозга могут оказаться полез-
ными для анализа пейсмекерной функции нейронов СХЯ.
Чувствительность к нейромедиаторам. СХЯ — это основной центр генерации ритмов в ЦНС. На срезах мозга регистрировали активность отдельных нейронов. Тестировались ответы нейронов на различные гормоны и нейромедиаторы (дофамин, серотонин, карбахол (антагонист АХ). Серотонин действовал на более чем 40% нейронов, примерно в равном количестве активировал и тормозил. Карбахол вызывал торможение примерно половины зарегистрированных нейронов (49,5%), а возбуждал только 10,3% из общего числа 137 зарегистрированных нейронов. Дофамин возбуждал почти 50% нейронов в присутствии некоторых гормонов (Hsieh, Pan,1990). Для пейсмекерной активности СХЯ необходим экстраклеточный Са++ и синаптический вход. Опыты Mirmiran et al. (1995) показали, что биологические часы млекопитающих представляют из себя гетерогенную нейронную систему, в которой циркадианный пейсмекерный ритм генерируется и модулируется через сложное взаимодействие между клетками СХЯ.
Âэкспериментах Honma et al. (2000) при помощи мультиэлектродного устройства одновременно регистрировалась активность от 4–8 нейронов, а межнейронные взаимодействия исследовались при помощи кросс-корреляционного анализа спонтанных потенциалов действия. У пар нейронов, проявляющих синхронизированные циркадианные ритмы, были определены функциональные связи. Когда связи разрывалсь, ритм разрядов десинхронизировался. После длительных воздействий тетродотоксином кросс-корреляции и синхронизация циркадианного ритма уничтожалась у большего числа нейронных пар. Результаты показывают, что за синхронизацию циркадианных ритмов отдельных нейронов СХЯ ответственны механизмы, включающие зависимость коммуникации от Na+-каналов,
Âопытах, проведенных Zhi-Gen Jiang с соавторами (1997) на срезах мозга крысы, регистрация электрической активности нейронов про-
380
водилась в разное время суток. Результаты опытов показали следующее: в среднем входная емкость нейронов, зарегистрированных вблизи субъективного «рассвета», была на 42% выше, чем у нейронов, зарегистрированных вблизи субъективных сумерек. Ток, необходимый для поддержания поляризации нейронов на -60 мВ, имел пик в середине субъективного дня и минимум в середине субъективной ночи. Эти результаты показывали, что по крайней мере два вида ионной проводимости участвуют в генерации циркадианного ритма. Фиксация напряжения на мембране нейрона показала, что имеются входящие и выходящие постсинаптические токи. Выходящий ток блокировался бикукуллином и не блокировался стрихнином. Он был определен как ТПСП, опосредованный GABAа рецепторами. Входящий токблокировался 6-cyano-7-nitroquinoxaline-2,3-dione (CNQX) и был идентифицирован как ВПСП, опосредованный глутаматом. Стимуляция оптического нерва или хиазмы вызывала моносинаптический ВПСП, который опосредован и NMDA, и nonNMDA рецепторами. У 13% клеток стимуляция оптического нерва вызывала выходной ток или входной ток, сопровождавшийся выходящим током. Все вызванные токи блокировались бикукуллином, что предполагает наличие участия тормозного ин-
тернейрона.
Распределение нейронов в СХЯ. Для выяснения структуры мультиосцилляторной циркадианной организации СХЯ исследовалась региональная специфичность дорзальной и вентральной областей СХЯ. Циркадианные ритмы реализации аргинин вазопрессина (AVP) и вазоактивного интестинального полипептида и электрическая активность нейронов измерялась у органотипической статической культуры срезов СХЯ, полученных от новорожденных крыс. Через 5 дней от начала культивирования четкие циркадианные ритмы были определены по реализации AVP c пиком, локализованным постоянно на середине исходной световой фазы, хотя 24 - профили реализации VIP были или аритмичными, или ритмичными. В последнем случае фаза, отсроченная на 5–7 часов, наблюдалась в циркадианном пике ритма AVP. Мультиканальная экстраклеточная регистрация 51 из 67 нейронов, исследованных в СХЯ, продемонстрировала циркадианные ритмы в скорости разрядов. Процент ритмических нейронов был значительно выше в дорзальном (86,8%), чем в вентральном (62,1%) районе СХЯ, где доминировали нейроны, содержащие AVP и VIP. 27% ритмичных нейронов были почти в антифазных отношениях большинства ритмов. Не обнаружено региональной специфичности в распределении антифазных
381
ритмов. Эти данные показали, что дорзальные и вентральные области СХЯ содержат циркадианные пейсмекеры с разными свойствами, которые регулируют высвобождение VIP и AVP раздельно, что, вероятно, связано с различием в числе, а отсюда и в совокупной силе осциллирующих нейронов (Nakamura et al., 2001).
Возраст и часы. Влияние возраста на нейронную активность СХЯ исследовалось на хомячках, которых содержали или в условиях смены света и темноты, или же в условиях постоянного освещения. Периоды свободного передвижения в круговороте ритмов 24-месячных хомяч- ков были короче, чем у 2-месячных. Была и значительная разница в средней частоте разрядов нейронов СХЯ у старых и молодых хомячков в течение субъективного дня (6,58 +/-0,36 спайк/сек. у молодых и 5,63+/-0,27 у старых), но не в течение ночи. Сходным образом в условиях постоянного освещения скорость разрядов у старых хомячков поддерживалась на уровне условий свет-темнота и была значительно ниже, чем у юных животных. Эти результаты показывают, что ухудшение активности нейронов СХЯ у старых животных является проявлением снижения активности в дневное время. Это может отражать изменения во взаимодействии между СХЯ часами и очевидными изменениями поведенческих и пейсмекерных свойств пейсмекерных нейронов СХЯ (Watanabe et al., 1995).
Супрахиазменное ядро гипоталамуса — главный циркадианный пейсмекер, или часы мозга млекопитающих. Каноническая теория придерживается взгляда, что выход от этих единственных доминирующих часов ответственен за управление большинством суточных ритмов в физиологии и поведении. Но последние данные подвергают сомнению единственность этой модели и демонстрируют присутствие часовоподобной активности во многих нейронных и ненейронных тканях. Так, в дополнение к СХЯ ряд областей мозга млекопитающих, включая обонятельные луковицы, миндалину, латеральную уздечку и множество ядер гипоталамуса, экспрессируют часовой ген, выход гормонов и электрическую активность. В работе Guilding and Piggins (2007) представлены данные об экстра-СХЯ-осцилляторах в мозге млекопитающих и приводятся сведения об основных свойствах и различиях между осцилляторами разных областей мозга. Демонстрация нейронных пейсмекеров, находящихся вне СХЯ, имеет далеко идущее значение для модели циркадианной системы общеорганизменного уровня.
Пейсмекеры — эндогенная активность, роль которой в жизни живого организма чрезвычайно разнообразна. Одна из функций пейсме-
382
керов — формирование ритмики мозга. Ритмичность разрядов нейронов некоторых структур мозга (таламуса, гипоталамуса и т. д.) многие исследователи связывают с поступлением к клеткам ритмических синаптических влияний — в этом заключается идея о сетевой основе ритмичности. Однако такие подкорковые структуры, как ретикулярная формация, мозжечек, гиппокамп, супрахиазменное ядро, оливы, содержат нервные клетки, ритмические разряды которых задаются специальным внутриклеточным механизмом (эндогенная основа ритмичности). Новые исследования, выполненные при помощи регистрации ЭЭГ, позитронно-эмиссионной томографии, магниторезонансной томографии, позволяют выдвинуть гипотезу о роли нейронов — генераторов в генезе основных ритмов мозга. В качестве одного из возможных источников возникновения суммарных ритмов мозга рассматривается пейсмекерная активность нейронов (Geisler, 2005, Johnson, 2005, Maccaferri and McBain, 1996). Именно эта категория эндогенных процессов, опосредуемых активным транспортом ионов, образует механизм внутреннего генератора нейрона, обеспечивая периодическое достижение порога генерации потенциалов действия (ПД) в отсутствие внешнего источника возбуждения.
13.6. Пейсмекеры гиппокампа
Природа тета-ритма. Большой интерес вызывают экспериментальные данные по исследованию тета-ритма — низкочастотной ритмической активности (4–10 герц) в септо-гиппокампальной области. Одна из обсуждающихся гипотез состоит в том, что тета-ритм участвует в процессах обучения и памяти.
Медиальный септум является необходимым компонентом субкортикальной сети, которая синхронизирует активность клеток гиппокампа на тета-частотах во время специфических стадий информационного процесса. Предполагается, что ГАБАергические нейроны, проявляющие высоко регулярную спайковую активность, связанную с гиппокампальным тета-ритмом, создают основу для медио-септальной системы, генерирующей ритм. В последних исследованиях показано, что гиперполяризационно-активируемый, управляемый циклическим нуклеотидом неизбирательный к катионам канал участвует в тета-синхро- низации медиального септума. В работе Varga et al. (2008) проверялась гипотеза, согласно которой экспрессия этого канала коррелирует с тета-модулируемыми разрядами медио-септальных нейронов при помощи соединения анатомических и нейрофизиологических подхо-
383
дов. Нейроны, имеющие такие каналы, составляют особую популяцию ГАБАергических клеток. Ритмические разряды в диапазоне тета-час- тот является характеристикой этих клеток. Наоборот, только малая часть клеток, не имеющих такого канала, проявляет связь с тета-ритмом. Все клетки с позитивным каналом имеют четкую привязку к определенной фазе тета-активности. Микроионофоретическая блокада канала приводит к снижению частоты разрядов, но нарушения тета-ритма зафиксированы только в нескольких случаях. Эти данные показывают, что экспрессия канала у ГАБАергических нейронов обеспечивает управление на всех фазах гиппокампального тета-ритма. У большинства септо-медиальных клеток генез тета-активности, по-видимому, определяется посредством взаимодействия на уровне сети и не зависит толь-
ко от пейсмекерных свойств этих особых каналов (Varga et al., 2008). Пейсмекеры СА1. Механизмы, опосредующие прямые и навязан-
ные ритмические осцилляции мембранного потенциала пирамидальных нейронов поля СА1 гиппокампа, исследовались на срезах мозга крысы. Собственные осцилляции (6–14 Гц, менее 10 мВ) вызывались импульсами деполяризационного тока длительностью 2 с у 42% зарегистрированных клеток. Осцилляции также запускались синусоидальными трансмембранными токами частотой 2,7 и 14 Гц, что имитировало синапти- чески опосредованные in vivo «внутриклеточные тета-ритмы». Медленные, по типу «все-или-ничего» события (40 мВ, 55мс), напоминующие ритми- ческие высокопороговые медленные спайки, наблюдаемые in vivo, вызывались и навязывались синусоидальным током с большой выраженной деполяризацией у 35% клеток. Собственные осцилляции были нечувствительны к свободному Са++, Со2+(2мМ) и Mn2+(2mM) растворам, но блокировались тетродотоксином (ТТХ), показывая, что они опосредованы натрием. Также найдено сосуществование высокого порога для Са2+ и устойчивой натриевой проводимости у пирамидных клеток поля СА1. Устойчивая натриевая проводимость опосредовала собственные осцилляции и флуктуировала вместе с используемыми синусоидальными токами. Более медленная высокопороговая Са2+ проводимость осциллировала исключительно на частоте менее 7 Гц и не поддерживала собствен-
ные колебания (Garcнa-Muсoz et al., 1993).
Пейсмекеры СА3. Синхронная активность нейронных популяций часто инициируется пейсмекерной областью и распространяется, чтобы привлечь и другие области. В работе Wittner L, Miles R (2007) исследуются факторы, которые определяют область локализации пейсмекера. Район СА3 гиппокампа действует как пейсмекер, который
384
растормаживает синхронность в гиппокампальных срезах морской свинки. Пирамидные клетки СА3 более возбудимы и разряжаются берстами (залпами) чаще, чем клетки СА3b. Клетки СА3а имеют более сложный дендритный рисунок, чем клетки СА3 b, в особенности в зоне рекуррентных синапсов. Обнаружено, что многие клетки СА3а и немногие СА3b ведут себя как пейсмекерные, разряжаясь до явлений, которые происходят в популяции, и побуждают другие клетки к разрядам. При увеличении возбудимости и усилении синаптических связей нейроны СА3а могут также активироваться, инициируя гиппокампальную ансамблевую активность.
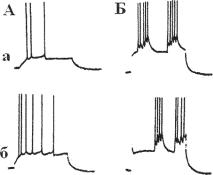
Ðèñ. 13.24. Вызванные повторные и залповые разряды сомы пирамидного нейрона СА1 гиппокампа. А — ответ сомы на инъекции деполяризационного тока двух интенсивностей (а и б). Стимул более высокой интенсивности вызывает повторяющиеся, но не залповые разряды. Б — залповые разряды, вызванные в соме той же клетки при помощи экстраклеточной стимуляции апикальных дендритов. Сравните двойной залповый ответ на длительную стимуляцию дендритов (Ба) с повторными разрядами, вызванными соматической стимуляцией (Аб). Одновременная гиперполяризация сомы (Бб) увеличивает латентный период развития залпов и предотвращает развитие соматического ПД (по R. K. S. WONG AND M. STEWART Different firing patterns generated in dendrites and somata of ca1 pyramidal neurones in guinea-pig hippocampus. Journal of Physiology (1992), 457, pp. 675-687 675).
Зависимость типа ответа от места его возникновения.
Результаты опытов на центральных нейронах заставляют предполагать, что различия в паттернах разрядов могут быть свойством количе- ственного различия ионных проводимостей. Выходной паттерн нейрона обычно определяется посредством последовательности активации ионных проводимостей. Ионные проводимости, определяющие особен-
385
ности паттерна разрядов, могут быть модифицированы рядом факторов. Мембранная поляризация или аппликация нейротрансмиттера могут быть необходимы, чтобы активировать или не активировать специфи- ческие проводимости, которые могут переводить разряды клетки из повторных в берстовые.
Прямые регистрации от дендритов также вскрывают механизм берстовой активности на апикальных дендритах пирамидных клеток CAl
èCA3 гиппокампа. В опытах Wong et al. (1979) было показано, что берстовый ответ, полученный при одной локализации, может вызвать берстовую реакцию при другом положении возбудительного входа. Так, дендритный залп может усиливать синаптические события, гарантируя
èсоматический разряд.
Для изучения происхождения повторных и залповых разрядов этих клеток использовалась внутриклеточная регистрация от пирамидных клеток СА1 срезов гиппокампа морской свинки (Wong RK, Stewart M, 1992). Одиночные ПД развивались при действии деполяризационного тока при регистрации от сомы. Наоборот, ток инъецируемый во время интродендритной регистрации, инициировал берсты в дендритах (рис. 13.24). Берстовые разряды можно было вызвать в соме при прямой деполяризации дистальных апикальных дендритов (примерно 150 микрон от слоя клеточных тел). Внутриклеточная регистрация велась одновременно от апиккальных дендритов и сомы пирамидных клеток. Парная дендро-соматическая регистрация подтвердила, что ритмические одиночные ПД генерируются сомой нейрона, а берсты генерируются в дистальных апикальных дендритах. Быстрые спайки в дендритах часто запускают быстрые спайки в соме, но не все быстрые спайки в дендритных берстах были запускающими для сомы. В парной регистрации, когда дендритные ПД не могут вызвать полного соматического спайка, дендритный спайк обычно регистрировался в соме. Соматический д-спайк был одинаковым (uniform) ответом по типу «все-или-ниче- го». В некоторых случаях он может запускать генерацию полного соматического спайка. Затухающие спайки можно зарегистрировать в дендритах, и они запускаются соматическими ПД. Дендритные ответы на соматическую стимуляцию иногда изменяются по амплитуде, но всегда имеется прямое соответствие между дендритным и соматическим ПД. Дендритная регистрация, проведенная близко к телу клетки (менее 150 мк), показала, что есть переходная область, в которой можно чаще вызвать одиночный ПД, а не залповую активность. Последействие от такого одиночного ПД отличается от такового после сомати-
386
ческого спайка. Обнаружен сдвиг от следовой гиперполяризации к деполяризационному последействию. Результаты показывают, что активность пирамидных клеток СА1 гиппокампа, вероятно, отражение ее выхода и может быть или берстовой, или в виде одиночных ПД. Соматические берсты не похожи на разряды, которые наблюдаются на апикальных дендритах, или на берстовые разряды клеток области СА3, они не инициируются локально. Скорее, они являются быстрым ответом сомы по типу спайк на спайк на берсты с апикальных дендритов. Таким образом, берстовые ответы могут генерироваться при обеих локализациях источника возбуждения, но соматические берстовые ответы развиваются только в том случае, когда причиной залпа являются апикальные дендриты. Берстовый паттерн соматических потенциалов действия является результатом запуска быстрых дендритных спайков к соме. Прямая соматическая стимуляция не продуцирует берстовых ответов. Был сделан вывод о том, что разные паттерны выходящей активности нейронов СА1 пирамидных клеток могут зависеть исклю-
чительно от локуса возбуждения.
Электрофизиологические свойства 4 классов нейронов. Медиальный септально-диагональный пучок (MSDB) содержит холинергические и нехолинергические нейроны. Известно, что эти нейроны играют важную роль в процессах обучения и памяти и в генерации гиппокампального тета-ритма. Электрофизиологически некоторые классы нейронов описаны для MSDB, но их химическая идентификация остается полностью не определенной. In vitro соединение методов электрофизиологии с RT-PCR позволило идентифицировать четыре класса нейронов. Первый класс нейронов демонстрирует медленные разряды нейронов и малые токи Ih или их полное осутствие и экспрессирует холинтрансферазную mRNA (ChAT). Второй класс — это быстро разряжающиеся нейроны. Они имели постоянный Ih и экспрессировали glutamic acid decarboxylase 67 mRNA (GAD67). Третий класс нейронов характеризуется быстрыми разрядами и берстовыми разрядами, экспрессируя glutamic acid decarboxylase 67 mRNA (GAD67). Ионные механизмы, лежащие в основе генерации берстов, вовлекали низкопороговые спайки и четко выраженный ток, проводимости которого часто ассоциируются с пейсмекерной активностью. Четвертый класс — нейроны, которые экспрессировали транскрипты только для одного или двух везикулярных глутаматных транспортеров (VGLUT1 и VGLUT2), но не для ChAT or GAD. Некоторые, предположительно глутаматерги- ческие, нейроны проявляли электрофизиологические свойства, сход-
387
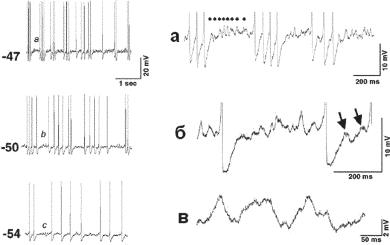
ные с ChAT-позитивными, медленно разряжающимися нейронами, но примерно половина глутаматергических нейронов проявляла кластровые разряды, прямо управляемые потенциал-зависимым подпороговым мембранным осциллятором (рис. 13.25 и 13.26). Нейроны, относящиеся к одному из четырех классов, были найдены среди септо-гиппокам- пальных нейронов при помощи ретроградной метки. Предполагается, что холинергические медленно разряжающиеся нейроны, быстро разряжающиеся и берстовые ГАБАергические нейроны, кластерно разряжающиеся глутаматергические нейроны могут вносить вклад в гиппокампальную ритмичность in vivo (Sotty et al., 2003).
Ðèñ. 13.25. Внутрикластерные, межкластерные и подпороговые осцилляции нейронов гиппокампа. А — нейрон, зарегистрированный в условиях фиксации напряжения на мембране, демонстрирует разряды в кластере других нейронов при предъявлении импульса деполяризационного тока увеличивающейся амплитуды. Увеличение подпороговых осцилляций показано справа (а-в) для каждого процесса, показанного слева. Частота мембранных осцилляций увеличи- вается при деполяризации мембраны — от -54 до -47 мВ). У этого разряжающегося в кластере нейрона частота осцилляций около 25 Гц при -47 мВ (осцилляции, обозначенные точками, демонстрируют увеличение амплитуды на рисунках справа) и около 10 Гц при -54 мВ. При МП около -50 мВ межкластерная, внутрикластерная и подпороговая частота осцилляций ниже, чем при -47 мВ. (по F. Sotty, M. Danik, F. Manseau, F. Laplante, R. Quirion and S. Williams. Distinct electrophysiological properties of glutamatergic, cholinergic and GABAergic rat septohippocampal neurons: novel implications for hippocampal rhythmicity J Physiol (2003), 551.3, pp. 927–943).
388
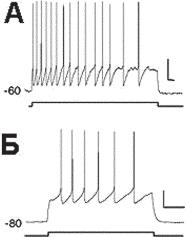
Ðèñ. 13.26. Ответы нейронов гиппокампа на прямое электрическое раздражение. А и Б — ответы нейрона, зарегистрированные в условиях фиксации напряжения на мембране на -60 мВ и -80 мВ при действии импульса деполяризационного тока. Этот нейрон демонстрирует медленные регулярные разряды. Калибровка: 20 мВ, 200 мс. (по F. Sotty, M. Danik, F. Manseau, F. Laplante, R. Quirion and S. Williams Distinct electrophysiological properties of glutamatergic, cholinergic and GABAergic rat septohippocampal neurons: novel implications for hippocampal rhythmicity J Physiol (2003), 551.3, pp. 927–943).
В опытах Brazhnik and Fox (1995) изучали свойства медиальносептальных нейронов и нейронов диагонального пучка Брока. На основе формы и длительности ПД, следовой гиперполяризации, мембранных характеристик, скорости разрядов и чувствительности к действию антагониста мускариновых рецепторов были выделены три типа ритмических берстовых нейронов. 1. Клетки с потенциалами действия короткой длительности без следовой гиперполяризации имели высокую скорость разрядов и чрезвычайно устойчивые берсты, насчитывающие от 2 до 34 спайков на тета-цикл. Они были чрезвычайно устойчивы к действию скополамина. 2. Клетки с потенциалами действия короткой длительности, с небольшой следовой гиперполяризацией тоже имели высокую скорость генерации ПД и устойчивые берсты с 4–13 спайками, фазовой привязкой к негативному пику тета-ритма зубчатой фасции. Гиперполяризационный импульс показал, что мембрана имеет малую постоянную времени, прекращение гиперполяризационного имульса дает эффект отдачи в виде генерации спайков. Деполяризация
389
