
Александров Ю.И., Анохин К.В. - Нейрон. Обработка сигналов. Пластичность. Моделирование_ Фундаментальное руководство (2008)
.pdf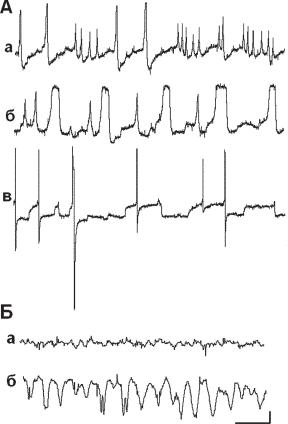
Ðèñ. 13.3. Фоновая активность, зарегистрированная внутриклеточными электродами у инфузории Paramecia caudatum. А. Электрические потенциалы, зарегистрированные в течение опыта у одной и той же клетки: а, б — участки активности, представленные несколькими эндонейрональными осцилляторами; в — генерация разноамплитудных потенциалов действия у той же самой парамеции. Б — фоновая активность, зарегистрированная у парамеции в другом опыте: a — осцилляции высокой частоты и небольшой амплитуды у спокойной парамеции; б — изменение фоновой активности у той же парамеции через 7 мин. от начала регистрации. Калибровка: 10 мВ. 1 с.
Множественность пейсмекеров одноклеточных. Регистрация электрической активности внутриклеточным микроэлектродом у инфузории Paramecium caudatum показала разнообразие осцилляторной ак-
330
тивности. Регистрация производилась от парамеции в момент ее отдыха: не применялось каких-либо обездвиживающих приемов, так как все способы в определенной степени травмируют двигательную систему этого одноклеточного. По этой причине регистрации были кратковременны — не более 15 мин. Записи электрической активности показывают, что, вопервых, в клетке регистрируются медленные и быстрые осцилляции, как это было описано в работе Коштоянца и Кокиной (1962), во-вторых, активны, как правило, одновременно несколько эндогенных осцилляторов, что совпадает с наблюдениями других авторов (Доронин и Зазулин, 1976). На некоторых записях можно выделить два–три одновременно работающих пейсмекера (рис. 13.3). Увеличение амплитуды волн эндогенной активности может приводить к генерации ПД (рис. 13.3, А, а-в). Амплитуда ПД, по-видимому, зависит от функциональных особенностей вызвавшего его пейсмекера. На нейрограммах можно видеть спайки как одинаковой, так и отличающейся амплитуды. Они отличаются друг от друга на единицы и даже десятки мВ. (рис. 13.3, А, в).
Ðèñ. 13.4. Электрическая активность, зарегистрированная у инфузории Paramecia caudatum внутриклеточным микроэлектродом в ответ на освещение ее белым светом через 6 мин. (а); б — аналогичный опыт на другой парамеции. Калибровка: 10 мВ, 1 с.
В опыте обнаружили, что включение белого света влияет на электрическую активность одноклеточного существа (рис. 13.4). Изменение мембранного потенциала под влиянием световых сигналов отмечен и
331
другими авторами (Kuhlmann, 1998). В рассматриваемом опыте интересен факт включения пейсмекерной активности, достигающей порога генерации спайка, подключением механизма, который напоминает по электрофизиологическому эффекту ТПСП увеличивающейся амплитуды (рис. 13.4, а). Каждая следующая волна приводит к повышению уровня поляризации мембраны, так что при критическом увеличении разности потенциалов происходит запуск механизма спайкогенерации. Аналогичное явление мы получили на полностью изолированных нейронах, когда при повторных микроаппликациях нейромедиатора возникал ТПСП, инициирующий постепенный запуск пейсмекера (рис. 13.11, б). Однако в рассматриваемом примере, полученном на одноклеточной парамеции, механизм активации эндогенного процесса был связан только с прямым действием света на мембрану. Описываемое явление было воспроизведено и на других парамециях (рис. 13.4, б).
Некоторые исследователи предполагают, что ритмические колебания потенциала являются отражением деятельности системы осморегуляции (Доронин и Зазулин, 1976). Аналогичные гиперполяризационные отклонения возникают при искусственном повреждении значительного участка клеточной поверхности и исчезают после регенерации нанесенного повреждения, а также в момент смерти клетки, когда происходит деструкция клеточной оболочки. Медленные регулярные колебания потенциала известны у Opalina ranarum (Коштоянц и Кокина, 1962). Они связываются с изменением направления биения ресничек. Подводя итог приведенным данным, можно сказать, что электрическая гетерогенность одноклеточных является отражением субстанциональной и функциональной изменчивости, предопределяется существованием этой клетки как самостоятельного организма (Доронин и Зозу-
ëèí, 1976).
Спонтанные изменения поведения. Анализ работ, посвященных изучению врожденных и приобретенных форм поведения у беспозвоночных, позволяет сделать вывод о том, что способность к накоплению индивидуального опыта появляется в эволюции на самых ранних ступенях развития — у донервных простейших организмов (Тушмалова, 1987). Спонтанные изменения поведения — тенденция организма поворачи- вать направо или налево в лабиринте — являются стандартной метрикой кратковременной памяти в экспериментах по психофармакологии и развитию. Хотя спонтанные изменения поведения являются, пожалуй, наиболее распространенной формой поведения в филогенезе подвижных биологических форм, существуют и спорные сведения. Например,
332
предыдущие исследования дали противоречивые данные о существовании спонтанных изменений поведения у простейших парамеций. Но в этих работах рассматривалось поведение многих одноклеточных с использованием слишком разных тестов и различных экспериментальных конструкций. Применение простого устройства позволило показать, что фактически оба вида одноклеточных не отличаются изменчивостью поведения. В особенности изменения спонтанные проявляются в лабиринтах с короткими треками, но не с длинными. Эти результаты полностью согласуются с данными, полученными на других видах одноклеточных, и устраняют противоречие, связанное с более ранними работами на парамециях (Hughes, 2004). Кроме того, они показывают, что необходимо проявлять осторожность при интерпретации результатов, полученных на разных видах, тестированных в различных устройствах. Предполагается, что, по крайней мере, у некоторых таксонов спонтанные изменения поведения не прямо зависят от использования кратковременной памяти (Harvey, Bovell, 2006). Одноклеточные проявляют предпочтение определенным полярностям электрического тока, что было показано в поведен- чесаких опытах (Armus and Montgomery, 2001). Оказалось, что электри- ческое раздражение средней силы от катодного источника может служить положительным и привлекательным для парамеций воздействием, анодная стимуляция обладает прямо противоположными свойствами —
вызывает отвращение и избегание.
Влияние окружающей среды на пейсмекеры одноклеточных.
Парамеции отвечают на химические воздействия окружающей среды. Среди таких сигналов находятся вещества, выполняющие нейромедиаторную функцию у многоклеточных животных, например, ацетилхолин и глутамат (Коштоянц и Кокина, 1962, Van Houten, 1998). Описаны ответы на глутамат: одноклеточные привлекаются L-глутаматом больше (при его добавлении во внеклеточную среду), чем высокой кон-
центрацией глутамата с KCl. (Van Houten, 1998).
Кальций и регуляция поведения парамеции. Многие стимулы: температурные, электрические, механические, химические — могут влиять на скорость плавания, а также на частоту и продолжительность видов плавания (вперед-назад, вращательное). Эти ответы обычно кратковременны. Клетка возвращается к своему предстимульному поведению в условиях постоянного присутствия стимула, демонстрируя форму сенсорной адаптации. Например, увеличение скорости плавания коррелирует с мембранной деполяризацией. Сильная деполяризация может вызывать градуальный Са-зависимый потенциал действия, при-
333
водя к вращательному и обратному плаванию, которое связано с повышением концентрации внутриресничного Са2+.
Усиленные электрофизиологические исследования реснитчатых простейших, таких, как Paramecium и Stylonychia, позволили установить, что двигательное поведение этих одноклеточных организмов регулируется возбудимостью мембраны. Внешние стимулы, такие, как механическое раздражение, деполяризация или гиперполяризация мембраны, соответствуют топографической организации рецепторной проводимости. Деполяризация, связанная с активацией рецептора, усиливается, чтобы стать градуальным потенциалом действия, который своим происхождением обязан расположению вольт-зависимых Саканалов. Са, входящий внутрь клетки по электрохимическому градиенту, повышает концентрацию внутриклеточного кальция и запускает тем самым специфическую двигательную реакцию ресничек, называемую ciliary reversal. Гиперполяризация мембраны изменяет частоту и направление биения ресничек таким образом, что становится причи- ной ускорения движения клетки вперед. Участие ионов кальция в регуляции этих плавательных движений до конца не выяснена (Brehm and Eckert, 1998).
Концентрация внутриклеточного кальция является хорошо известным сигналом для регуляции различных физиологических активностей. Во многих случаях Са(2+) одновременно регулирует несколько функций в одной клетке. Каким же образом происходит независимое регулирование? У парамеций контрактильная цитоскелетная система и реснички расположены близко друг к другу вблизи клеточной поверхности. Сокращения тела клетки, прекращение биения ресничек и увеличение частоты этих биений регулируется при помощи концентрации внутриклеточного кальция. Перечисленные процессы не всегда запускаются одновременно. В одноклеточное (парамецию) инъецировали связанный кальций и постоянно применяли ультрафиолетовое освещение, чтобы повысить концентрацию внутриклеточного кальция. Сокращения тела клетки начинались сразу же со включением ультрафиолета, и степень сокращений постепенно изменялась. С другой стороны, биение ресничек реверсировало через 1,4 с после включения ультрафиолета и полностью завершалось через 100 мс. Частота биения ресни- чек в обратном направлении была значительно выше, чем в нормальном направлении. Эти результаты показывают, что сокращения тела регулируются внутриклеточным кальцием по типу «доза-эффект», а изменение направления движения ресничек и скорость биений запус-
334
каются внутриклеточным кальцием по типу «все-или-ничего» (Iwadate,
Nakaoka, 2008)
Внутриклеточная сигнализация у одноклеточных и осцил-
ляции. Внутриклеточная сигнализация и взаимодействие клетки с клеткой является основной чертой живых организмов. Реснитчатые простейшие обнаруживают сложные механизмы внутриклеточной сигнализации. Реснитчатые контактируют (взаимодействуют) с другими клетками, например, симбиотически с микроорганизмами, которые находятся в ядре. Реснитчатые взаимодействуют и друг с другом. Многие феномены клеточной коммуникации у реснитчатых, по-видимому, сходны с теми, которые обнаружены у мультиклеточных организмов (Gцrtz et al., 1999, Christensen et al., 1998). Пуриновый нуклеотид GTP при экстраклеточном добавлении вызывает осцилляции плавательного поведения у простейших Paramecium tetraurelia. В течение 10 мин. клетка плавает попеременно вперед-назад. Осцилляции плвательного поведения управляются изменением мембранного потенциала клетки, который, в свою очередь, является причиной периодической активации входящего Mg2+ и Na+- специфического тока. Когда исследовали мутантов (клетки, не обнаруживающие такого вида поведения при экстраклеточном влиянии GTP), то оказалось, что, во-первых, они могут быть нечувствительными к GTP при его добавлении в окружающую среду, во-вторых, этот нуклеотид может не вызывать изменений мембранных токов, которые обнаруживаются при его действии на «нормальные» клетки. Предполагается, что у мутантов затрагивается эндогенный осциллятор (Mimikakis et al., 1998). В экспериментах (Van Houten et al., 1998) было найдено, что глутамат гиперполяризует клетку. Ионный механизм до конца не изучен, но не исключено, что участие принимает К- проводимость. Глутамат вызывает резкое и быстрое увеличение цАМФ в клетке. Вероятно, в передачу сигнала вовлекается протеинкиназа. Активация протеинкиназы при быстром увеличении цАМФ может поддерживать гиперполяризацию клетки, фосфорилирование и активацию плазматического мембранного кальциевого насоса. Есть и другие протеины, связывающие глутамат на мембране клетки. Наблюдение за движениями парамеций, изучение их траекторий и форм позволили сделать вывод о том, что биомолекулярная система, которая содержит кальмодулин, кальмодулин–зависимые ионные каналы, аденилатциклазу, гуанилатциклазу, фосфодиэстеразу, Са(2+)-кальмодулин, цАМФ, цГМФ-зависимые протеинкиназы, фосфатазу, способна регулировать двигательную активность, необходимую для сложных пере-
335
движений парамеций в различных условиях Предполагается, что молекулярная система, состоящая из нескольких типов потенциало- и лиганд-зависимых каналов (калиевых и кальциевых), кальмодулина, аденилатциклаз, гуанилатциклазы, фосфодиэстераз, Са2+-кальмодулин, цAMФ-, cГMФ-зависимых протеинкиназ, фосфопротеинфосфатаз и т.д. (показано, что все это у парамеций есть), обладает свойствами, обеспе- чивающими управление несколькими двигательными реакциями. И даже можно сказать, что в свойствах этой системы заложено автоматическое решение определенных двигательных задач, требующих достаточно сложного маневрирования. К этим задачам можно отнести: задачи маневрирования в среде с различными препятствиями, задачи поиска пищи или полового партнера, двигательные задачи защиты и т.д. ( Котов и др., 2000).
13.3. Пейсмекеры многоклеточных
Эндогенное происхождение пейсмекера. Осцилляции, зарегистрированные в опытах на одноклеточных, не нуждаются в подтверждении эндогенного происхождения по причине уникальности объекта (рис. 13.2). На многоклеточных, сложно организованных нервных системах специальные опыты необходимы: причиной осцилляций могут быть сложные межнейронные взаимодействия.
Спонтанные потенциалы действия, которые развиваются в клетках без очевидного синаптического возбуждения, были обнаружены у ряда нейронов позвоноочных и беспозвоночных . Считается, что эти потенциалы действия возникают благодаря пейсмекерному механизму, который присущ данной клетке и является независимым от других нейронов (Bullock and Horridge, 1965). Существование эндогенной пейсмекерной активности у нейронов моллюсков убедительно доказано работами Альвинг, Баумгартена, и др. У нейронов аплизии существуют различия, которые связаны с местом возникновения пейсмекерных ПД и ПД, вызываемых синаптической активностью. Все синапсы у этих нейронов локализованы на дистальных отростках клетки, а сома синапсов не имеет. Более того, Tauc (1962) показал для идентифицированного нейрона, что при возникновении синапти- ческого возбуждения распространяющийся потенциал действия возникает в дистальной части отростков и этот спайк является причиной запуска соматического ПД. В противоположность этому потенциал действия, генерируемый пейсмекерным механизмом, инициируется сомой нейрона (Alving, 1969).
336
В висцеральном ганглии аплизии примерно 50–75% крупных нейронов демонстрируют спонтанные пейсмекерные разряды (Carpenter, 1967; Frazier, 1968, Kandel et al., 1967). Пейсмекерные разряды могут быть регулярными (ритмичный пейсмекер) или же состоять из периодических разрядов, разделенных периодами молчания (залповый или берстовый пейсмекер). Более 30 нейронов висцерального ганглия были идентифицированы по размеру, местоположению, синаптическим связям и паттерну разрядов. С небольшими вариациями идентифицированные клетки проявляют тенденцию демонстрировать одну и ту же форму разрядов от препарата к препарату по присутствию или отсутствию или по паттерну пейсмекерных разрядов. По крайней мере, один пейсмекерный нейрон демонстрирует два или больше циркадианных
ритмов (Strumwasser, 1965).
Локализация пейсмекера. Структурой, обеспечивающей пейсмекерную активность, считается ограниченный, электрически активный участок мембраны — локус. Из опытов А. Арванитаки и X. Шилазонитис (Arvanitaki, Chalasonitis,1956) следует, что размер локуса пейсмекерной активности на мембране нейрона равен 50–100 мкм. Таких участков на соме нейрона может быть несколько. Альвинг (Alving, 1968) провела эксперименты на нейронах морского моллюска, моллюска аплизии, применив перевязку аксона шелковой ниткой. Сомы пейсмекерных и непейсмекерных нейронов изолировали при помощи лигатуры вокруг аксонов между сомой и синаптической областью и регистрировали трансмембранные потенциалы. Опыты показали, что нейроны, демонстрировавшие пейсмекерную активность до перевязки аксона, сохраняли ее и после этого. Изолированная сома пейсмекерного нейрона имела спонтанные разряды, а изолированная сома непейсмекерного нейрона была молчащей. Кроме того, обнаружили, что время адаптации у этих нейронов было разным. У пейсмекерных нейронов инъецированный ток вызывал изменение скорости разрядов, которое сохранялось до конца предъявления тока, а у непейсмекерных нейронов отмечены только временные изменения скорости разрядов (рис. 13.5). Бесспорное подтверждение эндогенного происхождения пейсмекерного потенциала и его независимости от влияний системы достигается полной механической изоляцией нейрона после обработки мозга одним из протеолитических ферментов (трипсином, сахарозой, проназой и т.д.) (рис. 13.2). В изолированном нейроне остается только пейсмекерная активность, сохраняя тот же уровень колебаний, что и в интактном ганглии (Baumgarten et al., 1971). Способность к длительной
337

ритмической активности сохраняется у некоторых клеток в течение длительного времени после их полной физической изоляции из нервной системы. Следовательно, в ее основе действительно лежат эндогенные процессы, приводящие к периодическому изменению ионной проницаемости поверхностной мембраны (Греченко,Соколов, 1979, Baumgarten et al., 1971). У многих нейронов аплизии пейсмекерные разряды значительно редуцируются или даже полностью исчезают при замещении внешнего Na+ трисом или сахарозой, но не исчезают при замещении натрия литием, NH4+. Однако у некоторых клеток обнаружены спонтанные разряды даже при полном отсутствии Na+ при обеспечении Ca++.
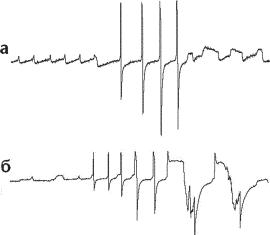
Ðèñ. 13.5. Образцы электрической активности нейрона аплизии. А — трансмембранный потенциал зарегистрирован у интактного пейсмекерного нейрона, получающего возбудительные и тормозные синаптические входы. Б — трансмембранный потенциал, зарегистрированный у того же самого нейрона после наложения лигатуры в области хиллока. Не отмечено никаких изменений потенциала покоя (по Alving B. O. Spontaneous activity in isolated somata of Aplysia pacemaker neurons J Gen Physiol. 1968 Jan; 51(1):29-45).
Получены результаты, которые показывают, что пейсмекерный локус и триггерная зона спайков у интактного пейсмекерного нейрона локализована на соме (Alving, 1968).
Пейсмекерные нейроны аплизии исследовались Штрумвассером и другими авторами. Waziri et al. (1965) считали, что результаты соответствуют наблюдениям за активностью нервных волокон Пуркинье, но в дальнейшем выдвинули предположение о том, что пейсмекерная активность является результатом высокой проводимости в покое для Na+ с вольт- и временной зависимостью для K+ после потенциала действия.
338
Strumwasser (1967, 1968) подчеркивал, что метаболически активные процессы также могут оказаться важными для организации паттернов пейсмекерной активности. Например, Chaplain (1979) предполагает, что эндогенная ритмическая активность пейсмекерных нейронов аплизии контролируется при помощи действий с циклом субстратов. Повторные циклы fructose-6-phosphate опосредуются двумя мембраносвязанными энзимами — phosphofructokinase (PFK) и fructose-1,6-diphosphatase (FDP). Аллостерические эффекторы, которые активируют PFK-FDP- ase систему, увеличивают регулярную ритмическую активность или индуцируют залповую (берстовую) активность, а тормозные эффекторы снижают пейсмекерную активность. Ассоциированный с PFK-FDPase цикл — это медленные осцилляции мембранного потенциала, если предположить, что изменения амплитуды и временного периода волн связаны с циклическими флуктуациями Н+ ионов и АТФ. Реакции других энзимов, которые затрагивают концентрацию глюконеогенных субстратов или PFK эффекторов, могут модулировать осцилляторный управляющий вход. На изолированных пейсмекерных нейронах действие тока может включить предсуществовавшие периоды активности
пейсмекера.
Локализация пейсекера на аксонных ветвях. Изучение эндогенной активности нейронов разных живых существ показало, что локус пейсмекерной активости может располагаться и на отростках. В частности, не исключается возможность их присутствия на дендритах. Цель работы Кононенко (2000) заключалась в определении роли аксодендритного дерева в генерации берстовой пейсмекерной активности у идентифицированного нейрона Rpa1, который гомологичен нейрону R15 у аплизии, и распространении ПД по аксону. Регистрировалась активность этого нейрона после перерезки правой или левой коннективы. При этом применялась фиксация напряжения на мембране и регистрировалась активность висцерального нерва, который содержит ветвь аксона нейрона Rpa1. Также применилась изоляция этого нейрона и аппликация окситацина. Перерезка правой, но не левой коннективы во всех случах вызывала полное исчезновение берстовых разрядов в Rpa1 и гиперполяризацию мембраны до -65–67 мВ. Такое молчание этого нейрона сохранялось и после его изоляции из ганглия. Описанная перерезка не приводила к изменению берстовой активности пейсмекерного нейрона V7, локализованного в висцеральном ганглии, хотя изоляция V7 тоже уничтожает его активность. Множество контролей, проведенных автором, позволяют ему сделать предположение о том, что
339
