
Александров Ю.И., Анохин К.В. - Нейрон. Обработка сигналов. Пластичность. Моделирование_ Фундаментальное руководство (2008)
.pdfлокус генерации пейсмекерной активности локализован на дендритном дереве нейрона RPa1. Выдвигается гипотеза о том, что берстовая и одиночная пейсмекерная активность связаны с функционированием разных локусов на дендритном дереве, в соответствии с их электрическими связями с аксонными ветвями (Kononenko, 2000). В экспериментах Kramer (1986) при помощи фиксации напряжения на мембране сомы берстовых нейронов аплизии в соединении с внутриаксонной регистрацией исследовался вклад аксональной активности в ионные токи, которые генерируют берстовую активность. Результаты показали, что ионные токи реализовались каналами, частично расположенными на соме, частично — на аксонах.
Потенциалы действия в залповых пейсмекерных нейронах R15 аплизии сопровождаются медленными входящими и выходящими токами последействия. В опытах Lewis (1988) ставилась задача изучения роли аксодендритного кальциевого потока в активации этих токов последействия. Для получения этих токов применяли деполяризационную посылку при использовании метода фиксации напряжения на мембране. Опыты показали, что, хотя токи последействия зависят от Са++, они не подавлялись деполяризацией, которая превышала потенциал равновесия для кальция. Но если экстраклеточный кальций был меньше 1 mM, большая деполяризация подавляла деполяризационное последействие. Дофамин блокирует деполяризационное последействие, если он апплицируется в аксо-денд- ритной области, но не действует, если апплицируется к соме. Аналогично последействие блокируется синаптически торможением большой длительности (LTI). В экспериментах, выполненных на срезах мозга морской свинки, показано, что при деполяризационном смещении МП до -45 мВ у таламических нейронов возникают высокочастотные осцилляции (20–80 Гц). Источник этих осцилляций локализуются в дендритном слое, они поддерживаются активацией кальциевых каналов определенного типа. Короткие гиперполяризационные импульсы временно увеличива-
ют амплитуду этих осцилляций (Prosser et al., 1989).
Классификация пейсмекерных нейронов. Изолированные нейроны обычно сохраняют тот вид фоновой активности, который был для них характерен при их нахождении в естественном структурно-функци- ональном ансамбле нервных элементов перед выделением клетки из системы. Электрическая активность изолированных нервных клеток стабильна в течение многих часов. По виду фоновой электрической активности пейсмекерные нейроны подразделяются на нейроны с монотонной фоновой ритмикой, когда на деполяризационной волне возникает только
340
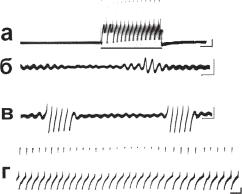
один спайк, и нейроны с ритмическим возникновением групп спайков (рис. 13.6). У моллюсков чаще встречается регулярный пейсмекерный потенциал с амплитудой 5–25 мВ и периодом колебаний 1–2 с.
Ðèñ. 13.6. Виды пейсмекерной активности изолированных нейронов моллюска Helix lucorum: а — молчащий нейрон с латентным пейсмекером, который активируется при действии электрического деполяризационного стимула силой 0,75 нА длительностью 5 с; б–г — актуальная пейсмекерная активность не достигающая (б) и достигающая порога генерации потенциалов действия (ПД). Пейсмекерные потенциалы организуют паттерны разрядов — групповые
(в) и регулярные ПД (г). Калибровка: 10 мВ. 1 с.
Кроме фоновоактивных, обнаружены нейроны, у которых фоновая спайковая активность отсутствует. Однако в результате активации такой клетки в ней возникает и в течение длительного времени может поддерживаться ритмическая спайковая активность, обусловленная деятельностью пейсмекерного механизма (рис. 13.6, а). Такой нейрон принято называть латентным пейсмекерным нейроном в отличие от нейрона с выраженной пейсмекерной активностью, который называется актуальным пейсмекерным нейроном (Соколов, Ярмизина, 1972). Потенциальным пейсмекерным нейроном называют тот нейрон, у которого в опыте пейсмекерная активность отсутствует и ее не удается вызвать, но при изве-
стных условиях (например, сезонных) она все же может наблюдаться.
Пейсмекер и уровень мембранного потенциала. Пейсмекерные потенциалы чрезвычайно зависимы от уровня мембранного потенциала нейронов (Alving, 1968, Пейсмекерный потенциал, 1975, Греченко, 2001). Отмечены две особенности: во-первых, актуальный пейсмекер наиболее чувствителен к гиперполяризационным смещениям
341
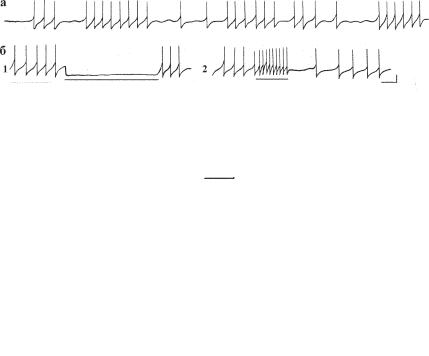
мембранного потенциала (МП): в некоторых случаях достаточно сдвига менее чем на 1 мВ для того, чтобы полностью выключить генерацию пейсмекера (рис. 13.7, б). Во-вторых, уровень актуализации латентного пейсмекера может находиться выше или ниже потенциала покоя нейрона (рис. 13.8), а при деили гиперполяризационном изменении МП проявляется взаимозависимость между несколькими клеточными осцилляторами (рис. 13.8). В основе такой связи осцилляторов лежит разная чувствительность к уровню поляризации клетки и к тем эндонейрональным процессам, которые ими запускаются. По-видимому, это влияние уровня МП является общим для пейсмекеров любого эволюционного уровня: подобную созависимость осцилляторов обнаружили при регистрации электрической активности парамеции (рис. 13.8, В).
Ðèñ. 13.7. Нерегулярная пейсмекерная активность и действие токов поляризации на пейсмекерные потенциалы: а — фоновая активность нейрона; б — действие токов поляризации — гиперполяризационного силой 0,3 нА (1) и деполяризационного той же силы (2). Длительность импульса поляризации 5 с. Калибровка: 10 мВ, 1 с.
Ðèñ. 13.8. Влияние уровня поляризации клеток на пейсмекерные осцилляции. А,Б — соотношение между уровнем деполяризации нейрона, вызываемого импульсом тока силой 1,3 нА (А), 1,5 нА (Б,1) и 1,2 нА (Б,2) и запускаемыми электрическими процессами. В — потенциал-зависимые осцилляции, зарегистрированные у парамеции. Калибровка: 10 мВ, 1 с.
342
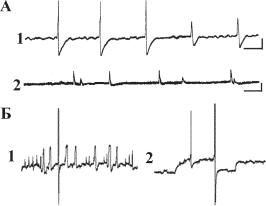
Множественность пейсмекеров. Электрофизиологические исследования, проведенные на одноклеточных, показывают, что у них регистрируются пейсмекеры, отличающиеся частотными, амплитудными и временными характеристиками. Колебания мембранного потенциала могут достигать порога генерации потенциала действия (рис. 13.9). На записи можно видеть присутствие нескольких процессов, приводящих к развитию ПД, имеющих разную амплитуду (рис. 13.9, Б).
Ðèñ. 13.9. Множественные осцилляции. А — появление разноамплитудных ПД после применения сильного внутриклеточного электрического воздействия (электрошока) (1) и после механического повреждения (2) у изолированных нейронов; Б — множественные осцилляции, зарегистрированные у парамеции, не достигающие порога генерации ПД (1) и приводящие к спайковой активности (2).
Можно предположить, что изначально пейсмекерная активность была представлена множественными процессами: на одноклеточных показано существование многих осцилляторов, которые в определенные моменты времени синхронизируются и порождают общий электрический ответ в виде ПД (Доронин и Зозулин, 1976). У одноклеточ- ных существ механизм организации поведения — это механизм координации осцилляторов. У многоклеточных организмов, например у интактной гидры, зарегистрированы ритмические потенциалы, на частоту (1–12 кол/мин.) и место генерации которых влияют сенсорные стимулы. Каждый импульс сложный и отличается по форме, месту возникновения, происходит от одного или нескольких пейсмекеров внутри системы элементов, соединенных электрическими синапсами (Passano and
343
McCullough, 1962). Координированная деятельность нескольких пейсмекеров необходима не только для организации поведения одноклеточных
— в нейронах более высоко организованных существ это явление (множественность пейсмекеров) тоже присутствует (рис. 13.9, А). Спайковая электрическая активность изолированного нейрона нерегулярна, не может быть связана с каким-либо одним ритмическим процессом. Следовательно, в ее основе лежит взаимодействие нескольких осцилляторов, и ПД возникают только при благоприятных условиях совпадения фаз и соответствующих ионных потоков, которые приводят к генерации ПД. В экстремальных условиях, например, при действии электрошока на клетку, можно получить доказательства существования в клетке нескольких осцилляторов (рис. 13.9, А). В норме у многоклеточных существ независимые пейсмекерные осцилляторы наблюдаются редко (Мартинес-Со- лер, Шехтер, 1975). Результаты электрофизиологических опытов согласуются с данными, в которых посредством анализа соотношений концентрации внутриклеточного кальция и величины входящего кальциевого тока показано существование своеобразных доменов. Не исключено, что электрофизиологически такая компартментализация клетки может быть представлена активностью пейсмекерных компонентов (Simon and Llinas, 1985). Исследования показывают, что идея об относительно функционально независимых компартментах нервных клеток подтверждается не только для пейсмекеров, но и для локусов электровозбудимых и хемо-
чувствительных мембран.
Запуск пейсмекерной активности. Так как функции пейсмекерной активности разнообразны, то ее активация вызывается разными причинами. Например, в опытах на нейронах полуинтактного препарата моллюска показано, что пейсмекерная активность у молчащей клетки «оживает» в определенное время суток, такой же феномен обнаружен и у нейронов более высоко организованных животных — это пейсмекеры, участвующие в регуляции циркадных ритмов. Найдена пейсмекерная активность у командных нейронов моллюска, у нейро- нов-модуляторов, осуществляющих тонкое влияние на целые нейронные ансамбли. Активное состояние пейсмекера может сохраняться в течение многих часов. Этот феномен лежит в основе весьма похожего явления, которое развивается при анодной поляризации и имеет боль-
шое значение для фиксации следа памяти (Греченко, Кондратьева, 1981).
Пейсмекеры и электрическая стимуляция. При поляризации областей мозга или отдельных нервных элементов в течение нескольких секунд анодным током выключение стимула вызывает эффект после-
344
действия. Последействие выражено повышением или понижением фоновой активности нейронов, сохраняющимся в течение длительного времени — от нескольких минут до нескольких часов (Воронин, 1966, Gartside, 1968). Для объяснения наблюдаемого феномена привлекают идею о реверберации импульсов по замкнутым цепям. Длительность последействия, возникшего после прекращения стимуляции,— это время циркуляции ПД по определенной замкнутой последовательности нейронов. В опытах на изолированных нейронах можно моделировать ситуации, в которых происходит активация пейсмекерного механизма.
В электрофизиологическом эксперименте на полностью изолированных нейронах были проведены опыты, условия которых позволили получить длительное последействие, возникавшее после выключения стимула. Изолированные нейроны полностью исключают возможность формирования последействия за счет циркуляции нервной активности: они физически и функционально лишены возможности контактировать с другими элементами центральной нервной системы (ЦНС) и образовывать какие-либо функциональные структуры.
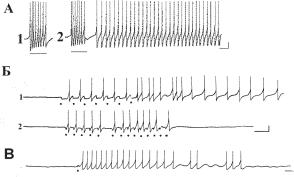
Ðèñ. 13.10. Включение пейсмекерной активности действием внутриклеточ- ных де- и гиперполяризационных импульсов (А и Б) и микроаппликацией нейромедиатора (В): А — включение регулярной пейсмекерной активности, достигающей порога генерации ПД, после предъявления 5 деполяризационных импульсов тока силой 1,3 в течение 2,5 с (1 и 2); Б — влияние параметров применяемых гиперполяризационных импульсов тока на включение пейсмекерного последействия: 1 — последействие, вызываемое гиперполяризационными импульсами силой 0,55 нА, длительностью 500 мс, частотой 0,5 Гц и отсутствие последействия при частоте предъявления 1,2 Гц (2); В — включение пейсмекерной активности микроаппликацией нейромедиатора АХ (длительность деполяризационного тока для аппликации 200 мс). Калибровка: 20 мВ, 1 с.
345
В нескольких опытах использовался гиперполяризационный электрический ток длительностью 10 с. Эффект, вызываемый применением такого стимула, заключается в том, что после его выключения возникает последействие, выраженное генерацией спайков у ранее спонтанно неактивного нейрона. В другой серии опытов эффект последействия был получен применением ритмических гиперполяризационных импульсов тока силой 0,12–0,35 нА, длительностью от 50 до 200 мс и частотой от 0,3 до 1 Гц. Длительность последействия зависит от параметров гиперполяризационных электрических импульсов. При оптимальном соотношении силы, длительности и частоты последействие сохраняется в течение 10–30 мин. Для некоторых клеток запуск длительно сохраняющейся пейсмекерной активности оказался возможным при действии одиночных или ритмичных деили гиперполяризационных имульсов электрического тока (рис. 13.10, А, Б). Существенным оказывается как количество предъявленных импульсов, так и их длительность, сила и частота (рис. 13.10). Если параметры оказались удачными, то после прекращения стимуляции пейсмекерная активность может сохраняться в течение нескольких минут и даже нескольких часов (от 1 до 5 часов в наших опытах).
Какой нейрофизиологический механизм лежит в основе формирования постстимульного последействия? Полученные результаты согласуются с предположением Гартсайда (1979), который пришел к выводу об эндогенной природе последействия, применив ингибиторы синтеза протеинов. Все перечисленное позволяет сделать заключение о формировании эффекта последействия за счет эндогенного пейсмекерного механизма.
Существование в ЦНС нейронов, способных к длительной постстимуляционной активации, обеспечивает функциональную готовность связанных с ними элементов и выполняет функцию, приписываемую реверберации,— поддержание системы воспроизведения в активном состоянии.
Пейсмекер и синаптические потенциалы. По соотношению пейсмекерных и синаптических потенциалов нейроны подразделяются на пейсмекерные, синаптические и пейсмекерно-синаптические (Соколов и Ярмизина, 1972). Запускать генерацию колебаний мембранного потенциала могут синаптические и внесинаптические влияния.
В опытах на нейронах полуинтактного препарата или препарата изолированной ЦНС моллюска обнаружили, что запуск пейсмекерной активности происходит при активации некоторых синаптических входов (рис. 13.11). В зависимости от вида и особенностей синаптической передачи пейсмекерные потенциалы могут генерироваться в течение перио-
346
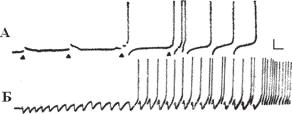
да от нескольких секунд до многих часов (Соколов Е. Н., Ярмизина, 1975, Gуmez-Beldarrain et al., 1998, Niktarash, 2003, Parnas I., Sturmwasser, 1975). Такие же результаты были получены и в опытах на полностью изолированных нейронах виноградной улитки, что доказывает влияние нейромедиатора на запуск эндогенных осцилляторов (рис. 13.6, В). Чувствительность к медиатору у локусов, запускающих длительную активность пейсмекера или же его длительное подавление, очень высокая: по сравнению с другими хемочувствительными локусами того же самого нейрона количество эффективно действующего медиатора оказывается в несколько раз меньше. Тестирование свойств других хемовозбудимых локусов этой же сомы показывает, что лишь избранные локусы имеют такую связь: это явление селективно, связь с пейсмекером доступна только избранным хемочувствительным входам (Греченко, 2001).
Ðèñ. 13.11. Синаптическая фасилитация с подключением пейсмекерной активности. А — постепенное увеличение ВПСП на 1, 2, 3 и 4 стимулы. На 4 стимул возникает группа синаптических ПД с активацией в последействии пейсмекерной спайковой активности. Треугольник — нанесение одиночного тактильного стимула. Б — постепенное возрастание амплитуды ТПСП и вовлечение эндогенного механизма генерации ПД на тактильные раздражения. Калибровка: 10 мВ, 1 с. (по: Ярмизина А. Л. Пластичность нейрона // Пейсмекерный потенциал нейрона, 1975, Тбилиси. С. 87-108).
Взаимодействие пейсмекерной активности с синаптическими потенциалами может проявляться и в форме пластических изменений ответа при развитии таких феноменов, как сенситизация или десенситизация (рис. 13.12). При многократной активации одного и того же синаптического входа постепенно происходит ослабление (или усиление при сенситизации) влияния на пейсмекерную активность клетки. Многие исследователи подчеркивают значение такого взаимодействия для самых разных процессов, например, для организации ритмики мозга или ритмики клеточного ансамбля. Есть данные о том, что синапсы, работающие на разных медиаторах, совершенно по-разному
347
влияют на пейсмекерную активность, а активность нейронных систем может регулироваться разными синаптическими входами от пейсмекерного нейрона. Результат определяется свойствами синапса (Rabbah, Nadim, 2007).
У многоклеточных организмов для обеспечения адаптивного поведения формируются нейронные системы. Межклеточное взаимодействие осуществляется посредством синаптических контактов. На идентифицированных нейронах моллюсков показано взаимодействие постсинапти- ческих потенциалов (ПСП) с эндонейрональной пейсмекерной активностью. Наиболее изученным является взаимодействие сенсорных и командных нейронов (Литвинов, 1975, Соколов и Незлина, 2007). Кроме ВПСП, в командных нейронах оборонительного поведения моллюсков регистрируется пейсмекерная активность. Командный нейрон имеет латентный высокопороговый пейсмекерный механизм (в спокойном состоянии пейсмекеры осутствуют, но возникают при возбуждении). На изолированных командных нейронах пейсмекер включается деполяризационным смещением мембранного потенциала (МП). Пейсмекерные волны имеют частоту около 1 Гц. Если амплитуда достигает порога генерации, то возникают регулярные потенциалы действия, которые распространяются по аксону, достигают двигательных нейронов и вызывают мышечное сокращение. Кроме внутриклеточной деполяризации, включение эндогенного пейсмекера может происходить при синаптической деполяризации командного нейрона. В этом случае пейсмекерные осцилляции выступают в роли усилителя ответа нейрона на пришедшее синаптическое возбуждение и продлевают активирующее действие коротких ВПСП, обеспечивая осуществление длительного по времени сократительного движения. В опытах на изолированных нейронах показано, что между пейсмекером и ПСП существуют различные виды взаимодействия. Например, ТПСП, вызывая гиперполяризационное смещение МП, временно прерывает генерацию ПД (рис. 13.12, в). Изучение усиливающей синаптический ответ нейрона функции пейсмекера показало, что не каждый локус химической чувствительности может запускать длительную пейсмекерную активность (рис. 13.13). Только «избранные» синаптические контакты демонстрируют особое влияние на локус пейсмекерной активности. Не исключено, что именно такой тип связи между нейронами опосредуют нейроны-модуля- торы, усиливающие синаптическое взаимодействие сенсорных и командных нейронов (рис. 13.14). Кроме запуска пейсмекерной активности, через изменение уровня поляризации мембраны реализуется также влияние синаптического входа непосредственно на локус пейсмекера. В этом слу- чае генерация ПД не связана со смещением МП.
348
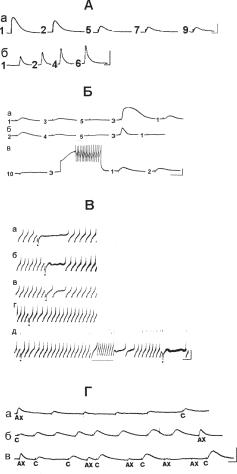
Ðèñ. 13.12. Изменения ответов на повторные микроаппликации нейромедиатора ацетилхолина (АХ): А — десенситизация при повторном предъявлении микроаппликаций в локус химической чувствительности. Частота предъявления АХ 1 раз в 1 мин.; б — сенситизация при предъявлении АХ с частотой 1 раз в 30 с. Калибровка: 10 мВ, с. Б — Рис. 14. Десенситизация хемочувствительной соматической мембраны при повторных предъявлениях АХ: а — первая серия, б — вторая серия. Цифры с левой стороны соответствуют номеру предъявляемого стимула, ЭС — экстрастимул. В первой серии это микроаппликация большого количества медиатора в тот же самый локус химической чувствительности, во второй (б) — в другой хемочувствительный локус, в — частичное растормаживание ответа при действии внутриклеточ- ного деполяризационного импульса силой 2,5 нА. Обозначения прежние. Калибровка: 10 мВ, 1 с. В — развитие десенситизации и растормаживание при действии внутриклеточного деполяризационного импульса тока силой 1,2 нА: а–г — ответы на 2, 4, 9, 12 предъявление
серотонина, д — отсутствие ответа на 15 предъявление С, действие внутриклеточного деполяризационного стимула (отмечено пунктирной линией) и ответ на С. Моменты микроаппликаций нейромедиатора отмечены точками. Амплитуда ПД полностью не прописана. Калибровка: 10 мВ, 1 с. Г — независимое развитие пластических изменений в разных локусах хемочувствительной мембраны: а — развитие десенситизации при повторном предъявлении АХ, б — развитие сенситизации при ритмичном предъявлении серотонина (С) в другой локус, в — независимое развитие пластических изменений в каждом из локусов при одновременном нанесении микроаппликаций АХ и С. Калибровка: 10 мВ, 2 c.
349
