
Хенке_Жидкостная хроматография [2009]
.pdf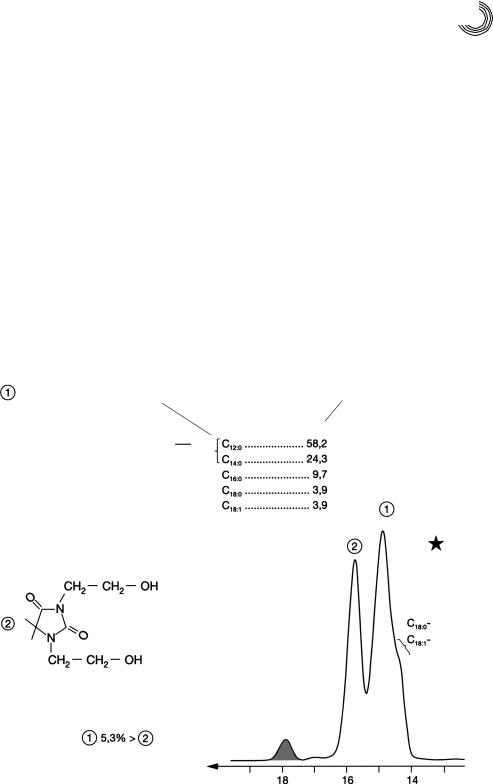
8.3. Препаративная гелевая хроматография 201
чество указывает наличие и отсутствие кавычек в слове «лаурат». Разделение мета! нолизата проводилось на пятом наборе колонок (1 м + 2,2 м, внутренний диаметр 25/26 мм) на Сефадексе LH!20 метанолом (2 мл/мин) (см. рис. 8.15). Разделение осуществляется не строго по «законам» молекулярно!ситовой хроматографии (МСХ). Пики отличаются по молекулярной массе (ММ) только на 5,3%, а не на 10%, как это ожидается при таком разделении. Второго и лучшего разделения про! дукта переэтерификации можно было бы достичь на 6 стеклянных готовых колон! ках Lobar®!LiChroprep!RP С!8 с метанолом в качестве элюента. В качестве перво! го пика появился бы в элюате N,N’!бис!(!2!гидроксиэтил)!5,5!диметилгидантоин и затем кислоты жирного ряда в виде сложных метиловых эфиров по возрастающе! му числу С. Сложные метиловые эфиры пальмитиновой и олеиновой кислот элюи! ровали бы при этих условиях разделения, т. е. чистым метанолом, не разделенны! ми. Для количественного разделения обоих видов сложных метиловых эфиров хва! тило бы уже 3…5 частей объема воды в метаноле.
Оригинальная проба, однако не из идентичной партии, была количественно разделена на 3 стеклянных готовых колонках Lobar®!LiChroprep!RP С!8, размер В
(25 × 310 мм) смесью метанола и воды (97 : 3), и тем самым смогли получить пер! воначальный состав как количественно, так и качественно.
Смесь сложных метиловых эфиров жирных кислот из разделения ВЭЖХ
741 мг
Поверхность, %
ММ 228
358 мг
и
ММ 216
МЭ
Вода
ч
Рис. 8.15. Препаративное разделение метанолизата ко!эмульгатора на Сефадексе LH!20
202
 Глава 8. Аналитические и препаративные разделения
Глава 8. Аналитические и препаративные разделения
Монолаурат полиэтиленоксидсорбитана |
n примерно 20 |
Mr примерно 1200 |
Монопальмитат полиэтиленоксидсорбитана |
n примерно 20 |
Mr примерно 1280 |
Моностеарат полиэтиленоксидсорбитана |
n примерно 20 |
Mr примерно 1300 |
a + b + c + d = примерно 20
Вода
ч
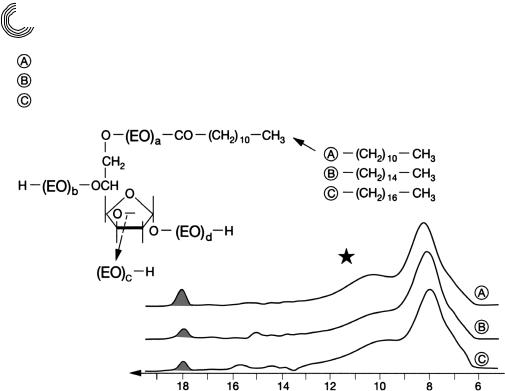
Рис. 8.16. Препаративное разделение сложных эфиров кислот жирного ряда поли! этиленоксидсорбитана на Сефадексе LH!20
8.3.7.Сложный эфир кислоты жирного ряда полиэтиленоксидсорбитана
На рис. 8.16 представлены хроматограммы 3 сложных эфиров кислот жирного ряда
полиэтиленоксидсорбитана, называемых также полисорбаты, записанных при идентичных условиях разделения. Незначительное, однако видимое различие в форме кривых элюирования главных пиков определяется длинами цепей жирных
кислот. В основном 3 полисорбата, которые использовались как вещества, спо!
собствующие растворению, имеют сравнимый состав, если сравнивать широкий разброс распределения молекулярных масс.
8.3.8. Пробы
Звезда ( ) и треугольник (
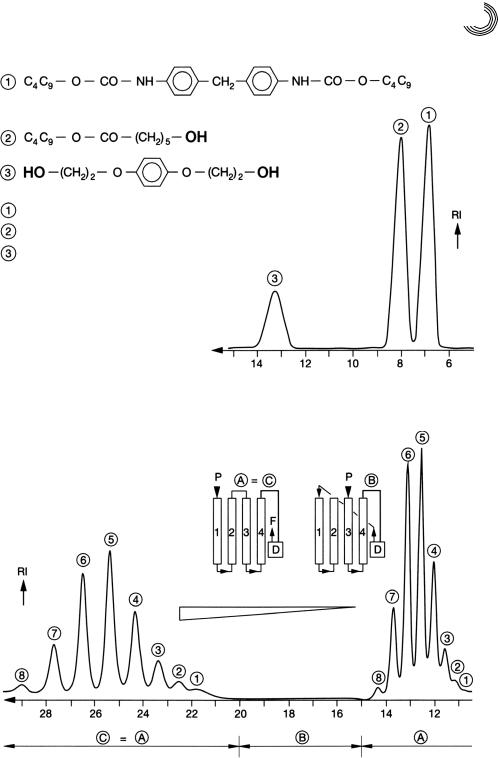
) и треугольник ( ) на рис. 8.17 по 8.21 обозначают, что все разделения проводились на одной и той же аппаратуре и при идентичных условиях. На рис. 8.17 представлен бутанолизат пробы полиэфирного полиуретана. В качестве жест! кого сегмента использовался метилендифенилдиизоцианат, а в качестве гибко! го сегмента – поликапролактон. Соединение форполимеров проводилось с по! мощью сшивателя гидрохинон! бис!(2!гидроксиэтил)!эфира. Этот пример очень
) на рис. 8.17 по 8.21 обозначают, что все разделения проводились на одной и той же аппаратуре и при идентичных условиях. На рис. 8.17 представлен бутанолизат пробы полиэфирного полиуретана. В качестве жест! кого сегмента использовался метилендифенилдиизоцианат, а в качестве гибко! го сегмента – поликапролактон. Соединение форполимеров проводилось с по! мощью сшивателя гидрохинон! бис!(2!гидроксиэтил)!эфира. Этот пример очень
наглядно показывает щадящую и все!таки количественную деполимеризацию
полиуретанов. В полимерах были представлены 2 разных вида соединения: сложно!
8.3. Препаративная гелевая хроматография 203
Проба: 2 г полиуретана
Диизоцианат дибутилуретан
из макродиола
Сшиватель
ММ 398 |
818 мг |
ММ 188 |
1851 мг |
ММ 198 |
277 мг |
ч
Рис. 8.17. Препаративное гель!хроматографическое разделение полиуретандеполи! меризата
Колонки: 4; длина = 1430 мм, внутренний диаметр = 70 мм Удлинение колонок показывает следующая схема
15 г аддукта ПО глицерина
ч
Рис. 8.18. Удлинение колонок путем их соединения (рециркуляционная хромато! графия)
204
 Глава 8. Аналитические и препаративные разделения
Глава 8. Аналитические и препаративные разделения
эфирная связь (–О–СО–) в гибком сегменте и уретановая связь (–О–СО–NH) между жестким сегментом и полиэфиром или сшивателем. Это значит, что с по! мощью деполимеризации были проведены перэтерификация и переуретани!
зация.
Как можно путем простого соединения колонок достичь их удлинения, изоб! ражает рис. 8.18. Если удвоить длину слоя геля, значит, как правило, улучшить разделение на коэффициент 1,4. Благодаря эффекту адсорбции разделение может быть намного лучше, чем упомянутое правило, и это прекрасно было видно при разделении смеси мальтодекстрина на Сефадексе LH!20 водой.
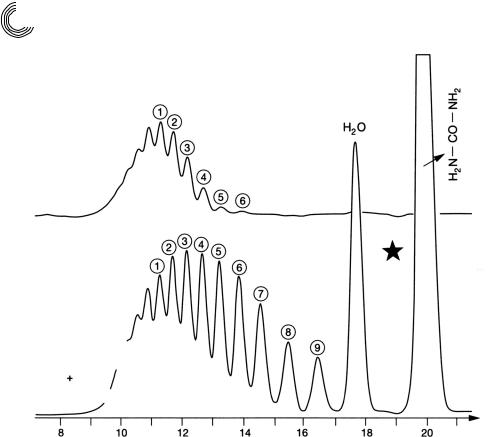
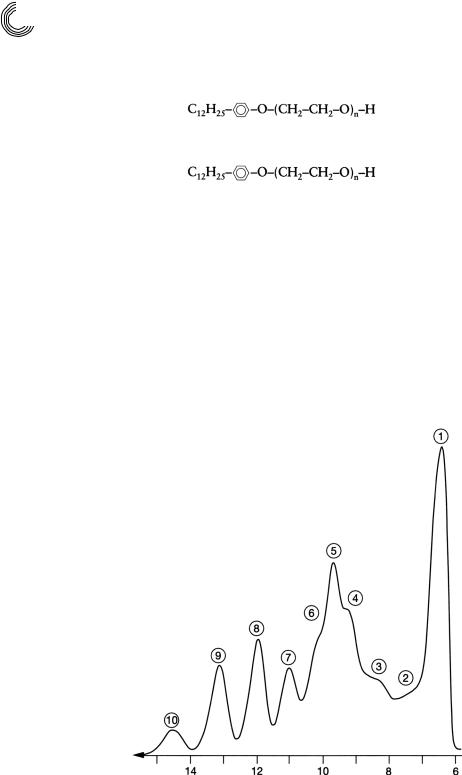
На рис. 8.19 и 8.20 можно видеть алкилфенольный полигликоль, а также ад! дукты этиленоксида (ЭО) кислоты жирного ряда. Рисунок 8.21 представляет по! пытку этоксилировать мочевину в воде, и результат отчетливо узнаваем. Присое! динение этиленоксида к мочевине в воде здесь неважно.
ЭО – этиленоксид
5 • ЭО
Вода
ч
9 • ЭО
ч
12 • ЭО
ч
Рис. 8.19. Препаративное сравнительное разделение аддуктов ЭО n!нонилфенола
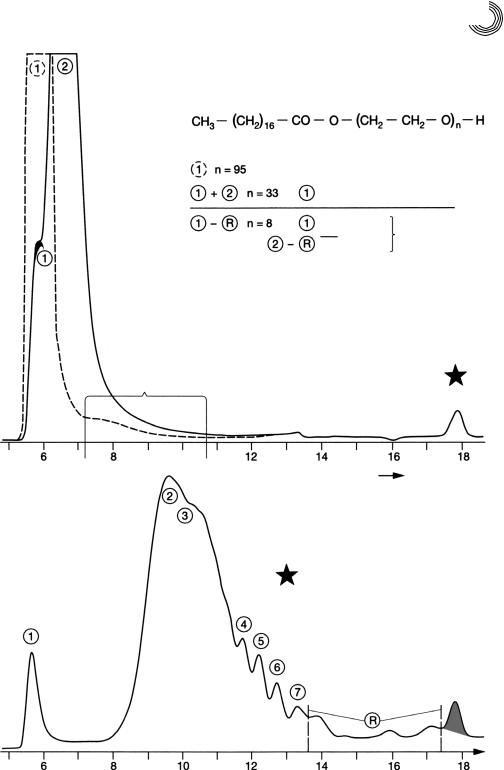
8.3. Препаративная гелевая хроматография 205
ПЭГ ≥ 4000
52 мг
ММ ≥ 4000* |
1000 мг |
ММ ≥ 4000* |
962 мг |
ММ ≥ 4000*
980 мг
ММ 636
* После времени элюирования
43 мг
Вода
ч
355 мг
389 мг
64 мг
45 мг
19 мг
18 мг
Вода
35 мг
ч
Рис. 8.20. Препаративное гель!хроматографическое разделение аддуктов ЭО стеа! риновой кислоты
206
 Глава 8. Аналитические и препаративные разделения
Глава 8. Аналитические и препаративные разделения
В основном ПЭГ 200 образовался с относительно большим количеством диэтиленгликоля (ДЭГ) и этиленгликоля (ЭГ)!
316 мг ПЭГ 400
ДЭГ
ЭГ
1515 мг продукта реакции из ЭО мочевины* при 40° С в Н2О
315 мг ПЭГ 400
Мочевина
ч
Рис. 8.21. Препаративное гель!хроматографическое разделение продукта реакции из мочевины и этиленоксида при 40°С в воде
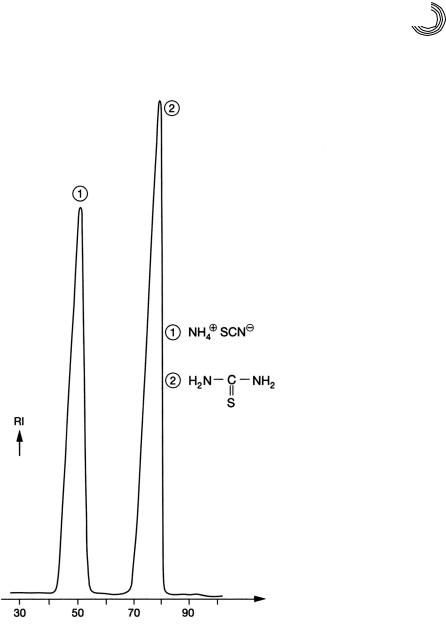
8.3.9. Смесь тиокарбамида – роданида аммония (1971)
Препаративное разделение реакционной смеси, состоящей из роданида аммония и тиокарбамида, можно осуществить очень просто с помощью дистиллирован! ной воды в качестве подвижной фазы на декстрангеле Сефадекс G!10 (предел ис!
ключения: ММ 700) (рис. 8.22). Были выбраны следующие условия разделения
(см. рис. 8.22).
Количественное разделение на колонке с высотой слоя геля 150 мм было бы завершено уже через 40 мин, или на таком же слое геля можно было бы разделить 3!кратное количество пробы, или при 3!кратном увеличении скорости пропуска! ния подвижной фазы значительно сократить время разделения. При идентичной молекулярной массе тиокарбамид, не способный к диссоциации, отстает силь!
нее, чем ионогенный роданид аммония.
Первое разделение было проведено без детектора. Роданид аммония был вна! чале определен качественно во фракциях элюата с помощью ионов Fe, а количе! ственное определение проводилось гравиметрическим путем.
Фракции тиокарбамида были нанесены на пластину тонкослойной хроматогра! фии (2…3 мкл) и качественно определены с помощью 4!диметиламинобензалдегида.
Количественное определение провели с помощью аргентометрического титрования.
8.3. Препаративная гелевая хроматография 207
Наполнитель колонки: |
Сефадекс G 10 |
Слой геля: |
13 × 300 мм |
Подвижная фаза/скорость протекания: |
вода дистил., 1 мл/мин |
Идентичные молярные массы: 76
118 мг
143 мг
мин
Рис. 8.22. Разделение роданида аммония и тиокарбамида
8.3.10. Полиамид 2,2 деполимеризат (1971)
При хлористоводородном гидролизе полиамида!2,2 в свободном виде выделяют! ся мономерные единицы щавелевой кислоты и этилендиамина в виде дигидро! хлоида. Оба компонента можно было бы разделить на щелочном или кислотном ионообменнике, один из компонентов подвергая адсорбции, а другой элюирова!
нию, или наоборот. Значительно проще оба соединения были разделены дистил!
лированной водой за один цикл на Сефадексе G!10 (предел исключения: ММ 700). Были выбраны следующие условия разделения:
208 |
Глава 8. Аналитические и препаративные разделения |
|
|
Слой геля Сефадекс!G!10: |
13 × 900 мм |
|
|
Подвижная фаза/скорость протекания: |
вода дистилл., 1 мл/мин |
|
|
Проба: |
гидролизат полиамида!2,2 (80 мг) |
|
|
Пик 1: |
HCl · H2N –CH2–CH2–NH2 · HCl |
91 мг |
|
Пик 2: |
НООС–СООН |
62 мг |
|
R2,1 = 1,5 и это обозначает количественное разделение.
ПОЛИАМИД-2,2
NH–CO–CO–[NH–CH2–CH2–NH–CO–CO]n–NH–CH2–CH2–…
Из одной полимерной единицы (в квадратных скобках) возникают: 132 мг этилендиамина · 2 HCl и
90 мг щавелевой кислоты
8.3.11. Триэтиленгликоль и 2 этилгексанол
Разделение триэтиленгликоля и 2!этилгексанола (изооктанол) на 5!метровом ко! лоночном наборе (1 м + 2 по 2 м, внутренний диаметр 25/26 мм; метанол 2 мл/мин)
|
|
Количество |
||
|
|
–ОН |
–O– |
|
НО–CH2–CH2–О–CH2–CH2–О–CH2–CH2–ОН |
2 |
2 |
||
CH2–CH3 |
1 |
0 |
||
|
|
|||
CH3–CH2–CH2–CH2–СН–CH2–ОН |
|
|
||
тетра |
|
|
||
пента |
Изооктанол |
|
|
|
|
|
|
||
|
три |
|
|
|
гекса |
|
|
|
|
гепта |
|
|
|
|
окта |
ДЭГ |
Вода = |
||
ЭГ |
||||
|
Vz + Vp |
|||
ч
Рис. 8.23. Разделение триэтиленгликоля и 2!этилгексанола на Сефадексе LH!20 метанолом
8.3. Препаративная гелевая хроматография 209
показывает, что при использовании метанола в качестве подвижной фазы поляр! ные соединения декстрангеля, богатого НО, тоже задерживаются из!за адсорбци! онных взаимодействий. Диол (ММ 150), компонент ПЭГ!200, элюируется только на 12 мин раньше, чем спирт (ММ 130). Разницы молекулярных масс в 13,3% дол! жно было бы хватить, согласно законам молекулярно!ситовой хроматографии, чтобы их можно было количественно разделить. Рисунок 8.23 показывает, что это далеко не так.
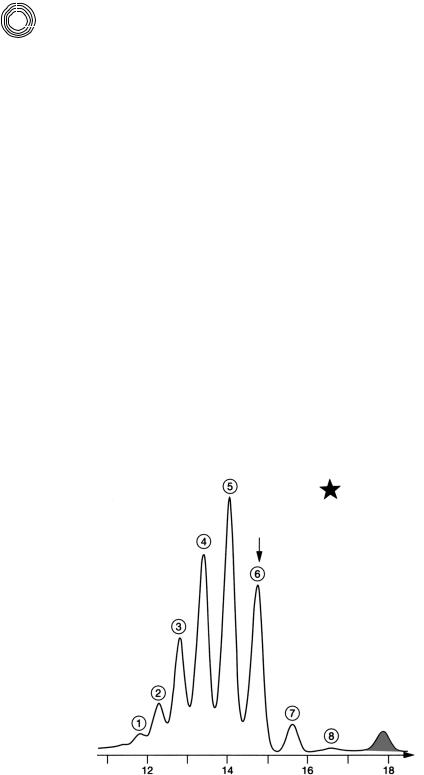
8.3.12. Разделение аддуктов додецилфенол – ЭО
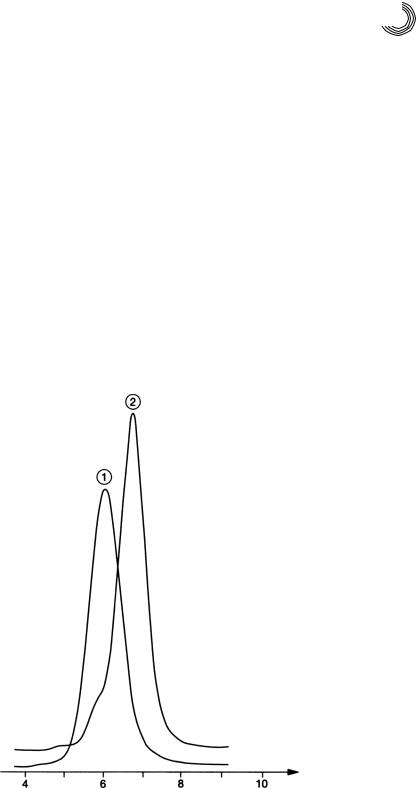
На рис. 8.24 можно видеть обе кривые элюирования додецилфенола 6 ЭО и 3 ЭО на Сефадексе LH!20 (1 м + 2 × 2 м, внутр. диаметр 25/26 мм) ацетоном (4 мл/мин) в качестве подвижной фазы. Известно, что этоксилаты представляют собой, как правило, смеси.
6 или 3 звена ЭО – это средняя степень этоксилирования. Здесь указывается на преимущество этого разделения: если в качестве подвижной фазы вместо ке! тона использовать метанол, то для обоих аддуктов ЭО получаются более широкие и разделенные между собой хроматограммы. В смеси они бы наслаивались. От этого пострадало бы качество разделения (сравни рис. 8.19). Благодаря простому
ч
Рис. 8.24. Разделение додецил!фенол ЭО аддуктов на Сефадексе LH!20 метанолом
210
 Глава 8. Аналитические и препаративные разделения
Глава 8. Аналитические и препаративные разделения
соединению колонок (двойная длина слоя геля) аддукты ЭО разделились бы ко! личественно ацетоном:
Пик 1:
650 мг, n = 6
Пик 2:
805 мг, n = 3
То, что эти и другие аддукты ЭО адсорбционно задерживаются при примене! нии полярного геля, вытекает из неудовлетворительного разделения. Пик 1 по молярной массе больше пика 2 на 25%, это значит, что по законам МСХ обе смеси должны быть разделены количественно.
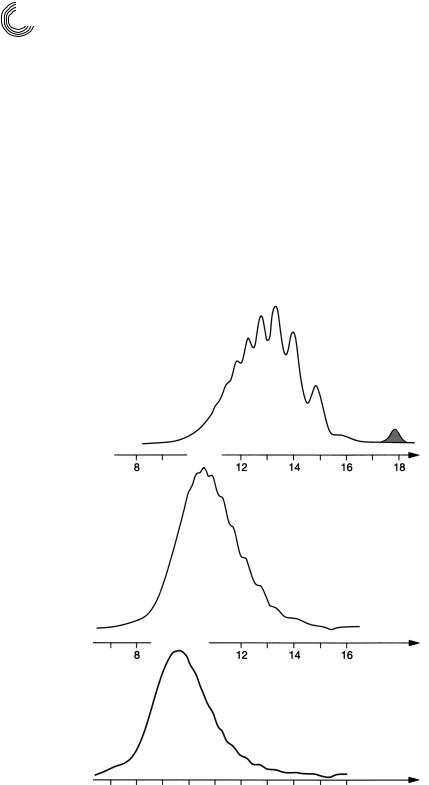
8.3.13.Мальтодекстрины
Вразделе 8.1.4 уже сообщалось об аналитическом ВЭЖХ!разделении мальто! и цел! лодекстринов. Рисунок 8.25 показывает, что такие растворимые водой смеси мож! но разделять с хорошим результатом на Сефадексе LH!20 с помощью воды в каче! стве подвижной фазы. Благодаря соединению колонок [8.2] или повторному впрыс!
Колонка: |
Сефадекс LH 20, внутр. диаметр: 25 мм |
||
Длина слоя геля: |
87 см + 2 × 187 см |
|
|
Подвижная фаза: |
вода дистиллированная |
|
|
Скорость протекания: |
2 мл/мин |
|
|
Величина пробы: |
1200 мг смеси мальтодекстрина |
||
|
(декстрин 20 фирмы Фука) |
|
|
|
|
Гекса |
|
|
|
|
Гепта |
|
|
Пента |
|
|
Три |
|
|
|
Мальтоза |
Тетра |
Высшие |
|
|
|
сахариды |
Глюкоза
ч
Рис. 8.25. Препаративное гель!хроматографическое разделение смеси мальтодек! стрина на Сефадексе LH!20, водой
