
Хенке_Жидкостная хроматография [2009]
.pdf
4.2. Эмульгаторы |
81 |
этоксилированного 1,6 гександиола, потому что в спектре не было сигнала для свободной (–ОН) группы (сложный моноэфир).
Следующим шагом для экстракта стала переэтерификация метанолом. Мета нолизат был отделен метанолом без увеличения концентрации на 6 стеклянных готовых колонках Lobar® LiChroprep RP 8, размер В. На хроматограмме, наряду
сменьшими пиками, были видны 2 главных пика. Пик 1 – это этоксилирован ный 1,6 гександиол, а пик 2 – это метиловый сложный эфир лауриновой кисло ты. Для того чтобы можно было определить степень этоксилирования, а также распределение, пик 1 разъединили метанолом (2 мл/мин) на 5 метровой Сефа декс LH 20 колонке. Хроматограмма представлена на рис. 4.23 внизу. Для сравне ния при аналогичных условиях (бумажная лента самописца была свернута) разде лили 800 мг ПЭГ 400 (полиэтиленгликоль) – см. рис. 4.23 вверху. Можно увидеть, что в этоксилате существует подобное распределение молярной массы. Доля низ комолекулярных компонентов в этоксилированном диоле больше. Пики 3…10 были изолированы и идентифицированы посредством спектра 1Н ядерной маг нитно резонансной спектроскопии и FD/масс cпектрометрии. Результат можно
увидеть на том же самом рисунке. При присоединении этиленоксида к 1,6 гек сандиолу возникают симметричные и асимметричные продукты присоединения
сидентичными молярными массами, которые в широком смысле можно назвать соединениями с изомерией положения.
4.2.1.7. Этоксилированный кокосовый жирный спирт
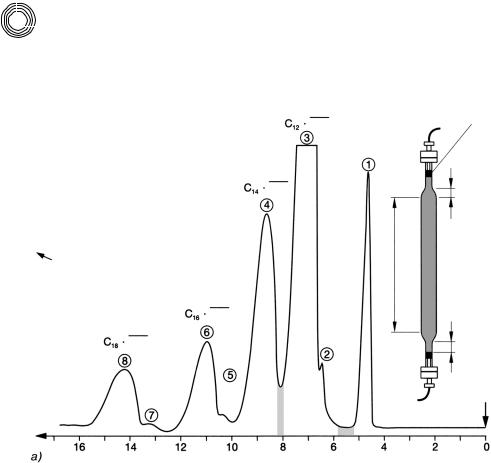
Состав этоксилированных спиртов жирного ряда может быть очень разным. Жир ные спирты могут иметь низкую или повышенную степень этоксилирования и их содержание в свободном полиэтиленгликоле (ПЭГ) или количество в неэтокси лированных видах спирта может быть также разным. На рис. 4.24 можно видеть весьма интересное разделение кокосового жирного спирта со средней степенью этоксилирования 5. Пик 1 можно идентифицировать с помощью высокоэффек
тивной жидкостной хроматографии (ВЭЖХ) как ПЭГ 200, пики 3, 4, 6 и 8 в соот ветствии со спектрами 1H ядерной магнитно резонансной спектроскопии. Уди вительно, с какой избирательностью может разделиться этоксилат жирного спирта
на ODS наполнителе колонки с помощью чистого метанола. Химическая форму
ла для пика 3 такова (см. ниже) и это касается других компонентов пробы с соот ветственно удлиненным жирным спиртом:
СН3–(СН2)10–СН2–О–(СН2–СН2–О)n–Н. n = 2…8 или n = 5
Как выглядит здесь распределение? На этот вопрос можно было бы ответить
после разделения отдельных пиков на Сефадексе LH 20 c помощью метанола или
еще лучше дихлорметана. Но не этот вопрос представляет здесь интерес. Пик 9,
как самая гидрофобная часть этоксилата, может быть элюирована дихлормета ном и идентифицирована в качестве смеси жирного спирта, состоящей из 1 доде
канола и 1 тетрадеканола. При ступенчатом элюировании с возрастающей поляр
ностью (см. раздел 5.4) в элюате дихлорметана содержалось бы 11,6%, для этого
82 |
|
Глава 4. Примеры разделения из практики |
|
|
Колонка: |
4 Kronlab*колонки (см. рис. 4.24б) |
|
|
Наполнитель колонки: |
YMC, ODS 120Å, 50 мкм (40/63 мкм) |
|
|
Подвижная фаза/скорость: |
метанол, 4,4 мл/мин |
|
|
Количество пробы: |
3000 мг кокосового жирного спирта • 5 • ЭО |
|
5ЭО |
Вставная перемычка 14 мм |
|
1200 мг
299 мг
31558 мг
4 |
543 мг |
5ЭО |
|
5 |
35 мг |
||
|
6235 мг
7 |
30 мг |
Поли* |
|
8 |
187 мг |
этилен* |
|
9 |
110 мг |
гликоль |
|
200 |
|||
|
|
Удален десорбционно с помощью СН2Cl2
380 мм
20 мм
Внутр.
диаметр 37 мм
|
5ЭО |
5ЭО |
30 мм |
|
б) Колонка для препаративной
гель*хроматографии
ч
Рис. 4.24. Препаративное разделение ЭО продукта присоединения кокосового жир ного спирта на обращенной фазе С 18 с помощью метанола. Речь идет о полярных компонентах прядильной препарации при производстве ис кусственных волокон
неразделенные этоксилированные жирные спирты элюировали бы метанолом.
Пики 1…8 – это полярные компоненты прядильной препарации для синтетичес
кого нитяного материала.
4.2.2. Сложный эфир полигликоля кислоты жирного ряда
При присоединении этиленоксида к соединениям с кислотными атомами водо рода возникают неионогенные поверхностно активные соединения, которые ис пользуются в качестве эмульгаторов в производстве искусственных волокон из полимеров, как вспомогательные материалы для фармацевтических препаратов и во многих других областях. К этим эмульгаторам причисляют также различные сложные эфиры полигликоля кислот жирного ряда.
4.2.2.1. Сложный эфир полигликоля кислоты кокосового масла
Ниже будет представлена как аналитическая, так и препаративная колоночно
жидкостная хроматография низкоэтоксилированной смеси кислоты кокосового
4.2. Эмульгаторы |
83 |
Колонка: |
4 × 250 мм |
|
Наполнитель колонки: |
гиперсил MOS, 5 |
мкм |
Подвижная фаза/скорость: |
метанол/вода 93 |
: 7, мл/мин |
Детектор: |
дифференциальный рефрактометр |
|
Количество пробы: |
25 мг этоксилата кислоты |
|
|
кокосового масла/мл подвижной фазы |
|
1 моно*, ди*, три* и тетраэтиленгликоль ≡ пики 3…6 из разделения ацетона 2 = смесь сложного моноэфира ≡ пик 2 из разделения ацетона Смесь сложного диэфира идентична с пиком 1 из разделения ацетона
на Сефадексе LH*20.
при n = 2
Смесь сложного диэфира
мин
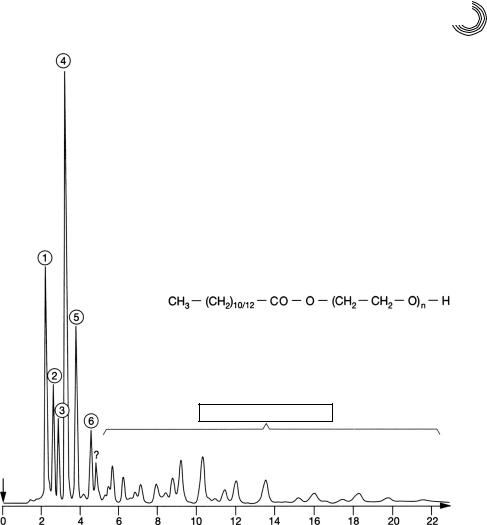
Рис. 4.25. Аналитическое разделение методом ВЭЖХ этоксилата кислоты кокосо вого масла на обращенной фазе С 8
масла. Под кислотами кокосового масла понимается смесь лауриновой и мирис тиновой кислот с большей долей додекановой кислоты. На рис. 4.25 показано ана литическое разделение методом ВЭЖХ низкоэтоксилированной смеси кислоты кокосового масла.
Можно предположить, что продукт присоединения в основном содержит лау
риновую и миристиновую кислоты (примерно 2 : 1) наряду с небольшим количе
ством пальмитиновой кислоты. Общую химическую формулу этоксилата кисло ты жирного ряда можно было бы сформулировать следующим образом:
CH3–(СН2)10/12–СО–О–(СН2–СН2–О)n–Н,
при n = 2
так как спектроскопический анализ (спектр 1H ядерной магнитно резонансной спек
троскопии) и анализ с увлажнением (расщепление йодоводородной кислотой HJ)
84 Глава 4. Примеры разделения из практики
дали среднюю степень этоксилирования 2, т. е. смесь может содержать кислоты жирного ряда с одной и тремя (–СН2–СН2–О) группами. То, что сложные эфиры полигликоля жирной кислоты, как правило, состоят из сложных моно и диэфи ров, можно было не раз установить. Поэтому вышеназванная формула сложного моноэфира нуждается в дополнении формулой сложного диэфира:
CH3–(СН2)10/12–СО–О–(СН2–СН2–О)n–Н–СО–(СН2)10/12–CH3.
при n =2
Наряду с этими двумя сложными эфирами смеси могут содержать также сво
бодные кислоты жирного ряда и свободный полиэтиленгликоль (ПЭГ).
На Сефадексе LH 20 с помощью ацетона в качестве элюента можно количествен но отделить сложные диэфиры от сложных моноэфиров и диолов, если средняя сте пень этоксилирования не выше 9, это значит, что налицо этерифицированный кислотой (тами) жирного ряда полиэтиленгликоль (PEG 400). Хроматограммы
на рис. 4.26 и 4.27 показывают препаративные гель хроматографические разделения сложного эфира полигликоля кислоты жирного ряда на «утонченных» или «утолщен ных» колонках. При этом для рис. 4.26 были выбраны следующие условия разделения:
Колонка: |
|
1 м + 2 × 2 м, внутренний диаметр 25/26 мм |
|
|
Наполнитель колонки: |
Сефадекс LH*20 |
|
||
Подвижная фаза/скорость: |
ацетон, 4 мл/мин |
|
||
Детектор: |
|
дифференциальный рефрактометр |
|
|
Количество пробы: |
|
2000 мг этоксилата кислоты кокосового масла |
|
|
1 |
сложный диэфир |
860 мг |
43% → |
R |
2 |
сложный моноэфир |
890 мг |
44,4% → |
|
3 |
тетраэтиленгликоль |
30 мг |
|
|
4 |
триэтиленгликоль |
80 мг |
12,0% |
|
5 |
диэтиленгликоль |
90 мг |
|
|
|
|
|||
6 |
этиленгликоль |
40 мг |
|
|
n = 1…4
ч
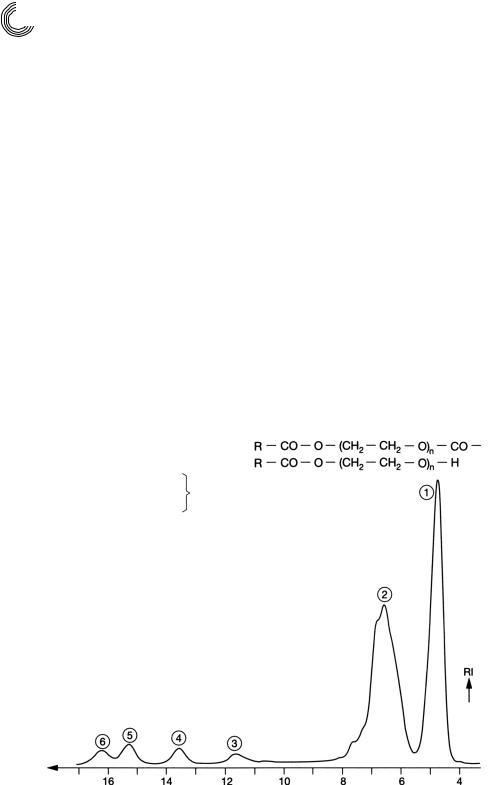
Рис. 4.26. Разделение см. рис. 4.27, здесь тонкие колонки
4.2. Эмульгаторы |
85 |
Для рис. 4.27 были выбраны следующие условия разделения:
Колонка: |
|
|
1 м + 2 × 2 м*, внутренний диаметр 70 мм |
||
Наполнитель колонки: |
|
Сефадекс LH*20 |
|||
Подвижная фаза/скорость: |
ацетон, 31,2 мл/мин |
||||
Детектор: |
|
|
дифференциальный рефрактометр |
||
Количество пробы: |
|
|
16 г этоксилата кислоты кокосового масла |
||
|
|
|
|
примерно в 100 мл ацетона |
|
1 |
сложный диэфир |
6,88 |
мг |
43% |
С коническими деталями |
и наконечниками с адаптерами |
|||||
2 |
сложный моноэфир |
7,12 |
мг |
44,4% |
длиннее 5 метров! |
3 |
тетраэтиленгликоль 0,24 мг |
|
|
||
4 |
триэтиленгликоль |
0,64 мг |
12,0% |
|
|
5 |
диэтиленгликоль |
0,72 мг |
|
||
6 |
этиленгликоль |
0,32 мг |
|
|
|
ч
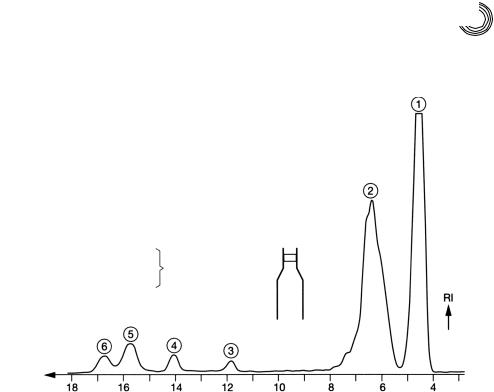
Рис. 4.27. «Макропрепаративное» гель хроматографическое разделение этоксилата кислоты кокосового масла на Сефадексе LH 20, на «утолщенных» колонках
Согласно спектру 1Н ядерной магнитно резонансной спектроскопии и инф ракрасному спектру, пик 1 – это чистая смесь сложного диэфира. Пик 2 состоит из сложных моноэфиров, причем легкое отделение как на переднем, так и на зад нем франте пика указывает на то, что налицо кислоты жирного ряда с различной степенью этоксилирования, т. е. соединения с разной полярностью. Чем более полярным является компонент смеси, тем позднее он будет элюирован ацетоном
от сильно полярного декстрангеля. Пики 3…6 могли быть идентифицированы посредством аналитической ВЭЖХ как моно бис тетраэтиленгликоль. Этот пре паративный гель хроматографический метод лучше всего подходит для того, что бы выделить количественно низкоэтоксилированные кислоты жирного ряда в два
главных компонента.
То, что препаративное разделение ацетоном на декстрангеле очень избиратель но, может быть продемонстрировано на основе аналитического разделения ВЭЖХ.
Пик 1 точно соответствует образцу пика смеси сложного диэфира, а пик 2, смесь сложного моноэфира, состоит из пиков 2…6. Пик 1 на рис. 4.25 свободный ПЭГ (полиэтиленгликоль), состоит из моно бис тетраэтиленгликоля. Здесь были
выбраны следующие условия разделения.
Сложные моноэфиры из за повышенной полярности (свободная [–H–O–] груп па) элюируют раньше, чем более гидрофобные сложные диэфиры. Самое слабо вы
раженное отставание на обращенной фазе показывают сильно полярные диолы, которые и покинут колонку неразделенными.
86 Глава 4. Примеры разделения из практики
Напрашивается следующий вывод: комбинированное разделение, сначала на Сефадексе LH 20, затем на обращенной фазе, тоже в препаративных количествах, ведет к полному разделению комплексной смеси. На декстрангеле смесь будет разделена по возрастающей полярности. То, что с помощью препаративной геле вой хроматографии можно также проводить разделения и в промышленном мас штабе с целью получения фракций сложного ди и моноэфира, легко проследить. Для этого только требуются утолщенные колонки и подходящие устройства, та кие как насос, детектор и устройство для фракционирования.
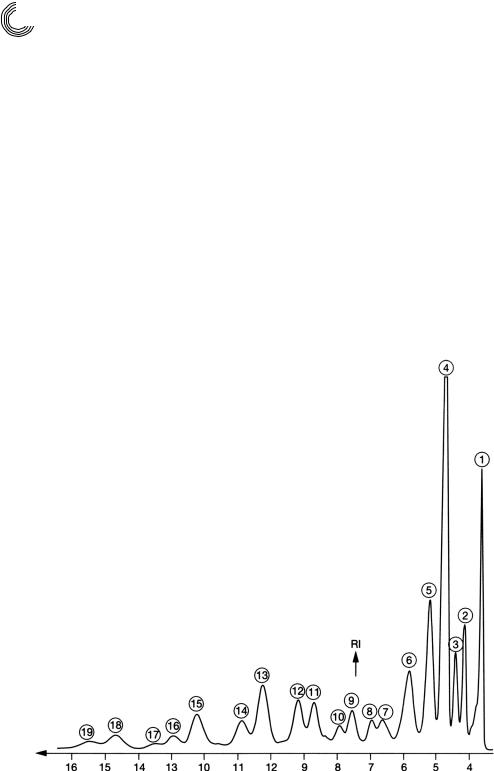
Препаративное разделение оригинальной пробы на 6 колонках Lobar® Lichroprep RP 8 чистым метанолом представлено на рис. 4.28. Для отдельных компонентов эток силата была проведена количественная оценка гравиметрически и проведена иден тификация с помощью спектров 1Н ядерной магнитно резонансной спектроскопии. Нельзя не заметить хорошего согласования между аналитическим и препаративным разделением. Были выбраны следующие условия для разделения:
Колонка: |
6 готовых стеклянных колонок Lobar®*Lichroprep*RP*8, |
|
размер В, 25 × 310 мм (фирма Мерк) |
Подвижная фаза/скорость: |
метанол, 2 мл/мин |
Количество пробы: |
1200 мг |
|
|
Вес в % |
1 |
ПЭГ (моно*, ди*, три* и тетраэтиленгликоль) |
12,5 |
2 |
Лауриновая кислота • 1 ЭО |
3,5 |
3 |
Миристиновая кислота • 1 ЭО |
2,0 |
4 |
Лауриновая кислота • 2 ЭО |
24,0 |
5 |
Миристиновая кислота • 2 ЭО |
8,0 |
6 |
Лауриновая кислота • 3 ЭО |
7,0 |
7…10 |
Не идентифицированы, согласно спектру 1Н*ядерной |
|
|
магнитно*резонансной спектроскопии |
|
|
это сложные диэфиры |
10,0 |
11 |
Сложный эфир этиленгликольдилаурила |
5,0 |
12 |
Сложный эфир этиленгликольлаурилмиристила |
5,0 |
13 |
Сложный эфир этиленгликольдимиристила |
8,0 |
14 |
Сложный эфир этиленгликольлаурилпальмитила |
3,0 |
15 |
Сложный эфир этиленгликольмиристилпальмитила |
6,0 |
16…19 |
Не идентифицированные сложные диэфиры |
|
|
с ди* и триэтиленгликолем |
6,0 |
ч
Рис. 4.28. Препаративное разделение этоксилата кислоты жирного ряда (см. рис. 4.25) на 6 стеклянных готовых колонках с помощью материала RP 8

4.2. Эмульгаторы |
87 |
4.2.2.2. Ди и моноолеат полиэтиленгликоля (ПЭГ 200)
Препаративное гель хроматографическое разделение ди и моноолеата (ПЭГ 200) на Сефадексе LH 20 c помощью ацетона дало хроматограмму, которую можно сравнить с этоксилатом кислоты кокосового масла, как на рис. 4.29а. И в этом случае этоксилат был разделен на «утолщенных» колонках (внутренний диаметр
70 мм) при сравнимой длине гелевого слоя, как передает рис. 4.29б. Метанолизат оригинальной пробы после ВЭЖХ разделения показал, что наряду с очень боль
шим количеством олеиновой кислоты, было небольшое количество миристино вой, пальмитиновой и стеариновой кислоты в составе сложного метилового эфи ра, это значит, использовалась техническая олеиновая кислота (олеин).
мг
→Дилаурат полиэтиленгликоля 300
Олеиновая
кислота
|
Слабая индикация |
ПЭГ%200 после ВЭЖХ |
ПЭГ%200 |
ч |
ч |
Рис. 4.29. Препаративное гель хроматографическое разделение ди (1) и монооле ата (2) ПЭГ 200. Сефадекс LH 20, 5 метровая колонка (1 + 2 по 2 м), внутренний диаметр 25/26 (а) или 70 мм (б)
4.2.2.3. Дилаурат полиэтиленгликоля 200
Уже после аналитического разделения методом ВЭЖХ можно было сказать, что этот образец дилаурат ПЭГ 200 делает честь своим производителям, потому что,
как правило, продукты с этим обозначением являются смесью сложных ди и мо
ноэфиров в соотношении 1 : 1 (см. раздел 4.2.2.2). Условия разделения были те же,
88 Глава 4. Примеры разделения из практики
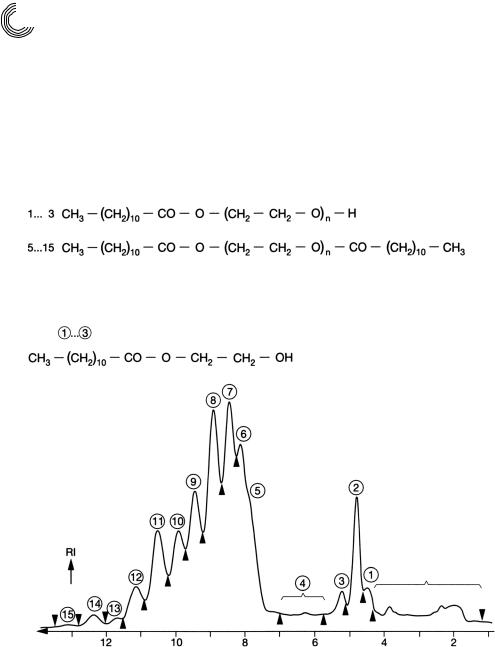
что и у сложного эфира полигликоля кислоты кокосового масла (см. рис. 4.25). И этот этоксилат был разделен метанолом в препаративных количествах на 6 Lobar® Lichroprep RP 8 колонках, размер В, с целью изолирования и идентифицирования (см. рис. 4.30). Были выбраны следующие условия разделения:
Колонки: |
6 Lobar® Lichroprep RP*8, размер В, 25 × 310 мм |
Подвижная фаза/скорость: |
метанол, 2 мл/мин |
Количество пробы: |
790 мг дилаурата PEG 200 |
Сложный моноэфир 11%
Сложный диэфир 88%
7 Сложный эфир этиленгликольдилаурила
8 Сложный эфир этиленгликольлаурилмиристила
11 Сложный эфир этиленгликольмиристилпальмитила
Пики – это полярные сложные моноэфиры с 1 • ЭО лауриновой кислоты в качестве главных компонентов (пик 2).
1 • ЭО лауриновой кислоты
3 мг |
8 мг |
|
ч
Рис. 4.30. Препаративное разделение дилаурата ПЭГ 200 метанолом на обращен ной фазе
Пики 5…15 – это различные сложные диэфиры с одинаковыми и разными кис лотами жирного ряда. Из сложных диэфиров были идентифицированы пики 7, 8 и 11 на основе их спектров 1Н ядерной магнитно резонансной спектроскопии. Ре зультат идентификации представлен на рис. 4.30. В табл. 4.3 можно найти коли
чества для отдельных пиков, которые почистили путем повторяющегося впрыс
кивания для количественной оценки и идентификации.

4.2. Эмульгаторы |
89 |
Таблица 4.3. Гравиметрическая оценка препаративного разделения
Ïèê № |
Результат взвешивания, мг |
|
Перед 1 |
8* |
|
|
|
|
1 |
14 |
|
|
|
|
2 |
60 |
11% Сложный моноэфир |
3 |
15 |
|
|
|
|
4 |
3 |
|
5 |
77 |
|
|
|
|
6 |
52 |
|
|
|
|
7 |
163 |
|
8 |
146 |
|
|
|
|
9 |
92 |
88% Сложный диэфир |
10 |
59 |
|
|
|
|
11 |
69 |
|
|
|
|
12 |
22 |
|
13 |
9 |
|
|
|
|
14 |
8 |
|
15 |
3 |
|
|
|
|
* Возможно свободные кислоты жирного ряда и свободный ПЭГ, самые полярные компо ненты смеси
На 5 метровой Сефадекс LH 20 колонке с помощью ацетона в качестве под вижной фазы (см. раздел 4.2.2.2, рис. 4.29) получают первый большой пик для смеси сложного диэфира и меньший второй пик для смеси сложного моноэфира. Оригинальная проба была переэтерифицирована метанолом и количественно раз
делена метанолом на 6 колонках Lobar® LiChroprep RP 8.
•Пик 1: cогласно ВЭЖХ cмесь из этиленгликоля и диэтиленгликоля,
•пик 2: очень много сложного метилового эфира лауриновой кислоты,
•пик 3: немного сложного метилового эфира миристиновой кислоты,
•пик 4: немного сложного метилового эфира пальмитиновой кислоты.
По результатам анализа это сложные эфиры жирных кислот этилен и диэти ленгликоля, а не сложный диэфир жирной кислоты полиэтиленгликоля (ПЭГ 200).
Препаративное разделение пробы оригинала было проведено с помощью ме танола в качестве подвижной фазы (2 мл/мин) на 6 готовых стеклянных колонках Lobar® LiChroprep RP 8, размер В, фирма Мерк. Было разделено 790 мг дилау рата ПЭГ 200. Результат представлен в табл. 4.3.
4.2.2.4. Сложный эфир полигликоля олеиновой кислоты
Обозначение «сложный эфир полигликоля олеиновой кислоты» – это суммарная формулировка, потому что такие продукты могут предствлять собой смеси из слож
ных ди и моноэфиров, свободных кислот жирного ряда, а также свободного поли этиленгликоля. Попытка разделить ацетоном этоксилат жирной кислоты на Сефа
дексе LH 20, как у ди и моноолеата ПЭГ, не увенчалась успехом, так как средняя
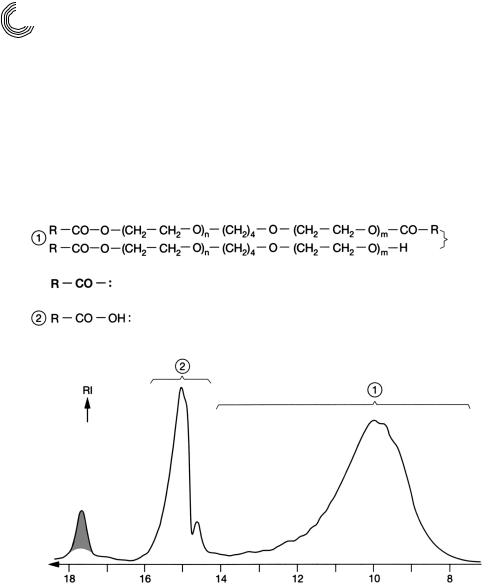
90 Глава 4. Примеры разделения из практики
степень этоксилирования должна быть больше 9. Это значит, что отщепленный ПЭГ должен иметь среднюю молярную массу > 400. Разделение проходило на Се фадексе LH 20 с помощью метанола в качестве подвижной фазы. Результат виден на рис. 4.31. Были выбраны следующие условия разделения:
Колонка: |
1 м + 2 × 2 м, внутр. диаметр 25/26 мм |
Наполнитель колонки: |
Сефадекс LH*20 |
Высота слоя геля: |
461 мм |
Подвижная фаза/скорость: |
метанол, 2 мл/мин |
Количество пробы: |
1100 мг |
900 мг
техническая олеиновая кислота, побочные компоненты: лауриновая, миристиновая и стеариновая кислота
техническая олеиновая кислота 200 мг
n + m = 13 и соответствует ПЭГ%600
Вода
ч
Рис. 4.31. Препаративное гель хроматографическое разделение сложного эфира полигликоля олеиновой кислоты метанолом на Сефадексе LH 20
После метилирования диазонметаном с помощью аналитической ВЭЖХ пик 2 нельзя было идентифицировать как техническую олеиновую кислоту. Пик 1 был этоксилатом, так как после переэтерификации метанолом на 6 Lobar® RP 8 ко лонках прошло разделение метанолом.
Отдельные пики были изолированы и идентифицированы следующим образом.
•Пик 1
Согласно спектру ВЭЖХ на обращенной фазе С 8 сравним с ПЭГ 600, но не идентичен. С помощью спектров 1Н и 13С ядерной магнитно резонансной спектроскопии был идентифицирован как этоксилированный 1,4 бутандиол.
