
Хенке_Жидкостная хроматография [2009]
.pdf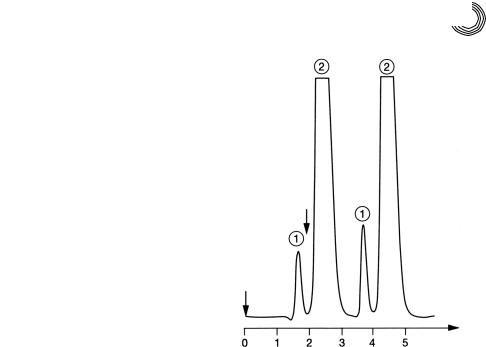
8.2. Препаративные разделения на готовых стеклянных колонках 191
Колонка: |
25 × 1000 мм/870 мм |
|
|
Подвижная фаза/ |
|
|
|
скорость протекания: |
этилацетат, 2 мл/мин |
|
|
Детектор: |
дифференциальный рефрактометр |
||
Проба: |
|
800…1000 мг экстракта |
|
|
|
в 40 мл элюента |
|
1 е впрыскивание = проба А |
|
||
Пик 1 |
Диглицерид |
7% |
|
Пик 2 |
Моноглицерид |
93% |
|
2 е впрыскивание = проба В |
Проба В |
||
Пик 1 |
Диглицерид |
8,5% |
|
Пик 2 |
Моноглицерид |
91,5% |
|
Проба А
ч
Рис. 8.6. Препаративное разделение технического моностеарата глицерина на Се! фадексе LH !20 с помощью этилацетата пробы А и пробы В
Оценка обоих пиков проводилась после удаления подвижной фазы путем гра! виметрии, а это значит, что были получены очень точные значения.
1 е впрыскивание = проба А |
|
|
Пик 1 |
Диглицерид |
7% |
Пик 2 |
Моноглицерид |
93% |
2 е впрыскивание = проба В |
|
|
Пик 1 |
Диглицерид |
8,5% |
Пик 2 |
Моноглицерид |
91,5% |
8.2.2. Метанолизат сложных эфиров полигликоля кислоты кокосового масла
Метанолиз и последующее препаративное разделение продуктов переэтерифика! ции (см. рис. 8.7) послужили, как это часто бывает, идентификации и количе! ственной оценке жирных кислот в виде сложных метиловых эфиров и таковых полиэтиленгликоля. Возникает вопрос, какие преимущества предлагает это пре! паративное разделение. В основном оно служит для того, чтобы разделить диоло!
вые компоненты и затем их идентифицировать посредством ВЭЖХ!хроматограм!
мы или ГХ, если возможно. Тем самым получают количества жирных кислот в
виде сложных метиловых эфиров, вплоть до смеси пальмитин!олеиновой кислот
(пик 6 на рис. 8.7). Для того чтобы определить компоненты метанолизата напря! мую с помощью ВЭЖХ, на ОФ!материалах требуется второе разделение. Для ком!
понентов ПЭГ требуется много воды в метаноле, для сложного метилового эфира
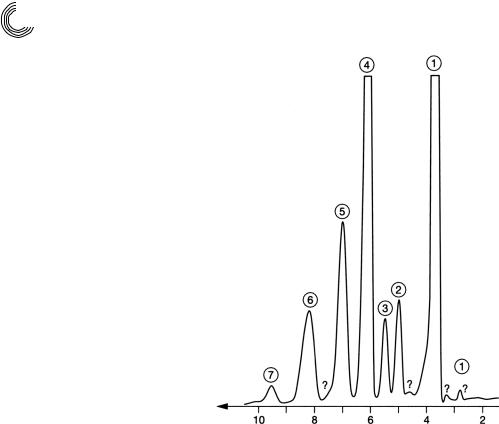
192
 Глава 8. Аналитические и препаративные разделения
Глава 8. Аналитические и препаративные разделения
Колонка: |
6 стеклянных готовых колонок |
|
Lobar® LiChroprep® RP С 8, |
|
25 × 310 мм (фирма Мерк), |
Подвижная фаза/ |
метанол, |
скорость протекания: |
2 мл/мин |
Проба: |
1157 мг метанолизата |
2 сложных метиловых эфира = более широкий пик
Перед
ч
Рис. 8.7. Препаративное разделение метанолизата сложных эфиров полигликоля кислоты кокосового масла (среднее значение ЭО = 2) на ОФ!материале с помощью метанола
жирной кислоты значительно больше метанола, чем воды. Следующие условия разделения привели к нижеследующим результатам.
|
|
ìã |
% |
|
|
|
|
Перед 1 идентификация не проводится |
3 |
0,2 |
|
|
|
|
|
1 моно-, ди-, три- и тетраэтиленгликоль |
400 |
34,5 |
|
2 |
сложный метиловый эфир каприловой кислоты |
25 |
2,1 |
|
|
|
|
3 |
сложный метиловый эфир каприновой кислоты |
45 |
3,9 |
4 |
сложный метиловый эфир лауриновой кислоты |
390 |
33,7 |
|
|
|
|
5 |
сложный метиловый эфир миристиновой кислоты |
151 |
13,0 |
|
|
|
|
6 |
сложный метиловый эфир пальмитиновой и олеиновой кислоты |
111 |
9,6 |
7 |
сложный метиловый эфир стеариновой кислоты |
20 |
1,7 |
|
|
|
|
8.2.3. Технический саркозид олеиновой кислоты
Саркозиды или сарконизаты – это анионоактивные вещества, которые образуются в результате конденсации жирных кислот с N!метилглицином (саркозином). Это
чувствительные к высоким температурам тензиды, которые используются также в прядильных препарациях для изготовления искусственных волокон. После мети!

8.2. Препаративные разделения на готовых стеклянных колонках 193
Колонка: |
6 стеклянных готовых колонок |
|
|
Lobar® LiChroprep RP С 8, размер В |
|
Подвижная фаза/скорость протекания: |
метанол, 2 мл/мин |
|
Проба: |
технический олеиловый саркозид, |
|
|
несвязанная кислота (аркомон SO) |
|
Величина пробы: |
1032 мг технического сложного |
|
|
метилового эфира олеилсаркозида |
|
|
657 мг |
215 мг |
Диазометан
Линолевые и другие не идентифицированные ненасыщенные саркозиды жирной кислоты в виде сложного метилового эфира
Сложный метиловый эфир олеилсаркозида
и: не идентифицированы!
53 мг |
25 мг |
|
|
|
41 мг |
|
22 мг |
14 мг
ч
Рис. 8.8. Разделение бóльших количеств технического саркозида олеиновой кисло! ты на ОФ материале метанолом
лирования безводной пробы эфирным раствором диазометана техническая смесь была разделена в препаративных количествах (см. рис. 8.8) на стеклянных готовых колонках фирмы Мерк и на основе 1Н!ЯМР!спектров можно было надежно иден! тифицировать компоненты. Результат и условия разделения можно получить из
названного рисунка. Разделить оригинальную пробу на ОФ!материале было бы сме!
лым и тяжелым делом, так как ионогенные соединения элюируются независимо от типа подвижной фазы. Если существуют такие или подобные соединения в виде солей щелочных, то катионы надо было бы заменить Н!ионами перед метилировани! ем на ионнообменнике. Были выбраны следующие условия разделения (см. рис. 8.8).
8.2.4. Экстракт полиэфирных волокон
Из хроматограммы на рис. 8.9 видно, что экстракты волокон можно разделить на
их составные части непосредственно на материалах ОФ С!8, хотя такие экстрак! ты, как правило, представляют собой комплексную смесь веществ (см. гл. 5, осо! бенно раздел 5.4). Были выбраны следующие условия разделения:

194
 Глава 8. Аналитические и препаративные разделения
Глава 8. Аналитические и препаративные разделения
|
275 мг |
R: додецил |
246 мг |
|
423 мг |
Молярное соотношение: x + y > z
ч
Рис. 8.9. Препаративное разделение экстракта полиэфирных волокон на материа! ле ОФ С!8
Колонка: |
4 стеклянных готовых колонки |
|
Lobar®!LiChroprep!RP С!8, размер В |
Подвижная фаза/ |
метанол/вода: |
скорость протекания: |
95 : 5, 3 мл/мин |
Величина пробы: |
950 мг экстракта волокна |
Это еще один типичный пример того, что на гидрофобированном силикагеле можно разделять соединения по убывающей полярности. Сульфированный слож! ный эфир янтарной кислоты элюируют перед этоксилированным додецилфено!
лом, и сополимернный аддукт ЭО/ПО сильнее всего замедляется на ОФ!матери!
але благодаря более высокой доле звеньев пропиленоксида.
8.2.5. Экстракт полиамидных волокон
Следующий пример быстрого, прямого и количественного разделения волокон!
ного экстракта представлен на рис. 8.10. Простой состав остаточной прядильной препарации нетрудно распознать, так как она состоит только из сложного эфира полигликоля жирной кислоты и несвязанного ПЭГ. Пик 1, как это часто бывает,
идентифицирован с помощью ВЭЖХ как ПЭГ!600.
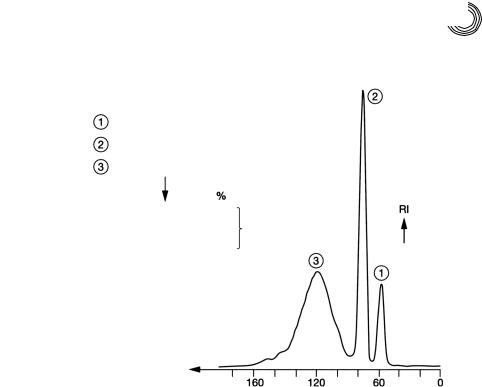
8.2. Препаративные разделения на готовых стеклянных колонках 195
Колонка: |
2 Lobar® LiChroprep RP С 8, размер В |
Подвижная фаза/расход: |
метанол/вода: 97 : 3,1 мл/мин |
Величина пробы: |
258 мг экстракта |
Несвязанный ПЭГ 600 |
|
15 мг |
|
Капролактамовые олигомеры |
50 мг |
||
Аддукт этиленоксида жирной кислоты |
218 мг |
||
Миристиновая кислота |
.....15 |
|
|
Пальмитиновая кислота .....15 |
к ПЭГ 600 |
|
|
Стеариновая кислота |
.....15 |
|
|
мин
Рис. 8.10. Препаративное разделение экстракта полиамидных волокон
Капролактамовые олигомеры были идентифицированы с помощью ИК!спек! тров. Смесь сложного эфира полигликоля жирной кислоты была переэтерифи! цирована метанолом, как уже описано, разделена препаративно и идентифици!
рована. Были выбраны следующие условия разделения (см. рис. 8.10).
8.2.6. Реакционная смесь (1977)
Даты, здесь и в других разделах, в скобках указывают на то, что отдельные разделения и определения уже «старые», но они ничего не утратили в своей актуальности.
При изготовлении дикарбоновых кислот из кислот жирного ряда возникает
реакционная смесь, в которой в основном содержатся исходное вещество и жела!
емый конечный продукт. Ниже следуют описание и результат разделения с помо! щью выбранных условий:
Колонка: |
2 готовые стеклянные колонки |
|
|
Lobar®!LiChroprep!RP С!8, размер В (25 × 310 мм) |
|
Подвижная фаза/ |
|
|
скорость протекания: метанол, 2 мл/мин |
|
|
Детектор: |
дифференциальный рефрактометр |
|
Проба: |
1 257 мг реакционной смеси в 20 мл метанола |
|
Пик 1: |
СН3О–СО–(СН2)7–СН=СН–(СН2)7–СО–ОСН3 |
с 450 мг |
Пик 2: |
СН3–(СН2)–СН=СН–(СН2)7–СО–ОСН3 |
с 802 мг |
Разделение до выхода на нулевую линию (R2,1 > 1,5) было закончено через 180 мин.

196
 Глава 8. Аналитические и препаративные разделения
Глава 8. Аналитические и препаративные разделения
8.3. Препаративная гелевая хроматография
На следующих примерах разделения будет показано, насколько успешно могут при! меняться гели Сефадекс!LH!20 и G!10 для препаративных разделений различных низкомолекулярных смесей веществ (молекулярный вес <1000). Сефадекс LH!20 и как наполнитель колонок обладает универсальными качествами и позволяет ис! пользовать чистые растворители в качестве подвижной фазы. Липофильный (L) и гидрофильный (Н) характер Сефадекса LH!20 делают декстрангель, как наполни! тель колонок, многогранным в применении, так как подвижная фаза, которая од! новременно служит средой для набухания, может быть органическим растворите! лем разной полярности, как, например, метанол, ацетон, этилацетат и дихлорме! тан, или используют просто чистую воду.
С помощью воды можно осуществлять также интересные разделения, кото! рые не всегда происходят только по убывающему молекулярному весу. И при ис! пользовании Сефадекса G!10 разделения не ограничиваются только молекуляр! но!ситовой хроматографией (МСХ), так как из водной окружающей среды тоже можно проводить селективные адсорбционные разделения (2).
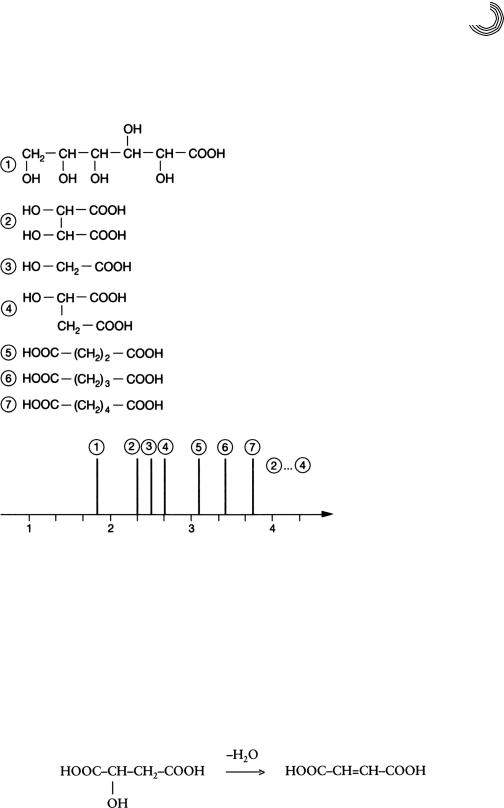
8.3.1. Разделение алифатических гидрокси и дикарбоновых кислот (1976)
Сложную смесь, состоящую из глюконовой, винной, гликолевой, яблочной, а так! же янтарной, глютаровой и адипиновой кислот, можно разделить в перпаратив!
ных количествах на гидроксипропилированном декстрангеле Сефадекс LH!20 с помощью дистиллированной воды в качестве подвижной фазы. Разделение про! исходит не только по убывающей молекулярной массе благодаря обратному си! товому эффекту, как изображает рис. 8.11. Адсорбционные эффекты тоже играют роль (см. пик 3 и 4) как и убывающая растворимость в воде, которая, в конце концов, также уравнивает запаздывание. Последнее относится в основном к ян!
тарной, глютаровой и адипиновой кислотам. Сравнение времени элюирования
тоже говорит за это, так как разница в молекулярной массе составляет только 1,5%, а не привычные 10%, которые необходимы в «классической» гелевой хроматогра! фии для разделения по убывающей молекулярной массе. Были выбраны следую!
щие условия разделения:
Колонка: |
1,3 × 145 см |
Высота слоя геля: |
140 см |
Подвижная фаза/скорость протекания: |
вода дистиллированная, 1 мл/мин |
8.3.2. Алифатические кислоты (1974)
Разделение яблочной, малеиновой и акриловой кислот, пик 1…3, может быть про! ведено на Сефадексе LH!20 дистиллированной водой в препаративных количе! ствах. Были выбраны следующие условия:
Слой геля: |
13 × 1400 мм |
Подвижная фаза/расход: |
вода дистиллированная, 2 мл/мин |
8.3. Препаративная гелевая хроматография 197
Колонка: |
1,3 × 145 см |
Высота слоя геля: |
140 см |
Подвижная фаза/скорость протекания: |
вода дистиллированная, 1 мл/мин |
ММ 196 глюконовая кислота
ММ 150 винная кислота
ММ 76 гликолевая кислота
ММ 134 яблочная кислота
ММ 118 янтарная кислота
ММ 132 глютаровая кислота
ММ 146 адипиновая кислота
: полуколичественное разделение,
30…40 мг/кислота иначе разделение до нулевой линии!
ч
Рис. 8.11. Препаративное гель!хроматографическое разделение алифатической гид! рокси! и дикарбоновой кислот на Сефадексе LH!20 в воде
Пик 1 |
105 мг, R2,1 > 2,0 |
Пик 2 |
95 мг, R3,2 > 1,5 |
Пик 3 |
123 мг |
АЛИФАТИЧЕСКАЯ СМЕСЬ КИСЛОТ
Эта смесь возникает из яблочной кислоты в присутствии оксидов сурьмы малеи! новой и акриловой кислот. Сначала образуется малеиновая кислота путем дегид! ратации яблочной кислоты:
198
 Глава 8. Аналитические и препаративные разделения
Глава 8. Аналитические и препаративные разделения
и последующее декарбоксилирование малеиновой кислоты ведет к акриловой кислоте:
8.3.3. Экстракт этилацетата
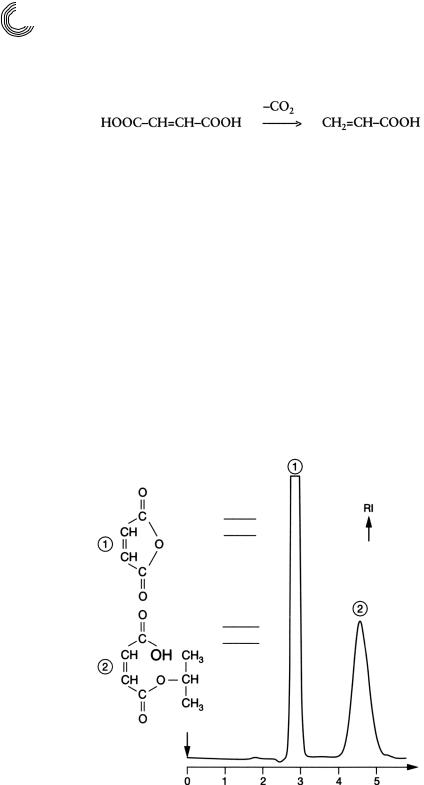
Использование одной и той же жидкости в качестве экстрагента и подвижной фазы может служить только преимуществом. Для препаративного разделения у экст!
ракта повышают концентрацию на ротационном испарителе или путем дистил! ляции, это зависит от летучести разделяемого соединения. На подходящем на! полнителе колонки разделение проводят экстрагентом в качестве элюента. В дан!
ном случае экстракт ацетата из гранулята полимера разделили количественно с помощью этилового эфира уксусной кислоты (этилацетата) на Сефадексе LH!20 (см. рис. 8.12). Смесь, состоящую из малеинового ангидрида (пик 1) и сложного моноэфира изопропила малеиновой кислоты (пик 2), можно было бы разделить также количественно уже на высоте слоя геля в 30 см менее чем за 2 часа. Были выбраны следующие условия разделения:
Колонка: |
25 × 1000 мм |
|
Высота слоя геля: |
870 |
мм |
Подвижная фаза/ |
этилацетат, |
|
скорость протекания: |
2 мл/мин |
|
Величина пробы: |
820 |
мг экстракта этилацетата |
ММ 98
548мг
ММ158
270 мг
ч
Рис. 8.12. Препаративное гель!хроматографическое разделение экстракта этилацетата
8.3. Препаративная гелевая хроматография 199
|
|
|
мг |
|
|
|
|
Этиленоксид (ЭО) • 5 • спирта кокосового масла |
609 |
||
Полидиметилсилоксан |
1275 |
||
Аддукт ЭО жирного спирта |
445 |
||
Элюат метанола остаточной прядильной препарации = экстракт волокна!
ч
ч
Рис. 8.13. Разделение полярных компонентов прядильной препарации для синте! тического волоконного материала
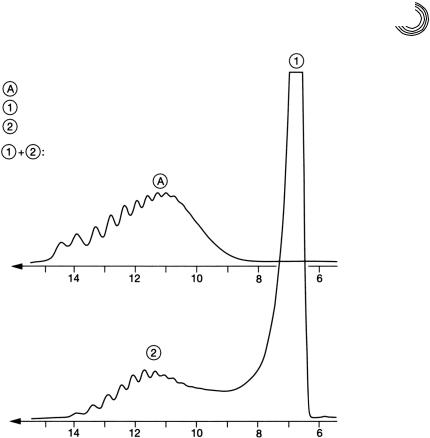
8.3.4.Полярные компоненты прядильной препарации
Осоставе полярных составляющих прядильной препарации для синтетического
нитяного материала подробно уже сообщалось (см. раздл 5.4.4.4). Данная смесь, пик 1 и пик 2 на рис. 8.13, была количественно разделена на 5!метровом стандартном колоночном наборе с Сефадекс!LH!20 (1 м + 2,2 м, внутренний диаметр 25/26 мм) метанолом (2 мл/мин).
Идентификация обоих пиков проводилась на основе 1Н!ЯМР!спектров. Для срав!
нения с полигликолем кислоты жирного ряда (пик 2) использовали имеющийся в продаже спирт кокосового масла со средней степенью этоксилирования 5. При иден! тичных условиях разделения кривая элюирования стандарта была записана на том же самом колоночном наборе после перемотки назад ленты самописца поверх кри! вой элюирования смеси. Легко заметить, что оба этоксилата спирта жирного ряда
близки как по средней молекулярной массе (ММ), так и по ширине распределения.
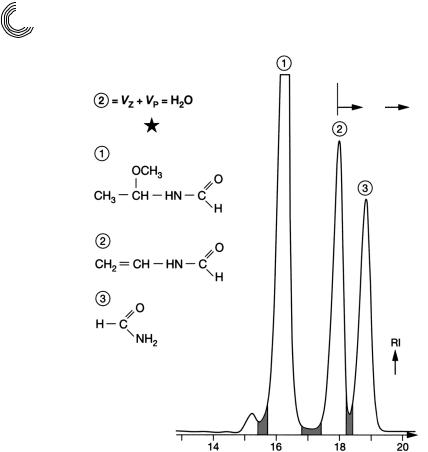
8.3.5.Продукт реакции
Хроматограмма на рис. 8.14 показывает, насколько просто и тем не менее эффек! тивно можно выделить ценный продукт N!винилформамид из смеси с помощью
200
 Глава 8. Аналитические и препаративные разделения
Глава 8. Аналитические и препаративные разделения
Vадсорбц.
121 мг
ММ 103 562 мг
210 мг
ММ 71
ММ 45
Остаток: 60 мг
Ценный продукт
ч
Рис. 8.14. Препаративное разделение N!винилформамида и формамида на Сефа! дексе LH!20
чистого метанола. Пик 1 и пик 2 – это чувствительные к воде вещества, т. е. для разделения требуются безводные подвижные фазы. Указание: пик 2 = Vz + Vp = Н2О должен показать, что N!винилформамид испытывает значительное запаздывание.
Соединения элюируются по убывающей молекулярной массе, иначе они претер!
певают адсорбционное замедление. Вторая возможность для выделения ценного продукта в еще больших количествах состоит в удалении пика 1 путем дистилля! ции. В заключение N!винилформамид и формамид могут быть разделены коли! чественно на декстрангеле ацетоном [8.1].
8.3.6. Метанолизат ко эмульгатора
Продукт, имеющийся в продаже, N,N’!бис!(2!гидроксиэтил)!5,5!диметилгиданто! ин!ди!«лаурат», среди прочего, используется в качестве ко!эмульгатора в прядиль! ных препарациях для изготовления искусственных волокон. Ко!эмульгаторы под! держивают или дополняют свойства эмульгаторов. Технические сложные эфиры
жирных кислот, как мы уже наблюдали в других случаях, это смеси, потому что для
этерификации одно! и многоатомных спиртов, как правило, применяются техни! ческие, т. е. не чистые, кислоты жирного ряда. В данном случае на техническое ка!
