
- •II часть
- •1.Миниатюризация
- •1.1.Мотивация проведения исследований в области нт
- •1.2.Планы и стратегия развития
- •1.3.Границы изменения масштабов
- •1.4.Связь размеров структур с их функциональностью
- •1.4.1.Распределение атомов и связанные с этим свойства
- •1.4.2.Отношения величина - свойства
- •4 Связь размеров структур с их функциональностью
- •2.1.Введение
- •2.2.Биологические строительные блоки
- •2.2.1. Размеры строительных блоков и наноструктуры
- •2.2.2.Основные объекты нанобиотехнологии
- •2.2.3.Строительные блоки.Синтетические и биологические.
- •2.3.Принципы самосборки
- •2.3.1.Нековалентные взаимодействия
- •2.3.2.Межмолекулярная упаковка
- •2.3.3.Биологическая самосборка
- •2.4.1.Самосборка (Другой источник информации): Понятия и определения
- •2.4.2.Типы межмолекулярных взаимодействий
- •2.4.3.Измерение свойств веществ в наномировом масштабе.
- •3.Нанобиотехнология
- •3.1.Проблемы определения используемых понятий
- •3.2.Технологии типа от нано к био
- •3.3.Технологии типа от био к нано
- •3.4.Нанобиотехнология и молекулярные устройства
- •3.4.1.Общие вопросы
- •3.1. Основные направления развития биотехнологии
- •3.4.2. Молекулярные устройства.3.4.2.1. Общие вопросы
- •3.4.2.2.Молекулярные пинцеты
- •4.4.2.3.Ротаксаны и катенаны
- •4.4.2.4.Вращательное движение
- •4.4.2.5.Возвратно-поступательное движение
- •4.4.2.6.Схемы сборки путем нанизывания кольцевых молекулярных
- •4.Биотехнология, медицина и здравоохранение
- •4.1. Состояние исследований и разработок
- •4.2. Цели, проблемы и решения
- •4.3. Инфраструктура, стратегия и приоритеты
- •4.4. Достижения и новые парадигмы
- •4.4.1. Изучение особенностей биологических систем
- •4.4.2. Нанонаука и нанотехнология в процессах создания биологических тканей (тканевая инженерия)
- •4.4.3. Биологическое детектирование боевых отравляющих веществ
- •4.4.4. Флуоресцентные биологические метки на основе полупроводниковых нанокристаллов
- •4.5.5. Нанотехнология изготовления днк-чипов
- •4.5.Иомиметические нанотехнологии
- •4.5.1. Днк как строительный материал нанотехнологий
- •4.5.1.1. Направленная сборка с помощью днк
- •4.5.1.2. Днк как шаблон для молекулярной электроники
- •4.5.1.3. Моторы и наномашины на основе днк
- •4.5.2.1. Действие биологических моторов
- •4.5.2.2. Биологические моторы как часть синтетических систем
- •4.5.3. Искусственный фотосинтез
- •4.7. Использование наноустройств в космических исследованиях
- •5.2.1.Основные технические характеристики микроскопа "supra 60vp"
- •5.3. Сканирующая зондовая микроскопия
- •5.3.1. Общие принципы сканирующей зондовой микроскопии
- •5.4.Сканирующая зондовая микроскопия
- •5.5.Сканирующая туннельная микроскопия
- •5.7.Атомно-силовые измерения в биологических системах
- •6. Технология рекомбинантных днк
- •6.1.Векторы для Escherichia coli
- •6.2.Идентификация клонированных днк
- •6.3.Экспрессия эукариотических белков в е. Coli
- •6.4. Генетическая инженерия с участием других клеток-хозяев
- •6.5.Получение инсулина на основе методов генетической инженерии
- •6.6.Синтез соматотропина
- •6.7.Получение интерферонов
- •6.8.Генная инженерия растений
- •6.8.1.Получение трансгенных растений
- •6.8.1.6.Применение методов генетической инженерии для улучшения аминокислотного состава запасных белков растений
- •6.8.1.7.Повышение эффективности процесса фотосинтеза
- •6.8.1.8.Генно-инженерные подходы к решению проблемы усвоения азота
- •6.8.1.9.Устойчивость растений к фитопатогенам
- •6.8.1.10.Устойчивость растений к гербицидам
- •6.8.1.11.Устойчивость растений к насекомым
- •6.8.1.12.Устойчивость растений к абиотическим стрессам
- •6.9.1.Типы питания микроорганизмов
- •6.9.2.Типы энергетического обмена у микроорганизмов
- •6.9.3.Питательные среды для культивирования микроорганизмов
- •6.9.4.Источники углерода
- •6.9.5.Источники азота
- •6.9.6.Источники витаминов, гормонов и микроэлементов
- •6.9.7.Биохимические и биофизические факторы роста
- •6.9.8.Конструирование питательных сред для выращивания микроорганизмов
- •6.9.9.Технология приготовления питательных сред
- •6.9.10.Пастеризация как вариант термической стерилизации
- •6.9.11.Стерилизация фильтрацией
- •6.9.12Особенности культивирования эукариотических клеток в качестве продуцентов.
- •10. Что такое паспорт культуры?
- •1. Каковы причины введения международных правил в фармацевтическую практику?
- •9. Экобиотехнология
- •9.1. Введение
- •9.2. Состояние исследований и разработок
- •9.3. Цели, проблемы и решения
- •9.4. Инфраструктура, стратегия и приоритеты
- •9.5. Достижения и новые парадигмы
- •9.6.Биотехнология утилизации твердых отходов.
- •9.6.1. Биотехнология утилизации твердых отходов
- •9.6.2.Биотехнология очистки сточных вод
- •9.7.Биоэнергетика
- •9.8. Ксенобиотики и их биодеградация
6.3.Экспрессия эукариотических белков в е. Coli
Первыми примерами успешного применения генетической1 инженерии в биотехнологии были синтезы ряда ценных белков-эукариот в клетках Е. coli. В этом разделе мы прежде всего-рассмотрим методы получения генов, пригодных для экспрессии1 эукариотических белков, затем обсудим требования, предъявиляемые к вектору экспрессии, и завершим раздел рядом замечаний, касающихся проблем скрининга продуктов экспрессии генов, а также устойчивости генов и соответствующих белков.
Нетрудно понять, что прямая экспрессия генов эукариот Е. coll связана с одним принципиальным препятствием. Прокариоты вообще и Е. coll в частности не обладают биохимическим механизмом, способным осуществлять сплайсинг РНК. Поэтому эукариотический ген, включенный непосредственно в Е. coll (при условии рассматриваемой ниже соответствующей бактериальной регуляции экспрессии), не будет нормально экс-прессироваться. В Е. coll будут транслироваться последовательности интронов эукариотического гена мРНК и синтезирующийся полипептид в общем случае будет резко отличаться от нормального эукариотического белка.
Очевидно, нам нужно каким-то образом приготовить бактериальный ген, отвечающий эукариотическому белку, т. е. такой ген, который содержал бы только нуклеотидную последовательность, кодирующую первичную структуру белка, и не имел бы ни одного интрона. Эта цель может быть достигнута двумя принципиально различными путями. Один из них сводится к химическому синтезу заданной нуклеотидной последовательности. Хотя здесь мы не можем углубляться в детали химического синтеза генов (интересующийся этой проблемой читатель может найти все необходимые сведения в литературе), все же необходимо подчеркнуть, что синтетическая химия ДНК пока еще не позволяет осуществлять прямой синтез всего гена. Обычно синтезируют олигонуклеотиды с частично перекрывающимися последовательностями, которые обладают способностью к самосборке в полную двухцепочечную нуклеотидную последовательность за счет образования водородных связей в парах оснований. В качестве примера на рис. 6.3 приведен ген, кодирующий последовательность 21 аминокислотного остатка цепи А инсулина человека; этот ген был собран из 12 различных олигодезоксирибонуклеотидов, построенных из 10—15 нук-леотидных остатков. При планировании синтеза гена следует принимать во внимание и ряд других требований, связанных с клонированием и экспрессией, в том числе свойства кодонов, отсутствие сигналов терминации, наличие сайтов рестрикции.
Возможность химического синтеза генов или их фрагментов создает базу для чрезвычайно перспективной области белковой инженерии. В принципе уже сейчас мы можем заменить любую аминокислоту в белке, с тем чтобы попытаться повысить биологическую активность или технологическую устойчивость данного белка. Более того, мы можем заставить клетку синтезировать новые (или, во всяком случае, неизвестные нам) аминокислотные последовательности и таким путем создавать новые катализаторы, лекарственные препараты и компоненты пищевых продуктов. К сожалению, в настоящее время мы знаем так мало о связи между первичной структурой и функцией белков, что возможности улучшения свойств белков путем их модификации пока что остаются практически нереализованными.
В другом пути получения бактериального гена, соответствующего эукариотическому белку, исходят из зрелой эукариоти-ческой матричной РНК, уже прошедшей стадию сплайсинга.

РИС. 6.3. Ген, отвечающий цепи А инсулина человека (аминокислотная последовательность приведена в верхней части рисунка). Этот ген был синтезирован из 12 олигодезоксирибонуклеотидов Ai—А12. [Воспроизведено из статьи; Crea R., Kraszewski A., Hirose Т., Itakura К., Chemical Synthesis of Genes for Human Insulin, Proc. Natl. Acad. Sci. (USA), 75, 5765 (1978).]
Как схематично показано на рис. 6.4, соответствующая необходимому белку мРНК сама может выполнять роль матрицы, на которой особый фермент, обратная транскриптаза, может синтезировать комплементарную цепь ДНК. Цепи мРНК и ДНК затем разделяют, на цепи ДНК с помощью ДНК-полимеразы строят комплементарную цепь, после чего специфическим ферментом нуклеазой S1 отщепляют небольшой петлевой одноце-почечный участок. В результате образуется молекула двухцепо-чечной комплементарной ДНК (кДНК). К последней, как показано на рис. 6.4, с помощью концевой трансферазы присоединяют гомополимерные последовательности дезоксицитидина (dC). Таким путем создаются предпосылки для последующего клонирования, предпочтительно с плазмидным вектором pBR322, расщепленным рестриктазой Pstl и имеющим гомополимерные последовательности (dG).
Для эффективной экспрессии структурному гену должны предшествовать нуклеотидные последовательности, обеспечивающие инициацию транскрипции (промотирующая последовательность) и начало трансляции (связывающий рибосому сайт и стартовый кодон); за структурным геном должен следовать терминирующий кодон, означающий прекращение трансляции, и ^терминатор транскрипции (вспомните рис. 6.6). В векторы экспрессии входят все эти регуляторные последовательности, участок начала репликации, а также по меньшей мере один мар-1кер селекции. С помощью клонирования и синтетическими ме-^тодами получено большое число регулирующих экспрессию по-

РИС.6.4. Схема синтеза двухцепочечной ДНК с нуклеотидной последовательностью,комплементароной нуклеотидной последовательности молекулы мРНК (волнистая линия). В результате синтеза получают пригодную для клонирования молекулу комплементарной ДНК (кДНК)
ледовательностей, пригодных для включения в векторы экспрессии. Чаще других используются промоторы lac, trp и Xpz..
Как правило, желательно, чтобы применяющийся промотор был регулируемым, т. е. включался только при каком-либо изменении параметров среды, например при добавлении индуктора, инактивации репрессора или при изменении температуры. В хорошо отработанной системе экспрессии содержание белка, отвечающего клонированному гену, может достигать 70% от всех клеточных белков, хотя обычно эта величина составляет от 10 до 25%. Поскольку продукт экспрессии не выполняет никакой полезной для клетки-хозяина функции, столь серьезное отвлечение биосинтезирующего аппарата клетки на синтез не-
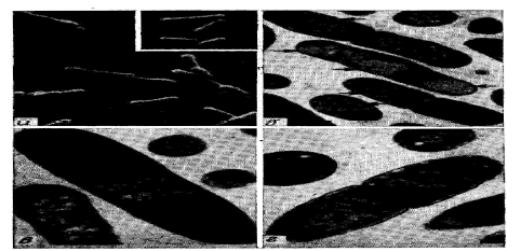
РИС.6.5. а- электронная сканирующая микротография рекомбинантных

нужных клетке белков может сказаться на скорости роста клеток и даже на их жизнеспособности. Поэтому в практической работе, как правило, условия культивирования в реакторе меняют таким образом, чтобы сначала экспрессия клонированного гена была практически подавлена и обеспечивался в основном быстрый рост клеточной массы вплоть до достижения необходимой плотности клеток, а затем с максимальной скоростью осуществлялась бы экспрессия.
Когда в Е. coli концентрация чужеродных белков достигает высокого уровня, они аккумулируются в клетке в виде плотных образований (рис. 6.5). Последние представляют собой главным образом чужеродный белок, но содержат и небольшие количества бактериальных белков, причем чужеродный белок обычно находится в денатурированном состоянии и клетки, содержащие плотные образования, часто имеют искаженную форму. Поэтому, хотя высокая концентрация белка в той или иной степени облегчает процессы выделения, его дальнейшая стабилизация и превращение в активную форму обусловливают необходимость дополнительных технологических стадий.
Конечная продуктивность рекомбинантной культуры может лимитироваться обусловленной тем или иным фактором нестабильностью белка. Бактерия Е. coli содержит внутриклеточные протеазы, способные каким-то образом узнавать небольшие аномальные белки и разрушать их. В обычных клетках эти протеазы выполняют полезную функцию, разрушая ошибочно синтезированные белки до аминокислот, которые затем могут вновь использоваться для синтеза белков; в рекомбинантных системах подобные протеазы могут быстро расщепить весь чужеродный для клетки белок. Для повышения устойчивости последнего часто методами генной инженерии синтезируют гибридный белок, состоящий из белка Е. coli, к которому (как правило, к С-концу) присоединен чужеродный белок. Такой подход применялся для стабилизации ряда относительно небольших полипептидов, в том числе соматостатина (14 аминокислот), цепей А (21 аминокислота) и В (30 аминокислот) инсулина человека. В этих случаях роль соединительного звена между белковым фрагментом Е. coli и пептидом человека выполнял остаток ме-тионина; при последующей обработке бромцианом, расщепляющим полипептидные цепи по остаткам метионина, образовывался активный пептид человека. (К счастью, ни один из перечисленных полипептидов не содержал остатков метионина!)
На рекомбинантных популяциях могут сказываться две различные формы генетической нестабильности. Во-первых, определенная часть вновь образующихся клеток может не содержать плазмид. В этом случае благодаря так называемой сегрегационной неустойчивости не несущие плазмид клетки могут подавлять рост содержащих плазмиды продуктивных клеток, если только система не находится под давлением отбора. Однако даже под давлением отбора сегрегационная нестабильность снижает общую скорость роста и продуктивность рекомбинантной популяции. Другой тип нестабильности — структурная неустойчивость — приводит к неспособности клеток синтезировать активный белок. Причина этой нестабильности может заключаться в мутации структурного гена или регуляторных нуклео-
тидных последовательностей. К сожалению, эта форма нестабильности не поддается регуляции путем давления отбора.
