
- •II часть
- •1.Миниатюризация
- •1.1.Мотивация проведения исследований в области нт
- •1.2.Планы и стратегия развития
- •1.3.Границы изменения масштабов
- •1.4.Связь размеров структур с их функциональностью
- •1.4.1.Распределение атомов и связанные с этим свойства
- •1.4.2.Отношения величина - свойства
- •4 Связь размеров структур с их функциональностью
- •2.1.Введение
- •2.2.Биологические строительные блоки
- •2.2.1. Размеры строительных блоков и наноструктуры
- •2.2.2.Основные объекты нанобиотехнологии
- •2.2.3.Строительные блоки.Синтетические и биологические.
- •2.3.Принципы самосборки
- •2.3.1.Нековалентные взаимодействия
- •2.3.2.Межмолекулярная упаковка
- •2.3.3.Биологическая самосборка
- •2.4.1.Самосборка (Другой источник информации): Понятия и определения
- •2.4.2.Типы межмолекулярных взаимодействий
- •2.4.3.Измерение свойств веществ в наномировом масштабе.
- •3.Нанобиотехнология
- •3.1.Проблемы определения используемых понятий
- •3.2.Технологии типа от нано к био
- •3.3.Технологии типа от био к нано
- •3.4.Нанобиотехнология и молекулярные устройства
- •3.4.1.Общие вопросы
- •3.1. Основные направления развития биотехнологии
- •3.4.2. Молекулярные устройства.3.4.2.1. Общие вопросы
- •3.4.2.2.Молекулярные пинцеты
- •4.4.2.3.Ротаксаны и катенаны
- •4.4.2.4.Вращательное движение
- •4.4.2.5.Возвратно-поступательное движение
- •4.4.2.6.Схемы сборки путем нанизывания кольцевых молекулярных
- •4.Биотехнология, медицина и здравоохранение
- •4.1. Состояние исследований и разработок
- •4.2. Цели, проблемы и решения
- •4.3. Инфраструктура, стратегия и приоритеты
- •4.4. Достижения и новые парадигмы
- •4.4.1. Изучение особенностей биологических систем
- •4.4.2. Нанонаука и нанотехнология в процессах создания биологических тканей (тканевая инженерия)
- •4.4.3. Биологическое детектирование боевых отравляющих веществ
- •4.4.4. Флуоресцентные биологические метки на основе полупроводниковых нанокристаллов
- •4.5.5. Нанотехнология изготовления днк-чипов
- •4.5.Иомиметические нанотехнологии
- •4.5.1. Днк как строительный материал нанотехнологий
- •4.5.1.1. Направленная сборка с помощью днк
- •4.5.1.2. Днк как шаблон для молекулярной электроники
- •4.5.1.3. Моторы и наномашины на основе днк
- •4.5.2.1. Действие биологических моторов
- •4.5.2.2. Биологические моторы как часть синтетических систем
- •4.5.3. Искусственный фотосинтез
- •4.7. Использование наноустройств в космических исследованиях
- •5.2.1.Основные технические характеристики микроскопа "supra 60vp"
- •5.3. Сканирующая зондовая микроскопия
- •5.3.1. Общие принципы сканирующей зондовой микроскопии
- •5.4.Сканирующая зондовая микроскопия
- •5.5.Сканирующая туннельная микроскопия
- •5.7.Атомно-силовые измерения в биологических системах
- •6. Технология рекомбинантных днк
- •6.1.Векторы для Escherichia coli
- •6.2.Идентификация клонированных днк
- •6.3.Экспрессия эукариотических белков в е. Coli
- •6.4. Генетическая инженерия с участием других клеток-хозяев
- •6.5.Получение инсулина на основе методов генетической инженерии
- •6.6.Синтез соматотропина
- •6.7.Получение интерферонов
- •6.8.Генная инженерия растений
- •6.8.1.Получение трансгенных растений
- •6.8.1.6.Применение методов генетической инженерии для улучшения аминокислотного состава запасных белков растений
- •6.8.1.7.Повышение эффективности процесса фотосинтеза
- •6.8.1.8.Генно-инженерные подходы к решению проблемы усвоения азота
- •6.8.1.9.Устойчивость растений к фитопатогенам
- •6.8.1.10.Устойчивость растений к гербицидам
- •6.8.1.11.Устойчивость растений к насекомым
- •6.8.1.12.Устойчивость растений к абиотическим стрессам
- •6.9.1.Типы питания микроорганизмов
- •6.9.2.Типы энергетического обмена у микроорганизмов
- •6.9.3.Питательные среды для культивирования микроорганизмов
- •6.9.4.Источники углерода
- •6.9.5.Источники азота
- •6.9.6.Источники витаминов, гормонов и микроэлементов
- •6.9.7.Биохимические и биофизические факторы роста
- •6.9.8.Конструирование питательных сред для выращивания микроорганизмов
- •6.9.9.Технология приготовления питательных сред
- •6.9.10.Пастеризация как вариант термической стерилизации
- •6.9.11.Стерилизация фильтрацией
- •6.9.12Особенности культивирования эукариотических клеток в качестве продуцентов.
- •10. Что такое паспорт культуры?
- •1. Каковы причины введения международных правил в фармацевтическую практику?
- •9. Экобиотехнология
- •9.1. Введение
- •9.2. Состояние исследований и разработок
- •9.3. Цели, проблемы и решения
- •9.4. Инфраструктура, стратегия и приоритеты
- •9.5. Достижения и новые парадигмы
- •9.6.Биотехнология утилизации твердых отходов.
- •9.6.1. Биотехнология утилизации твердых отходов
- •9.6.2.Биотехнология очистки сточных вод
- •9.7.Биоэнергетика
- •9.8. Ксенобиотики и их биодеградация
6. Технология рекомбинантных днк
6.1.Векторы для Escherichia coli
Векторами называют молекулы ДНК, обеспечивающие амплификацию фрагмента ДНК в растущей популяции клеток. Чтобы вектор отвечал всем предъявляемым к нему в процессе клонирования требованиям, он должен обладать следующими свойствами:
1. Способностью реплицироваться в клетке-хозяине.
2. Способностью включать чужеродные ДНК различной молекулярной массы без нарушения способности к репликации.
3. Легкостью введения в клетку-хозяина после включения чужеродной ДНК.
4. Наличием генетического маркера селекции, обеспечивающего быструю положительную селекцию клеток, содержащих вектор.
5. Наличием только одного сайта, подвергающегося расщеплению одной или несколькими рестрикционными эндонуклеа-зами.
Для клонирования ДНК в Е. coli применяли два класса векторов— плазмиды и бактериофаги. Здесь основное внимание будет уделено плазмидным векторам.
Как мы уже упоминали выше, при введении плазмид в клетки Е. coli используется механизм трансформации. Поскольку трансформированная клетка Е. coli может включить только одну плазмиду, а для последующего выделения, идентификации и применения интересующих нас последовательностей ДНК необходим клон, состоящий из большого числа идентичных клеток, содержащих плазмиды, то плазмида обязательно должна обладать способностью к репликации в растущей бактериальной клетке. Для этого в свою очередь нужно, чтобы в состав плазмиды входил участок начала репликации — нуклеотидная последовательность (около 600 пар оснований в случае плазмид Е. coli типа Со1Е-1), направляющая и регулирующая процесс репликации таким образом, чтобы каждая клетка содержала достаточное число копий плазмид (обычно около 30).
Немаловажны и генетические маркеры селекции. Если, например, в плазмиду включить ген устойчивости к антибиотику, то быстрая положительная селекция содержащих плазмиды клеток не вызовет затруднений. Для этого достаточно вырастить клетки на среде, содержащей антибиотик в такой концентрации, которая приведет к гибели всех не имеющих плазмиды клеток, но в то же время обеспечит рост клеток, содержащих плазмиды, а следовательно, и ген устойчивости к антибиотику. Другой общий подход к селекции заключается в использовании мутант-ной клетки-хозяина, у которой отсутствует фермент, необходимый для роста в определенной среде, и в одновременном введении соответствующего этому ферменту нормального гена в ре-
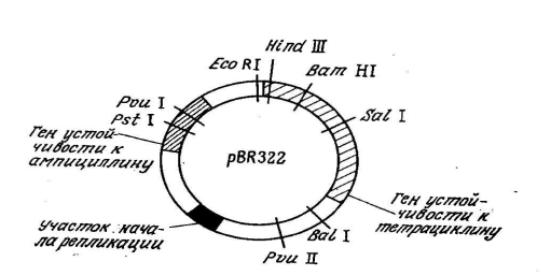
Рис.6.1. Генетическая арта плазмиды рBR322. Показаны локусы генов и ряд сайтов рестрикции. Расшифровона последовательность всех 4363 пар оснований плазмиды.
комбинантную плазмиду. В этом случае экспрессия гена плазмиды комплементирует генетический дефект клетки-хозяина.
В технологии рекомбинантных ДНК. маркеры селекции в плазмидах могут выполнять две различные функции. Во-первых, методы положительной селекции, позволяющие быстро идентифицировать содержащие вектор колонии, резко интенсифицируют лабораторные исследования. Во-вторых, при последующем выращивании содержащих плазмиду клеток давление отбора (обусловленное, например, введением в питательную среду антибиотика) сводит к минимуму конкуренцию со стороны любых не содержащих плазмиду клеток, которые могут возникать в ходе роста популяции.
Плазмидные векторы для клонирования в Е. coli особенно широко изучались в последние годы. К числу наиболее популярных относится плазмида pBR322 (рис. 6.1), содержащая ряд единичных сайтов рестрикции, гены устойчивости к тетрациклину и ампициллину, а также участок начала репликации, обеспечивающий амплификацию плазмиды в клетке. Здесь под амплификацией (экстракопированием) понимается существенное повышение количества плазмид по отношению к хромосомной ДНК. В случае pBR322 и родственных плазмид амплификация становится возможной благодаря тому обстоятельству, что в отличие от хромосомы репликация плазмиды в клетке-хозяине может осуществляться и тогда, когда белковый синтез остановлен. Поэтому добавление к культуральной жидкости ингибитора белкового синтеза, например хлорамфеникола, приводит к синтезу от 30 до 1000 и более копий плазмиды, а следовательно, и клонируемой ДНК. Это позволяет получить последнюю в количествах, достаточных для ее идентификации и последующего использования в качестве реагента при конструировании других ДНК. В плазмиде pBR322 и родственных векторах могут клонироваться сегменты чужеродных ДНК, содержащие до 15 тысяч пар оснований.
В качестве клонирующего вектора широко изучался также бактериофаг К, который сохраняет способность к репликации и литичеокие функции после делении 25% генома дикого типа; это позволяет клонировать сегменты чужеродной ДНК, содержащие до 12 тысяч пар оснований. Значительно большие сегменты ДНК (до 50 тысяч пар оснований) удается клонировать с помощью гибридных плазмидно-фаговых К векторов, называемых космидами; последние могут быть введены в головку и хвост фага Я. По этой причине векторы-бактериофаги предпочтительнее в тех случаях, когда возникает необходимость в клонировании библиотек, состоящих из целого генома эукариоты или из ее очень больших фрагментов. Полезные векторы получали также из фагов с одноцепочечным геномом, например из фага М13. Получаемые с их помощью одноцепочечные клоны особенно удобны для определения нуклеотидных последовательностей ДНК по методу Сэнджера. Следующий раздел будет посвящен методам выяснения последовательностей нуклеотидных остатков и другим методам идентификации клонированных ДНК.
