
- •II часть
- •1.Миниатюризация
- •1.1.Мотивация проведения исследований в области нт
- •1.2.Планы и стратегия развития
- •1.3.Границы изменения масштабов
- •1.4.Связь размеров структур с их функциональностью
- •1.4.1.Распределение атомов и связанные с этим свойства
- •1.4.2.Отношения величина - свойства
- •4 Связь размеров структур с их функциональностью
- •2.1.Введение
- •2.2.Биологические строительные блоки
- •2.2.1. Размеры строительных блоков и наноструктуры
- •2.2.2.Основные объекты нанобиотехнологии
- •2.2.3.Строительные блоки.Синтетические и биологические.
- •2.3.Принципы самосборки
- •2.3.1.Нековалентные взаимодействия
- •2.3.2.Межмолекулярная упаковка
- •2.3.3.Биологическая самосборка
- •2.4.1.Самосборка (Другой источник информации): Понятия и определения
- •2.4.2.Типы межмолекулярных взаимодействий
- •2.4.3.Измерение свойств веществ в наномировом масштабе.
- •3.Нанобиотехнология
- •3.1.Проблемы определения используемых понятий
- •3.2.Технологии типа от нано к био
- •3.3.Технологии типа от био к нано
- •3.4.Нанобиотехнология и молекулярные устройства
- •3.4.1.Общие вопросы
- •3.1. Основные направления развития биотехнологии
- •3.4.2. Молекулярные устройства.3.4.2.1. Общие вопросы
- •3.4.2.2.Молекулярные пинцеты
- •4.4.2.3.Ротаксаны и катенаны
- •4.4.2.4.Вращательное движение
- •4.4.2.5.Возвратно-поступательное движение
- •4.4.2.6.Схемы сборки путем нанизывания кольцевых молекулярных
- •4.Биотехнология, медицина и здравоохранение
- •4.1. Состояние исследований и разработок
- •4.2. Цели, проблемы и решения
- •4.3. Инфраструктура, стратегия и приоритеты
- •4.4. Достижения и новые парадигмы
- •4.4.1. Изучение особенностей биологических систем
- •4.4.2. Нанонаука и нанотехнология в процессах создания биологических тканей (тканевая инженерия)
- •4.4.3. Биологическое детектирование боевых отравляющих веществ
- •4.4.4. Флуоресцентные биологические метки на основе полупроводниковых нанокристаллов
- •4.5.5. Нанотехнология изготовления днк-чипов
- •4.5.Иомиметические нанотехнологии
- •4.5.1. Днк как строительный материал нанотехнологий
- •4.5.1.1. Направленная сборка с помощью днк
- •4.5.1.2. Днк как шаблон для молекулярной электроники
- •4.5.1.3. Моторы и наномашины на основе днк
- •4.5.2.1. Действие биологических моторов
- •4.5.2.2. Биологические моторы как часть синтетических систем
- •4.5.3. Искусственный фотосинтез
- •4.7. Использование наноустройств в космических исследованиях
- •5.2.1.Основные технические характеристики микроскопа "supra 60vp"
- •5.3. Сканирующая зондовая микроскопия
- •5.3.1. Общие принципы сканирующей зондовой микроскопии
- •5.4.Сканирующая зондовая микроскопия
- •5.5.Сканирующая туннельная микроскопия
- •5.7.Атомно-силовые измерения в биологических системах
- •6. Технология рекомбинантных днк
- •6.1.Векторы для Escherichia coli
- •6.2.Идентификация клонированных днк
- •6.3.Экспрессия эукариотических белков в е. Coli
- •6.4. Генетическая инженерия с участием других клеток-хозяев
- •6.5.Получение инсулина на основе методов генетической инженерии
- •6.6.Синтез соматотропина
- •6.7.Получение интерферонов
- •6.8.Генная инженерия растений
- •6.8.1.Получение трансгенных растений
- •6.8.1.6.Применение методов генетической инженерии для улучшения аминокислотного состава запасных белков растений
- •6.8.1.7.Повышение эффективности процесса фотосинтеза
- •6.8.1.8.Генно-инженерные подходы к решению проблемы усвоения азота
- •6.8.1.9.Устойчивость растений к фитопатогенам
- •6.8.1.10.Устойчивость растений к гербицидам
- •6.8.1.11.Устойчивость растений к насекомым
- •6.8.1.12.Устойчивость растений к абиотическим стрессам
- •6.9.1.Типы питания микроорганизмов
- •6.9.2.Типы энергетического обмена у микроорганизмов
- •6.9.3.Питательные среды для культивирования микроорганизмов
- •6.9.4.Источники углерода
- •6.9.5.Источники азота
- •6.9.6.Источники витаминов, гормонов и микроэлементов
- •6.9.7.Биохимические и биофизические факторы роста
- •6.9.8.Конструирование питательных сред для выращивания микроорганизмов
- •6.9.9.Технология приготовления питательных сред
- •6.9.10.Пастеризация как вариант термической стерилизации
- •6.9.11.Стерилизация фильтрацией
- •6.9.12Особенности культивирования эукариотических клеток в качестве продуцентов.
- •10. Что такое паспорт культуры?
- •1. Каковы причины введения международных правил в фармацевтическую практику?
- •9. Экобиотехнология
- •9.1. Введение
- •9.2. Состояние исследований и разработок
- •9.3. Цели, проблемы и решения
- •9.4. Инфраструктура, стратегия и приоритеты
- •9.5. Достижения и новые парадигмы
- •9.6.Биотехнология утилизации твердых отходов.
- •9.6.1. Биотехнология утилизации твердых отходов
- •9.6.2.Биотехнология очистки сточных вод
- •9.7.Биоэнергетика
- •9.8. Ксенобиотики и их биодеградация
2.4.1.Самосборка (Другой источник информации): Понятия и определения
Самосборка молекул подразумевает не просто их ассоциацию, а связывание в нужной последовательности и с определенной ориентацией. Можно сказать, что информация о структуре ассоциата «зашифрована» в химической структуре компонентов и «считывается» в ходе образования ансамбля. Поэтому самосборку часто рассматривают как межмолекулярный обмен структурной информацией и называют молекулярным распознаванием.
Непременное условие молекулярного распознавания — двойная компле-ментарность компонентов, включающая как геометрическое, так и энергетическое их соответствие. В последнем случае используются также термины химическая комплементарность и комплементарность взаимодействий.
Комплементарные компоненты (фрагменты молекул, отдельные молекулы или даже фрагменты ассоциатов) называют плеромерами от греческих слов пХпршра — дополнение и рероа — часть. В простейшем случае бимолекулярного ассоциата больший из плеромеров называется рецептором, а меньший — субстратом. Их обозначают р и и соответственно. На комплементарность р и а указывают с помощью «bra-ket> обозначений ( | и | ), применяемых в квантовой механике, например {р\а). Супермолекулу из комплементарных субъединиц обозначают ра. Рецепторные субъединицы часто еще называют лигандами — термином, пришедшим из химии координационных соединений.
В синтетических супрамолекулярных ансамблях зачастую различают активные и структурные компоненты. Структурные компоненты обеспечивают правильную сборку ансамбля и придание ему нужной формы. Активные компоненты отвечают за выполнение какой-либо функции.
По числу молекул, участвующих в самосборке, выделяют би-, три-, олиго- и многокомпонентные ассоциаты. Ассоциаты, состоящие из небольшого фиксированного числа молекул и имеющие хорошо определенные размеры и форму, принято называть также супермолекулами. Наряду с супермолекулами выделяют супрамолекулярные ансамбли — это полимолекулярные ассоциаты, как правило формирующие организованную (мезоморфную) фазу. Эта фаза может иметь форму пленки, мицелл, везикул, жидкого или твердого кристалла.
Супрамолекулярные ансамбли — это своеобразные «суперполимеры». В противоположность «низкомолекулярным» супермолекулам они полидисперсны, т. е. содержат переменное число молекул. Кроме того, структура ряда супрамолекулярных ансамблей, например из амфифильных соединений, менее устойчива и определенна, чем у супермолекул. Тем не менее деление на супермолекулы и супрамолекулярные ансамбли достаточно условно: известны кристаллические супрамолекулярные ансамбли, не уступающие супермолекулам в определенности и устойчивости структуры.
2.4.2.Типы межмолекулярных взаимодействий
Движущей силой самосборки молекул в супраструктуры служат невалентные межмолекулярные взаимодействия: координационные и водородные связи, электростатические, ван-дер-ваальсовы, гидрофобные взаимодействия.
Водородная связь (протонная или Н-связь) возникает между электроотрицательным атомом, имеющим неподеленную электронную пару, и атомом водорода, который химически связан с другим электроотрицательным атомом и имеет избыточный положительный заряд (см. рис. 8.1).
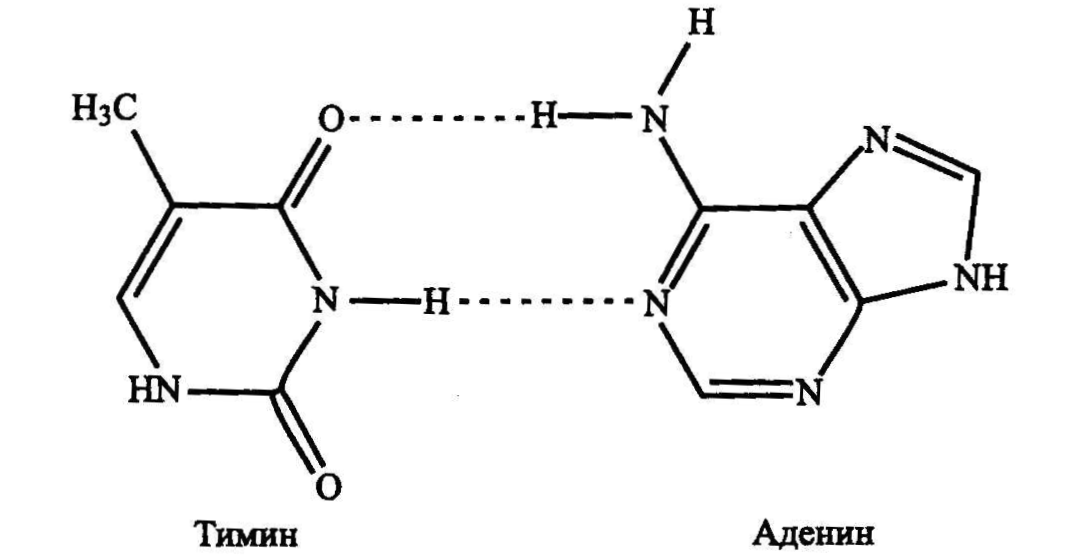
Рис. 2.9. Двойная водородная связь между тимином и аденином
Водородную связь схематически можно изобразить как:
R, - А - Н • • • • : D - R2,
где Ri, Щ — радикалы, А и D — электроотрицательные атомы (фтор, кислород, азот, иногда хлор или сера). Двумя точками показана пара электронов.
Водородная связь имеет электростатическую и донорно-акцепторную природу. Электростатическая компонента возникает за счет взаимодействия разноименно заряженных атомов (протона и электроотрицательного атома D) и диполей, в состав которых они входят. Донорно-акцепторное взаимодействие возникает между электронной парой молекулы донора OD-R2) и свободной орбиталью молекулы-акцептора (Rj-A-H).
Водородная связь, подобно ковалентной, обладает насыщаемостью (каждый протон может образовать лишь одну такую связь) и направленностью: атомы, участвующие в связывании, должны быть определенным образом сориентированы, что накладывает на структуру комплекса, образованного водородными связями, пространственные ограничения, одновременно повышая селективность распознавания. Энергия водородной связи колеблется от 1 до 15 ккал/моль, составляя в среднем 5-10 ккал/моль: она примерно на прядок сильнее ван-дер-ваальсовых взаимодействий и на порядок слабее ковалентной связи.
Координационная связь — это связь, образованная за счет электростатических и/или донорно-акцепторных взаимодействий молекул друг с другом или с ионами.
Представление о комплексных соединениях, образованных за счет кор-динационных связей, введено в 1892 г. швейцарским ученым Альфредом Вернером. В большинстве комплексов различают внутреннюю и внешнюю сферы. Центральный атом (ион) внутренней сферы является комплексообра-зователем, а координированные вокруг него молекулы (ионы) — лигандами. По заряду лигандов комплексы делят на анионные (отрицательно заряженные лиганды), катионные (положительно заряженные лиганды) и нейтральные. В последнем случае лиганды — это нейтральные молекулы, либо молекулы и анионы вокруг комплесообразователя-катиона.
Комплексообразователем может быть любой химический элемент. В супрамолекулярной химии чаще всего рассматриваются комплексы, в которых координационные (донорно-акцепторные) связи образуются между атомами N, О, S, имеющими неподеленные электронные пары, и катионами одно- двух-и трехвалентных металлов: К, Na, Mg, Са, Fe, Zn, Со и т. д. При этом ионы металлов служат акцепторами электронов, принимая их на свои свободные электронные орбитали, лежащие чуть выше валентных.
Координационная связь насыщаема и направлена. Число и пространственное расположение лигандов вокруг координационного центра определяется его электронной структурой. Интенсивность координационной связи варьируется в очень широких пределах: от 1-2 ккал/моль, что сопоставимо с энергией тепловых флуктуации, до 100 ккал/моль — как у ковалентной химической связи. Такое сочетание интенсивности и характера координационной связи делает ее удобным инструментом для химически программируемой самосборки наноструктур. Электростатические взаимодействия возникают между ионами и (или) полярными молекулами, отдельные атомы или группы атомов которых несут положительный или отрицательный заряд.
В зависимости от характера распределения электронной плотности молекулы их делят на полярные и неполярные. В неполярных молекулах центры тяжести положительных и отрицательных зарядов совпадают. В результате парциальные заряды на отдельных атомах близки к нулю. Примером могут служить алифатические углеводороды — от низкомолекулярных, таких как метан (СН4) или этан (Н3С-СН3), до полимерных (полиэтилен, -[-СН2-]П-)-
Полярные молекулы являются диполями. Полярность возникает при связывании атомов, которые имеют различную электроотрицательность, т. е. способность удерживать электроны. Если из двух ковалентно связанных атомов один более электроотрицателен (в паре с углеродом или водородом это могут быть гетероатомы N, О, S, F, С1 и др.), он оттягивает на себя электронную плотность «соседа», связь поляризуется и превращается в диполь. При этом более электроотрицательный атом приобретает избыточный отрицательный, а менее электроотрицательный — избыточный положительный заряд. Например, диполями являются группы -О-Н, -С-0-, >N-H, >С=0, -C=N.
Электростатические взаимодействия можно формально разделить на взаимодействия зарядов, заряда и диполя и двух диполей. Когда обсуждается взаимодействие отдельных зарядов, обычно речь идет об атомных или молекулярных ионах. Энергия взаимодействия точечных зарядов подчиняется закону Кулона и падает обратно пропорционально расстоянию между ними (и ~ 1/г). В полярных средах возможна экранировка заряда в результате перераспределения и ориентации молекул окружения, приводящая к более быстрому ослаблению электростатических взаимодействий с расстоянием.
Энергия взаимодействия заряд—диполь ослабляется с расстоянием как 1/г2, если диполь сориентирован жестко. Для свободно вращающегося диполя и "v 1/г4. При взаимодействии двух фиксированных и свободно вращающихся диполей и ~ 1/г3 и и ~ 1/г6 соответственно.
Выделяют также ван-дер-ваальсовы взаимодействия. Они характерны как для полярных, так и для неполярных молекул. Ван-дер-ваальсовы взаимодействия имеют квантовую природу. Тем не менее их появление можно объяснить исходя из достаточно простых представлений о электростатическом взаимодействии ядер атомов и электронных оболочек.
Атом, включающий положительно заряженное ядро и отрицательные электроны, является мгновенным микродиполем. Сближение молекул приводит к согласованию ориентации микродиполей, а также процессов их появления и исчезновения. В результате на расстояниях больше 2-3 А между молекулами (как полярными, так и неполярными) возникает притяжение, ослабевающее с расстоянием по закону и ~ 1/г6. Это так называемое дисперсионное (лондоновское) взаимодействие. Однако на более коротких дистанциях над притяжением начинает преобладать более сильное электростатическое отталкивание ядер и электронных оболочек. Суммарное действие дисперсионного притяжения и короткодействующего отталкивания приближенно описывается различными эмпирическими потенциалами. Один из них, довольно распространенный — потенциал Леннарда-Джонса, форма которого приведена на рис. 2.10:
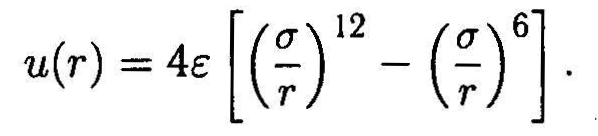
Здесь и(г) — потенциальная энергия, е — энергетический параметр (глубина потенциальной ямы), а — характерный размер атома, а расстояние 21/6ег, на котором притяжение уравновешивает отталкивание, обычно определяется как сумма ван-дер-ваальсовых радиусов взаимодействующих атомов.
Кроме того, вклад в ван-дер-ваальсовы взаимодействия дают ориентационные и индукционные взаимодействия. Ориента-ционное взаимодействие возникает между диполями полярных молекул. В случае индукционного взаимодействия полярная молекула «деформирует» электронную структуру неполярной, приводя к поляризации последней и усиливая собственную полярность.
Многие явления самоорганизации, как правило, вызываются не отдельным типом межмолекулярных взаимодействий, а множеством различных взаимодействий. В тех случаях, когда самосборка компонентов идет в растворе, активное влияние
среды на этот процесс рассматривают как некую обобщенную силу растворителя.
Эффект растворителя состоит в том, что молекула субстрата стремится перейти из одного окружения в другое, например из окружения молекул растворителя в окружение лигандов, с которыми субстрат образует супермолекулу. Такое стремление «к перемене мест» возникает в связи с различием свободной энергии молекулы в разном окружении. Наиболее известный пример эффекта растворителя — гидрофобный эффект.
Рис.2.10. Вид протенциала ван-дервальского взаимодействия
Гидрофобный эффект — это эффективное (кажущееся) притяжение между неполярными молекулами, проявляющееся при их попадании в воду (полярный растворитель). За эту способность неполярные вещества также называют гидрофобными — «боящимися воды». На макроуровне гидрофобный эффект проявляется в том, что неполярные жидкости плохо смешиваются (или не смешиваются) с водой, а эмульсии типа вода—масло неустойчивы и стремятся к макрофазному расслоению. На молекулярном масштабе гидрофобные молекулы или фрагменты в водном окружении интенсивно агрегируют.
Изменение свободной энергии при переносе гидрофобной молекулы из «своей» фазы в воду складывается из энтальпийной и энтропийной составляющих. Такой перенос повышает свободную энергию, т. е. он не выгоден. Основной вклад в изменение свободной энергии дает понижение энтропии (упорядочение системы), тогда как изменение энтальпии, которое может быть как положительным, так и отрицательным, обычно значительно меньше и не столь существенно. Другими словами, в присутствии гидрофобных молекул вода упорядочивается! Почему это происходит?
Хорошо известно, что в воде существует сетка водородных связей, где каждая молекула связана с четырьмя соседями. Чтобы в эту сетку вошла гидрофобная молекула, необходимо либо порвать часть водородных связей между окружающими молекулами воды, что крайне невыгодно (одна водородная связь «стоит» около 7 ккал/моль), либо переориентировать эти молекулы, исказив сетку. Переориентация молекул воды на гидрофобной поверхности связана с потерей энтропии, т. е. подвижности. Тем не менее она оказывается предпочтительнее разрыва водородных связей, так как в единицах TAS обходится всего в 0,2 ккал/моль.
Упорядочение молекул воды вокруг гидрофобной молекулы фактически означает, что последняя покрыта «ледяной коркой». Чтобы снизить энтропийные потери, гидрофобные молекулы ассоциируются: тогда площадь гидрофобной поверхности и, соответственно, «количество льда», приходящееся на каждую неполярную молекулу, уменьшаются. Со стороны это выглядит так, будто между неполярными молекулами действует гидрофобное притяжение.
Гидрофобное притяжение — важнейший фактор самоорганизации в водных средах. В биологических системах это одна из сил, стабилизирующих клеточные мембраны, глобулярные белки, ДНК и т. д. Гидрофобные эффекты ответственны за формирование клатратов — кристаллов воды и неполярных молекул, которые могут рассматриваться как наноструктурированные материалы. В значительной степени за счет гидрофобных взаимодействий происходит сборка мицелл, слоев и везикул — супрамолекулярных ансамблей амфифильных молекул.
п-стекинг — это особый тип межмолекулярных взаимодействий, характерный для ароматических соединений. В соответствии с концепцией Хантера—Сандерса, сформулированной ими в 1990 г. [8], п-стекинг имеет электростатическую природу и обусловлен особым характером электронной структуры ароматических молекул. Например, в молекуле бензола (СбНб), структура которой показана на рис. 2.11, каждый атом углерода находится в состоянии sp-гибридизации. Три sp2-орбитали лежат в плоскости кольца, образуя сг-связи с соседними атомами углерода и водорода. У каждого углерода остается еще одна негибридизованная 2р2-орбиталь, направленная перпендикулярно плоскости молекулы. Шесть таких 7г-орбиталей делокализованы, т. е. объединены в два 7г-электронных облака — над и под плоскостью, образованной ядрами атомов углерода и водорода. Аналогичное неравномерное «сендви-чевое» распределение электронной плотности характерно и для производных бензола. Благодаря этому между ароматическими фрагментами молекул может возникать как притяжение, так и отталкивание — в зависимости от их взаимной ориентации, что иллюстрирует рис. 2.12. Энергия такого взаимодействия составляет порядка 1-10 ккал/моль.
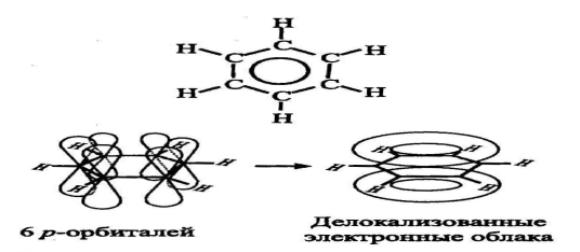
Рис.2.11. Химическая формула и электронная структура бензола (показана делокализация р-орбиталей)
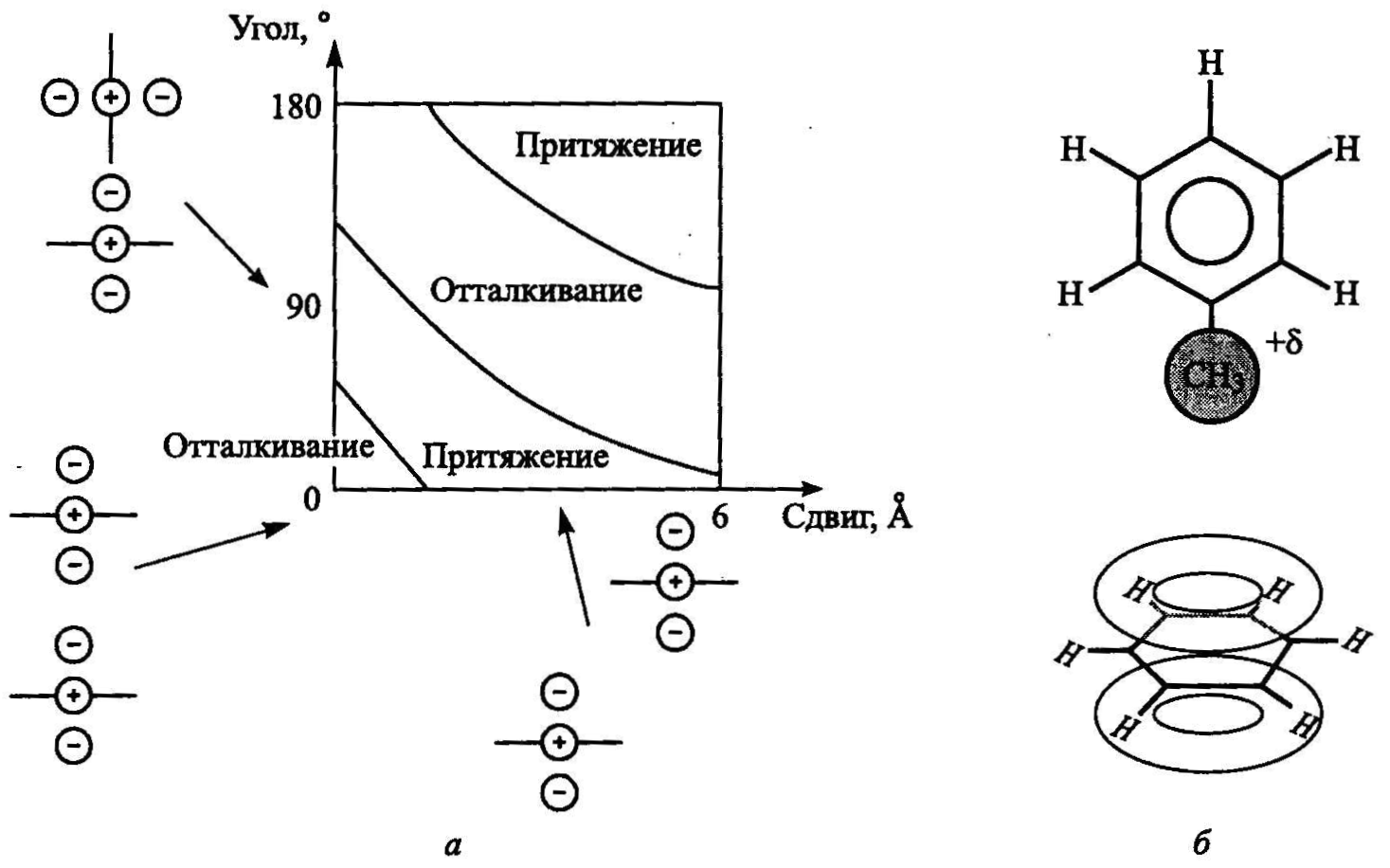
Рис. 2.12. Типы взаимодействий ароматических фрагментов: а — силы, действующие при ж-стекинге между ароматическими фрагментами в зависимости от их взаимной ориентации по данным [8], а также б — схема Т-стекинга
Аналогичную электростатическую природу имеет так называемый Т-спгекинг, характерный, например, для пары бензол-толуол, где положительно заряженные атомы водорода метильной группы толуола взаимодействуют с 7г-электронным облаком бензола. По тому же механизму происходит и катион-ж-связывание (взаимодействие между ароматическим фрагментом и каким-либо катионом). Его энергия может достигать 20 ккал/моль.
Основные характеристики межмолекулярных взаимодействий приведены в табл. 2.5.
Таблица 2.5.
Типы межмолекулярных взаимодействий
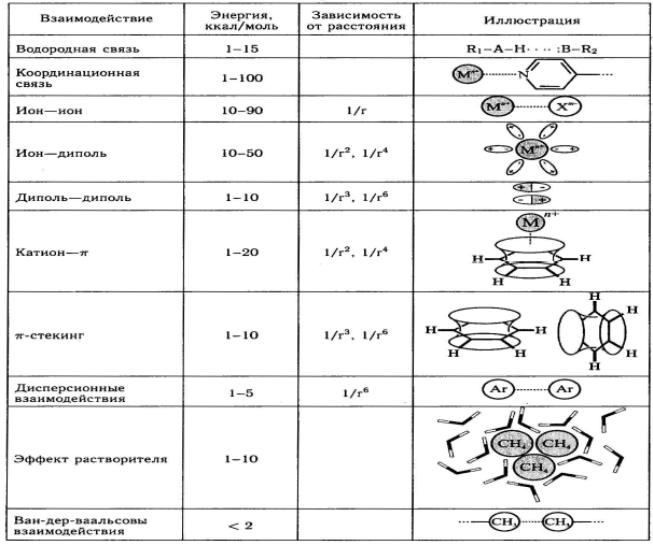
Таким образом, межмолекулярные взаимодействия обычно на 1-2 порядка слабее ковалентных связей, так что супрамолекулярные ассоциаты менее стабильны термодинамически, более лабильны кинетически и более гибки динамически, чем молекулы. Их структура может быть легко изменена или разрушена различными внешними воздействиями: изменением температуры, концентрации каких-либо веществ или ионов, облучением, замещением одного из компонентов ассоциата другим и т. д. Как ни странно, это дает супраструктурам ряд следующих преимуществ.
— Простота сборки. Супрамолекулярные ансамбли, особенно состоящие из многих тысяч молекул и имеющие сложную форму, гораздо легче собрать из небольших, одинаковых и относительно простых компонентов, чем химически синтезировать. Это относится, например, к биологическим и синтетическим мембранам, пленкам, везикулам, микродоменным структурам и т. п.
— Селективность молекулярного распознавания. Рецептор, «выбирая» в сложном химическом окружении нужный субстрат, естественно, может оказаться в контакте и не с той молекулой. Селективность обеспечивается обратимостью ошибочного связывания.
— Управляемость. Легкая подверженность супрамолекулярных структур внешним воздействиям позволяет контролировать их функционирование. В природе каталитические «способности» белков «включаются» и «выключаются» в нужные моменты изменением условий среды, восстанавливающим или разрушающим лабильные невалентные связи, которые поддерживают каталитически активную (так называемую нативную) структуру. Созданы синтетические молекулы, способные связывать и «отпускать» другие молекулы или ионы, например при облучении светом определенной длины волны. На этом принципе основана работа различных рецепторов, регенерируемых сорбентов, активный трансмембранный транспорт веществ.
— Многократность использования. Не вступая в трудно разрушаемое химическое взаимодействие друг с другом, компоненты супрамолекулярного ансамбля не видоизменяются. Благодаря этому их можно многократно повторно использовать.
— Регенерируемость. При небольших повреждениях супрамолекулярные ансамбли легко восстанавливаются, достраивая свою структуру до термодинамически выгодной.
— Утилизируемость. Для разрушения супрамолекулярных структур нужны меньшие затраты энергии, благодаря чему их легко «разобрать» в случае необходимости. Эта «экологичность» нужна как биологическим, так и синтетическим системам.
С 41 стр.Хартманн
