
- •1. Введение
- •2. Химическая коррозия
- •2.1 Показатели химической коррозии
- •2.2 Пленки продуктов коррозии и их свойства
- •2.3 Кинетика роста пленок
- •2 .4 Оксидные пленки и их свойства
- •2.5 Теория жаростойкого легирования
- •2.6 Факторы газовой коррозии
- •Внутренние
- •Внешние факторы
- •2.7 Защита от газовой коррозии
- •3. Электрохимическая коррозия
- •3.1 Термодинамика электрохимической коррозии
- •3.2 Схема электрохимической коррозии
- •А нодный
- •3.3 Местные гальванические элементы и причины их появления
- •3.4 Катодные процессы
- •3.5 Внутренние и внешние факторы электрохимической коррозии Внутренние факторы
- •Термодинамическая устойчивость и положение в периодической системе Менделеева
- •Состав и структура сплава
- •Внешние факторы
- •3 . Температура, давление и перемешивание
- •С увеличением давления скорость коррозии увеличивается, т.К. Увеличивается растворимость кислорода.
- •3.6 Понятие пассивности и ее значение для защиты металлов
- •4. Коррозия металлов в естественных условиях
- •4.1 Атмосферная коррозия
- •4.1.1 Типы атмосферной коррозии
- •Толщина пленки меняет течение катодных и анодных процессов. В зависимости от толщины возможен различный контроль:
- •4.1.2 Причины появления пленки влаги
- •4.1.3 Факторы атмосферной коррозии
- •4.1.4 Способы защиты
- •4.2 Подземная коррозия
- •4.2.1 Особенности подземной коррозии
- •4.2.2 Механизм
- •4.2.3 Вторичные продукты коррозии
- •4.2.4 Факторы подземной коррозии
- •4.2.5 Блуждающие токи
- •4.2.6 Методы защиты
- •4.3 Морская коррозия
- •4.3.1 Особенности морской коррозии
- •4.3.2 Характер разрушения
- •4.3.3 Механизм морской коррозии
- •4.3.4 Контроль
- •4.3.5 Факторы морской коррозии
- •4.3.6 Методы защиты
- •4.4 Коррозия металлов на металлургических предприятиях
- •5. Коррозия металлов в условиях эксплуатации
- •5.1 Межкристаллитная коррозия (мкк)
- •5.1.1Факторы мкк
- •5.1.2 Защита от мкк
- •5.2 Контактная коррозия
- •5.3 Щелевая коррозия
- •5.3.1 Способы защиты от щелевой коррозии
- •5.4.1 Типы питтинговой коррозии
- •5.4.2 Условия питтингообразования
- •5.4.3 Этапы питтингообразования
- •5.4.4 Факторы
- •5.4.5 Защита от питтингообразования
- •6. Защита металлов от коррозии
- •6.1 Защитные покрытия
- •Травление:
- •6.1.1 Металлические
- •Гальванический метод
- •Горячий метод
- •Плакирование.
- •Металлизация распылением
- •Диффузионные
- •6.1.2 Неметаллические покрытия
- •1.Лакокрасочные покрытия
- •6.2.1 Катодная защита
- •6.2.2 Анодная защита
- •6.3 Замедлители коррозии
- •Приложение
3.2 Схема электрохимической коррозии
Заключается в протекании электрохимической реакции с участием свободных электронов, при которой ионизация атомов металла и восстановление окислительного компонента коррозионной среды проходят не в одном акте и их скорости зависят от величины потенциала.
Схема состоит из трех основных процессов:
Анодной реакции – образование гидратированных ионов металла в электролите и некомпенсированных электронов на анодных участках
 ne
ne Me
n+
Men+
∙
mH2O
ne
ne Me
n+
Men+
∙
mH2O
Процессы перетекания электронов по металлу от анодных участков к катодным и соответствующего перемещения катионов и анионов в растворе.
Катодного процесса – ассимиляция электронов (деполяризаторами).
Д + ze → [ Дze ]

 Θ
Θ
А нодный
 участок.
+m
Н2О
участок.
+m
Н2О





 ze
Ме Меz+
∙
m
Н2О
ze
Ме Меz+
∙
m
Н2О
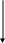
 К+
К+

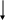





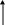




 ze
ze
Д [Дze] А-
Рис.3.1 Схема протекания электрохимической коррозии
3.3 Местные гальванические элементы и причины их появления
Таблица 3.1 Причины возникновения гетерогенности поверхности металла
Общая причина |
Конкретная причина |
Неоднородность металла |
|
1.Неоднородность металлической фазы. |
а) макро- и микровключения б) неоднородность сплава. |
2.Неоднородность поверхности металла |
а) наличие границ блоков и зерен кристаллитов б) выход дислокаций на поверхность металла в) анизотропность металлического кристалла |
3.Атомарная неоднородность поверхности металла |
а) наличие разнородных атомов в твердом растворе |
4. Неоднородность защитных пленок на поверхности металла. |
а) макро- и микропоры в окисной пленке, б) неравномерное распределение по поверхности металла вторичных продуктов. |
5.Неоднородность внутренних напряжений в металле. |
а) неравномерная деформация, б) неравномерность приложенных внешних напряжений |
Неоднородность электролита |
|
Неоднородность жидкой фазы |
а) различие в концентрации собственных ионов данного металла в электролите, б) различие в концентрации нейтральных солей в растворе, в) различия pH , г) различие в концентрации кислорода |
Неоднородность физических условий |
|
Неоднородность физических условий |
а) различие температур, б) неравномерное распределение лучистой энергии, в) неравномерное наложение внешнего электрического поля. |
Таким образом, поверхность металла представляет собой многоэлектродный (состоящий из двух и более) отличающихся друг от друга электродов, гальванический элемент.
Поверхность металла можно рассматривать как двух электродную систему, т.е. состоящую из участков двух видов: анодных и катодных.
Например, на поверхности металла присутствует пленка лакокрасочного покрытия, не полностью покрывающая металлическое изделие, находящееся в растворе серной кислоты (рисунок 3.2)


 20% Н2SO4
20% Н2SO4
К
 А
А


Рис. 3.2 Схема протекания коррозионных процессов
На поверхности металла, покрытой пленкой, будет протекать катодный процесс. Так как среда кислая, то катодной реакцией будет водородная деполяризация: К: Н+ + е → ½ Н2.
На поверхности оголенного металла будет протекать анодная реакция, так как эта часть металлического образца будет более активной по отношению к покрытой лакокрасочной пленкой. Если в качестве металла выбрано железо, то будет протекать следующая реакция анодного окисления: А: Fe Fe2+ + 2e
