
- •1. Введение
- •2. Химическая коррозия
- •2.1 Показатели химической коррозии
- •2.2 Пленки продуктов коррозии и их свойства
- •2.3 Кинетика роста пленок
- •2 .4 Оксидные пленки и их свойства
- •2.5 Теория жаростойкого легирования
- •2.6 Факторы газовой коррозии
- •Внутренние
- •Внешние факторы
- •2.7 Защита от газовой коррозии
- •3. Электрохимическая коррозия
- •3.1 Термодинамика электрохимической коррозии
- •3.2 Схема электрохимической коррозии
- •А нодный
- •3.3 Местные гальванические элементы и причины их появления
- •3.4 Катодные процессы
- •3.5 Внутренние и внешние факторы электрохимической коррозии Внутренние факторы
- •Термодинамическая устойчивость и положение в периодической системе Менделеева
- •Состав и структура сплава
- •Внешние факторы
- •3 . Температура, давление и перемешивание
- •С увеличением давления скорость коррозии увеличивается, т.К. Увеличивается растворимость кислорода.
- •3.6 Понятие пассивности и ее значение для защиты металлов
- •4. Коррозия металлов в естественных условиях
- •4.1 Атмосферная коррозия
- •4.1.1 Типы атмосферной коррозии
- •Толщина пленки меняет течение катодных и анодных процессов. В зависимости от толщины возможен различный контроль:
- •4.1.2 Причины появления пленки влаги
- •4.1.3 Факторы атмосферной коррозии
- •4.1.4 Способы защиты
- •4.2 Подземная коррозия
- •4.2.1 Особенности подземной коррозии
- •4.2.2 Механизм
- •4.2.3 Вторичные продукты коррозии
- •4.2.4 Факторы подземной коррозии
- •4.2.5 Блуждающие токи
- •4.2.6 Методы защиты
- •4.3 Морская коррозия
- •4.3.1 Особенности морской коррозии
- •4.3.2 Характер разрушения
- •4.3.3 Механизм морской коррозии
- •4.3.4 Контроль
- •4.3.5 Факторы морской коррозии
- •4.3.6 Методы защиты
- •4.4 Коррозия металлов на металлургических предприятиях
- •5. Коррозия металлов в условиях эксплуатации
- •5.1 Межкристаллитная коррозия (мкк)
- •5.1.1Факторы мкк
- •5.1.2 Защита от мкк
- •5.2 Контактная коррозия
- •5.3 Щелевая коррозия
- •5.3.1 Способы защиты от щелевой коррозии
- •5.4.1 Типы питтинговой коррозии
- •5.4.2 Условия питтингообразования
- •5.4.3 Этапы питтингообразования
- •5.4.4 Факторы
- •5.4.5 Защита от питтингообразования
- •6. Защита металлов от коррозии
- •6.1 Защитные покрытия
- •Травление:
- •6.1.1 Металлические
- •Гальванический метод
- •Горячий метод
- •Плакирование.
- •Металлизация распылением
- •Диффузионные
- •6.1.2 Неметаллические покрытия
- •1.Лакокрасочные покрытия
- •6.2.1 Катодная защита
- •6.2.2 Анодная защита
- •6.3 Замедлители коррозии
- •Приложение
2. Химическая коррозия
Химическая коррозия металлов – самопроизвольное взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте.
Первопричина химической коррозии – термодинамическая неустойчивость металлов. Химическая коррозия возникает в результате химического воздействия коррозионной среды (без образования электрического тока) и протекает обычно в неэлектропроводной среде, например, в безводных средах и газах, особенно при повышенных температурах.
Эта коррозия протекает относительно просто, поскольку определяющих факторов мало. Однако если на поверхности металла образуются защитные слои, то скорость коррозии зависит от скорости диффузии газа в металл или от скорости диффузии атомов металла.
При химической коррозии происходит прямой переход валентных электронов из металла в продукт коррозии, т.е. образуются ионные соединения по следующей схеме:
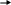 2Мет
+ 02г
2МеОт
2Мет
+ 02г
2МеОт
Данная химическая реакция окисления будет находиться в равновесии, если парциальное давление кислорода (РО2) и упругость диссоциации окисла (РМеО) станут, равны. При (РО2) (РМеО) реакция будет протекать в сторону образования окисла. Наоборот, при (РО2) (РМеО) реакция будет протекать в обратном направлении. Окисел будет диссоциировать с образованием чистого металла и кислорода.
Принципиальная возможность протекания этой реакции определяется изобарно-изотермическим потенциалом Gт.
Если Gт< коррозия возможна;
Gт> коррозия невозможна;
Gт = 0 – в равновесии.
Чтобы определить Gт, нужно произвести расчёт
по формуле
Gт = RT (lg РМеО- lg РО2)
где РМеО – равновесное парциальное давление кислорода или упругость диссоциации оксида;
РО2 - фактическое давление О2.
Т
 огда
Gт<0
когда - РО2
> РО2
коррозия возможна
огда
Gт<0
когда - РО2
> РО2
коррозия возможна
Gт >0 когда РО2 < РО2 коррозия невозможна
2.1 Показатели химической коррозии
Кинетика процессов коррозии существенно изменяется под воздействием внешних (состав, температура, давление, скорость потока, агрегатное состояние среды) и внутренних (химический и фазовый состав, структура, чистота, физико-механические свойства) факторов.
Скорость коррозии – количество металла, ионизированного в единицу времени с поверхности металла.
Истинная скорость коррозии металла в момент времени τ, равна первой производной величины у по времени τ при τ = τ1 , или графическим дифференцированием по tg угла наклона к кривой у = f (τ)





У df() = dy = tg


 d
d
d
d

у1

Р ис.2.1
Графическое дифференцирование
ис.2.1
Графическое дифференцирование
Скорость коррозии характеризуется основными показателями:
Глубинный – это глубина коррозионного разрушения металла ( П ) в единицу времени ( τ ).
![]() ,
мм/год
;
,
мм/год
;
Показатель изменения толщины (h) образующейся на металле плёнки продуктов коррозии
![]() ,
мм/год;
,
мм/год;
Показатель изменения массы - изменение массы (m) в результате коррозии, отнесённое к единице поверхности металла ( S ) и к единице времени ( τ ).
![]()
![]() ,
,
![]() ,
г/м2ч;
,
г/м2ч;
Если известен состав образующихся продуктов коррозии, то тогда эти два показателя можно пересчитать:
![]() ,
,
где Аме – атомная масса металла;
Аок - атомная масса окислителя;
nме - валентность металла;
nок - валентность окислителя;
Глубинный показатель:
К нему можно перейти через отрицательный показатель коррозии.
![]() ,
где Кm-
в г/м2ч,
ме
– в г/см3.
,
где Кm-
в г/м2ч,
ме
– в г/см3.
Объёмный показатель:
Кобъёмн. – это объём поглощённого или выделившегося в процессе коррозии металла газа (Vобъёмн.), приведённый к нормальным условиям (Т= 00С; Р = 1 атм) и отнесённый к единице времени.
![]() ,
см3/
см2ч
,
см3/
см2ч
