
- •Титриметрические методы анализа
- •Содержание
- •1. Общая характеристика титриметрических методов анализа
- •1.1. Требования к химическим реакциям титрования
- •1.2. Классификация реакций, применяемых в титриметрии
- •Кислотно-основное титрование (протолитометрия).
- •Окислительно-восстановительное титрование (редоксиметрия).
- •1.3. Стандартные растворы – титранты
- •1.4. Способы выражения концентрации стандартных растворов
- •1.5. Закон эквивалентов
- •1.6. Общие приемы титрования
- •1.7. Кривые титрования
- •2. Кислотно-основное титрование (протолитометрия)
- •2.1. Теории кислотно-основного взаимодействия
- •2.2. Буферные растворы
- •2.3. Кривые титрования сильных протолитов
- •2.3.1. Титрование сильной кислоты раствором сильного основания
- •2.3.2. Титрование сильного основания раствором сильной кислоты
- •2.3.3. Анализ кривых титрования
- •2.4. Кислотно-основные индикаторы
- •2.5. Титрование слабого протолита сильным протолитом
- •2.5.1. Титрование слабой кислоты сильным основанием
- •2.5.2. Титрование слабого основания сильной кислотой
- •2.5.3. Особенности титрования слабых протолитов
- •2.6. Титрование смеси протолитов , полипротонных кислот, поликислотных оснований
- •2.6.1. Титрование смеси двух кислот – сильной и слабой
- •2.6.2. Титрование двух слабых кислот
- •2.6.3. Титрование полипротонных кислот (н3ро4)
- •2.6.4. Титрование поликислотных оснований (Na2co3)
- •2.7. Источники ошибок в титриметрическом анализе
- •3. Комплексиметрические методы анализа (комплексиметрия)
- •3.1. Общая характеристика метода
- •3.2. Комплексонометрия
- •3.2.1. Кривые титрования в комплексонометрии
- •3.2.2. Влияние кислотности раствора
- •3.2.3. Влияние дополнительных лигандов
- •3.2.4. Определение точки эквивалентности в методе комплексонометрии. Металлоиндикаторы
- •3.2.5. Особенности метода комплексонометрии
- •4. Окислительно-восстановительное титрование (редоксиметрия)
- •4.1. Общая характеристика метода
- •4.2. Кривые окислительно-восстановительного титрования
- •4.3. Определение точки эквивалентности в методе редоксиметрии
- •4.4. Факторы, влияющие на величину редоксипотенциала
- •4.4.1. Применимость формулы Нернста
- •4.4.2. Влияние ионной силы раствора на величину редоксипотенциала
- •4.4.3. Влияние рН раствора на величину редоксипотенциала
- •4.4.4. Влияние комплексообразования или образования малорастворимых соединений на величину редоксипотенциала
- •4.5. Особенности редоксиметрии
- •4.5.1. Предварительная подготовка пробы к анализу
- •4.5.2. Константы равновесия окислительно-восстановительных реакций
- •4.5.3. Скорость и механизм окислительно-восстановительных реакций
- •4.5.4. Устойчивость водных растворов окислителей и восстановителей
- •4.5.5. Факторы, влияющие на скорость окислительно-восстановительной реакции
- •4.6. Методы окислительно-восстановительного титрования
- •4.6.1. Перманганатометрия
- •4.6.2. Дихроматометрия
- •4.6.3. Хромометрия
- •4.6.4. Иодометрия
- •4.6.5. Ванадатометрия
- •4.6.6. Цериметрия
- •4.6.7. Броматометрия
- •Литература
2.3.1. Титрование сильной кислоты раствором сильного основания
HCl + NaOH = H2O + NaCl;
H+ + OH- = H2O.
Примем объем раствора кислоты Vк = 100 мл, концентрацию кислоты Ск = 0,1 М, концентрацию титранта Ст = 0,1 М, объем титранта Vт – переменная величина. Расчеты проведем без учета ионной силы раствора.
1. До начала титрования:
pH = -lg[H+] = -lgCк,
поскольку сильная одноосновная кислота HCl в растворе полностью ионизована.
2. В процессе титрования до точки эквивалентности (ТЭ):
В процессе титрования концентрация соляной кислоты будет уменьшаться.
Степень
оттитрованности: ![]()
![]()
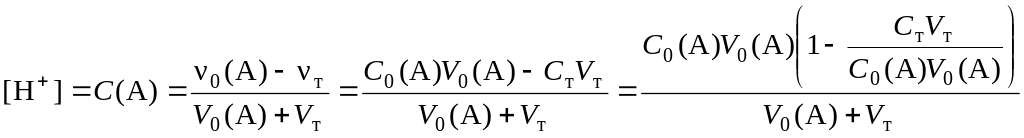
или
![]() ,
,
где х = 100 – х.
Если не учитывать изменение объема раствора за счет добавления титранта, то:
![]() ,
,
тогда
![]() .
.
В точке эквивалентности (стехиометричности):
[H+]
= [OH-]
=
![]() =
10-7
моль/л;
=
10-7
моль/л;
![]() .
.
После точки эквивалентности рН раствора определяется избыточной концентрацией титранта – сильного основания:
![]() ,
,
где х = х – 100.
Без учета изменения объема раствора при титровании (без учета разбавления).
![]() ,
,
тогда
![]() .
.
Составим таблицу значений рН и построим кривую титрования (рис. 2.1).
Vт, мл (х, %) |
pH (без учета разбавления) |
рН (с учетом разбавления) |
0 |
1 |
1 |
50 |
1,3 |
1,5 |
90 |
2 |
2,3 |
99 |
3 |
3,3 |
99,9 |
4 |
4,3 |
100 |
7 |
7 |
100,1 |
10 |
9,7 |
101 |
11 |
10,7 |
110 |
12 |
11,7 |
200 |
13 |
12,7 |
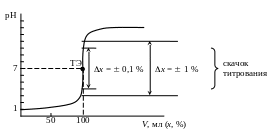
Рис. 2.1. Кривая титрования сильной кислоты (0,1 М HCl) раствором сильного основания (0,1 М NaOH)
2.3.2. Титрование сильного основания раствором сильной кислоты
NaOH + HCl = H2O + NaCl
Примем объем раствора основания V0(A) = 100 мл, концентрацию основания С0(А) = 0,1 М, концентрацию титранта – кислоты Ст = 0,1 М, объем титранта Vт – переменная величина.
Самостоятельно вывести формулы для расчета рН и построить кривую титрования.
Исходный раствор NaOH: pH = pKw + lgС0(А).
При титровании до точки эквивалентности: pH = pKw + lgС0(А) + lg
 .
.В точке эквивалентности: pHт.э. = 7.
После точки эквивалентности: pH = – lgС0(А) – lg .
2.3.3. Анализ кривых титрования
Первая точка кривой определяется исходной концентрацией титруемой кислоты (основания) С0(А).
В начале титрования рН раствора изменяется сравнительно мало даже при добавлении достаточно больших количеств титранта (до х ~ 90%). Также слабо изменяется рН и при избыточных (по сравнению со стехиометрическим) количествах титранта (х 110%).
Кривые титрования практически симметричны относительно ТЭ (рН = 7) при условии, что С0(А) = Ст.
Вблизи ТЭ (стехиометричности) наблюдается резкое изменение рН среды при добавлении даже небольших количеств титранта («скачок рН»). Величина скачка задается «областью эквивалентности», которая определяется погрешностью титрования. Требуемую погрешность титрования х задают в процентах от стехиометрически необходимого количества титранта (обычно 0,1% или 1%) (рис. 2.1).
Если х = 0,1 %, то х1 = 99,9 % (до ТЭ), х2 = 100,1 % (после ТЭ), тогда
рНх1 = –lgС0(А) – lg ;
pHх2 = pKw + lgС0(А) + lg .
Величина «скачка рН»: pH = pKw + 2lgС0(А) + 2lg .
При x = 0,1% скачок pH = 8 + 2lgС0(А).
При x = 1% скачок pH = 10 + 2lgС0(А).
Влияние концентрации титранта и определяемого вещества. Как следует из анализа кривой титрования скачок рН тем больше, чем выше концентрации веществ (при прочих равных условиях). Минимальная величина скачка, позволяющая фиксировать ТЭ при титровании, составляет pH = 2. Можно оценить минимальную концентрацию протолита, при которой титрование возможно:
при x
=
0,1%, ![]() ,
тогда С(А)min
= 10-3
моль/л;
,
тогда С(А)min
= 10-3
моль/л;
при x
=
1%, ![]() ,
тогда С(А)min
= 10-4
моль/л.
,
тогда С(А)min
= 10-4
моль/л.
Концентрацию титранта обычно берут в 5–10 раз больше, чем концентрация определяемого (титруемого) вещества. Это обеспечивает большую величину скачка рН, т.е. более резкий и четкий переход окраски индикатора. Однако нужно учитывать, что возрастает так называемая «капельная» ошибка титрования. Если абсолютная погрешность бюретки 0,02 мл, объем капли 0,03–0,01 мл, то при объеме титранта 10 мл хкапли = 0,3‑0,1 %.
