
- •Титриметрические методы анализа
- •Содержание
- •1. Общая характеристика титриметрических методов анализа
- •1.1. Требования к химическим реакциям титрования
- •1.2. Классификация реакций, применяемых в титриметрии
- •Кислотно-основное титрование (протолитометрия).
- •Окислительно-восстановительное титрование (редоксиметрия).
- •1.3. Стандартные растворы – титранты
- •1.4. Способы выражения концентрации стандартных растворов
- •1.5. Закон эквивалентов
- •1.6. Общие приемы титрования
- •1.7. Кривые титрования
- •2. Кислотно-основное титрование (протолитометрия)
- •2.1. Теории кислотно-основного взаимодействия
- •2.2. Буферные растворы
- •2.3. Кривые титрования сильных протолитов
- •2.3.1. Титрование сильной кислоты раствором сильного основания
- •2.3.2. Титрование сильного основания раствором сильной кислоты
- •2.3.3. Анализ кривых титрования
- •2.4. Кислотно-основные индикаторы
- •2.5. Титрование слабого протолита сильным протолитом
- •2.5.1. Титрование слабой кислоты сильным основанием
- •2.5.2. Титрование слабого основания сильной кислотой
- •2.5.3. Особенности титрования слабых протолитов
- •2.6. Титрование смеси протолитов , полипротонных кислот, поликислотных оснований
- •2.6.1. Титрование смеси двух кислот – сильной и слабой
- •2.6.2. Титрование двух слабых кислот
- •2.6.3. Титрование полипротонных кислот (н3ро4)
- •2.6.4. Титрование поликислотных оснований (Na2co3)
- •2.7. Источники ошибок в титриметрическом анализе
- •3. Комплексиметрические методы анализа (комплексиметрия)
- •3.1. Общая характеристика метода
- •3.2. Комплексонометрия
- •3.2.1. Кривые титрования в комплексонометрии
- •3.2.2. Влияние кислотности раствора
- •3.2.3. Влияние дополнительных лигандов
- •3.2.4. Определение точки эквивалентности в методе комплексонометрии. Металлоиндикаторы
- •3.2.5. Особенности метода комплексонометрии
- •4. Окислительно-восстановительное титрование (редоксиметрия)
- •4.1. Общая характеристика метода
- •4.2. Кривые окислительно-восстановительного титрования
- •4.3. Определение точки эквивалентности в методе редоксиметрии
- •4.4. Факторы, влияющие на величину редоксипотенциала
- •4.4.1. Применимость формулы Нернста
- •4.4.2. Влияние ионной силы раствора на величину редоксипотенциала
- •4.4.3. Влияние рН раствора на величину редоксипотенциала
- •4.4.4. Влияние комплексообразования или образования малорастворимых соединений на величину редоксипотенциала
- •4.5. Особенности редоксиметрии
- •4.5.1. Предварительная подготовка пробы к анализу
- •4.5.2. Константы равновесия окислительно-восстановительных реакций
- •4.5.3. Скорость и механизм окислительно-восстановительных реакций
- •4.5.4. Устойчивость водных растворов окислителей и восстановителей
- •4.5.5. Факторы, влияющие на скорость окислительно-восстановительной реакции
- •4.6. Методы окислительно-восстановительного титрования
- •4.6.1. Перманганатометрия
- •4.6.2. Дихроматометрия
- •4.6.3. Хромометрия
- •4.6.4. Иодометрия
- •4.6.5. Ванадатометрия
- •4.6.6. Цериметрия
- •4.6.7. Броматометрия
- •Литература
1.6. Общие приемы титрования
По способу выполнения различают прямое, обратное титрование и титрование заместителя.
Прямое титрование.
При прямом титровании титрант (R) непосредственно добавляют к определяемому (титруемому) веществу (А).
Если определенный объем раствора титранта титруют раствором определяемого компонента, то такой прием называют реверсивным титрованием.
А + R = P, Э(А) = Э(R)
Обратное титрование или титрование по остатку.
Этот метод применяют в следующих случаях:
мала скорость прямой реакции;
отсутствует подходящий индикатор для прямого титрования;
возможны потери определяемого компонента в условиях прямого титрования, например, вследствие улетучивания, окисления и т.д.
Метод обратного титрования реализуется следующим образом: к раствору, содержащему определяемое вещество (А) добавляют заведомо с избытком точно известное количество реагента (R1), затем после протекания реакции определяемого вещества (А) с этим реагентом (R1), оставшееся его количество (R1ост.) оттитровывают подходящим титрантом (R2)
A + R1 (с избытком) = P1 (+ R1ост.);
R1ост. + R2 = P2.
По закону эквивалентов: Э(R1) = Э(A) + Э(R2);
Э(A) = Э(R1) – Э(R2).
ПРИМЕР:
t
CaCO3(тв.) + 2HCl CaCl2 + CO2 + H2O (+ HClост.);
HClост. + NaOH = H2O + NaCl;
Э(CaCO3) = Э(HCl) – Э(NaOH).
Титрование по замещению или титрование заместителя (косвенное титрование).
Метод применяют, если реакция нестехиометрична или протекает медленно. Проводят стехиометрическую реакцию определяемого вещества (А) с вспомогательным реагентом (R1), а образующийся в эквивалентном количестве продукт (P1) оттитровывают подходящим титрантом (R2).
A + R1(вспомогат.) = P1;
P1 + R2 = P2;
Тогда: Э(А) = Э(P1) = Э(R2).
ПРИМЕР:
4NH4Cl + 6CH2O = (CH2)6N4 + 4HCl + 6H2O;
(A) (R1) (P1)
HCl + NaOH = H2O + NaCl.
(P1) (R2)
1.7. Кривые титрования
Рассмотрим реакцию общего типа:
A + RT = P.
В ходе титрования изменяются концентрации всех компонентов, участвующих в реакции. При изменении концентрации веществ изменяется аналитический сигнал, который функционально связан с концентрацией вещества (линейно, логарифмически). Например, в ходе окислительно-восстановительного титрования изменяются равновесные концентрации окислителя и восстановителя, и, следовательно, потенциал; при изменении концентраций компонентов кислотно-основной реакции изменяется рН раствора.
График изменения аналитического сигнала, связанного с концентрацией определяемого вещества, титранта или продукта реакции в процессе титрования называют кривой титрования. Кривые титрования помогают выбрать индикатор, оценить погрешность, наглядно проследить за ходом титрования.
При построении кривой титрования по оси абсцисс обычно откладывается объем добавленного титранта VR (или массу mR), либо степень оттитрованности x.
Степень оттитрованности – доля добавленного количества титранта от его стехиометрически необходимого количества:
![]() ,
,
или
![]() ,
,
где отт.(А) – количество оттитрованного вещества,
0(А) – исходное количество вещества,
(R) – количество добавленного титранта,
стех.(R) – стехиометрически необходимое количество титранта,
V(R) – объем добавленного титранта,
Vстех.(R) – стехиометрически необходимый объем титранта,
В точке эквивалентности (ТЭ) х = 1 или х = 100%. В случае протекания ступенчатых реакций будет наблюдаться несколько ТЭ, тогда для второй точки имеем х = 2 или х = 200% и т.д.
По оси ординат откладывают следующие величины:
логарифм концентрации одного из компонентов lgC(A) или величину, пропорциональную этому логарифму (например, рН), в этом случае получают логарифмическую кривую титрования (рис. 1.2).
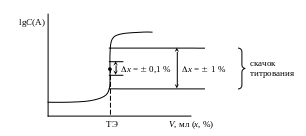
Рис. 1.2. Кривая титрования (логарифмическая)
На логарифмической кривой титрования область резкого изменения логарифма концентрации получила название – скачок титрования. Границы скачка титрования устанавливаются в зависимости от заданной точности титрования (рис. 1.2).
логарифм отношения концентраций
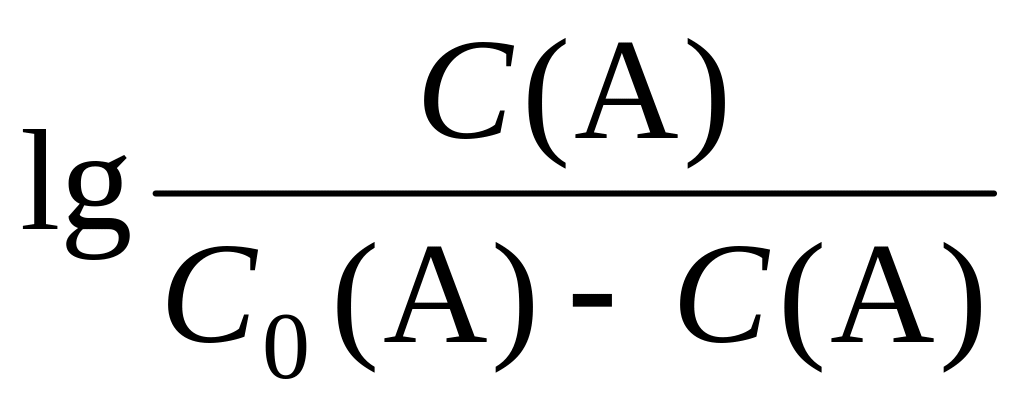 (например, EOx/Red),
в этом случае получают билогарифмическую
кривую титрования. Внешне она похожа
на логарифмическую кривую титрования,
за исключением начальной точки титрования
(до начала добавления титранта), поскольку
эта точка не определена: С(А)
С0(А)
-.
(например, EOx/Red),
в этом случае получают билогарифмическую
кривую титрования. Внешне она похожа
на логарифмическую кривую титрования,
за исключением начальной точки титрования
(до начала добавления титранта), поскольку
эта точка не определена: С(А)
С0(А)
-.концентрация или величина, пропорциональная концентрации (электропроводность), в этом случае получают линейную кривую титрования (рис.1.3).
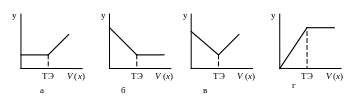
Рис. 1.3. Линейные кривы титрования где аналитический сигнал (у) обусловлен: а – титрантом; б – титруемым веществом; в – титрантом и титруемым веществом; г – продуктом реакции титрования
