
- •Титриметрические методы анализа
- •Содержание
- •1. Общая характеристика титриметрических методов анализа
- •1.1. Требования к химическим реакциям титрования
- •1.2. Классификация реакций, применяемых в титриметрии
- •Кислотно-основное титрование (протолитометрия).
- •Окислительно-восстановительное титрование (редоксиметрия).
- •1.3. Стандартные растворы – титранты
- •1.4. Способы выражения концентрации стандартных растворов
- •1.5. Закон эквивалентов
- •1.6. Общие приемы титрования
- •1.7. Кривые титрования
- •2. Кислотно-основное титрование (протолитометрия)
- •2.1. Теории кислотно-основного взаимодействия
- •2.2. Буферные растворы
- •2.3. Кривые титрования сильных протолитов
- •2.3.1. Титрование сильной кислоты раствором сильного основания
- •2.3.2. Титрование сильного основания раствором сильной кислоты
- •2.3.3. Анализ кривых титрования
- •2.4. Кислотно-основные индикаторы
- •2.5. Титрование слабого протолита сильным протолитом
- •2.5.1. Титрование слабой кислоты сильным основанием
- •2.5.2. Титрование слабого основания сильной кислотой
- •2.5.3. Особенности титрования слабых протолитов
- •2.6. Титрование смеси протолитов , полипротонных кислот, поликислотных оснований
- •2.6.1. Титрование смеси двух кислот – сильной и слабой
- •2.6.2. Титрование двух слабых кислот
- •2.6.3. Титрование полипротонных кислот (н3ро4)
- •2.6.4. Титрование поликислотных оснований (Na2co3)
- •2.7. Источники ошибок в титриметрическом анализе
- •3. Комплексиметрические методы анализа (комплексиметрия)
- •3.1. Общая характеристика метода
- •3.2. Комплексонометрия
- •3.2.1. Кривые титрования в комплексонометрии
- •3.2.2. Влияние кислотности раствора
- •3.2.3. Влияние дополнительных лигандов
- •3.2.4. Определение точки эквивалентности в методе комплексонометрии. Металлоиндикаторы
- •3.2.5. Особенности метода комплексонометрии
- •4. Окислительно-восстановительное титрование (редоксиметрия)
- •4.1. Общая характеристика метода
- •4.2. Кривые окислительно-восстановительного титрования
- •4.3. Определение точки эквивалентности в методе редоксиметрии
- •4.4. Факторы, влияющие на величину редоксипотенциала
- •4.4.1. Применимость формулы Нернста
- •4.4.2. Влияние ионной силы раствора на величину редоксипотенциала
- •4.4.3. Влияние рН раствора на величину редоксипотенциала
- •4.4.4. Влияние комплексообразования или образования малорастворимых соединений на величину редоксипотенциала
- •4.5. Особенности редоксиметрии
- •4.5.1. Предварительная подготовка пробы к анализу
- •4.5.2. Константы равновесия окислительно-восстановительных реакций
- •4.5.3. Скорость и механизм окислительно-восстановительных реакций
- •4.5.4. Устойчивость водных растворов окислителей и восстановителей
- •4.5.5. Факторы, влияющие на скорость окислительно-восстановительной реакции
- •4.6. Методы окислительно-восстановительного титрования
- •4.6.1. Перманганатометрия
- •4.6.2. Дихроматометрия
- •4.6.3. Хромометрия
- •4.6.4. Иодометрия
- •4.6.5. Ванадатометрия
- •4.6.6. Цериметрия
- •4.6.7. Броматометрия
- •Литература
2.6.2. Титрование двух слабых кислот
Рассмотрим процесс титрования смеси двух слабых кислот НА1 и НА2 сильным основанием (например, NaOH). Примем, что исходные концентрации кислот равны: C0(НА1) = С0(НА2) = С0; кислота НА1 более сильная, т.е. K1 K2 (рK1 рK2).
До начала титрования рН раствора определяется ионизацией более сильной кислоты, ионизация более слабой кислоты подавляется:
![]()
До первой точки эквивалентности титруется более сильная кислота:
![]()
В первой точке эквивалентности будет оттитровано (нейтрализовано) x % более сильной кислоты НА1 и частично оттитровано (100 – х) % более слабой НА2.
![]() (2.1)
(2.1)
![]() (2.2)
(2.2)
![]() (2.3)
(2.3)
![]() (2.4)
(2.4)
Выразим величину [H+] в точке эквивалентности, которая обусловлена ионизацией обеих кислот:
![]()
и ![]()
тогда ![]()
с учетом формул (2.1–2.4) получаем:
![]()
![]()
Степень оттитрованности кислоты НА1 в ТЭ1 можно определить следующим образом:
![]()
учитывая, что ![]()
получим: ![]()
но концентрация
ионов [H+]
равна: ![]()
тогда ![]()
разделим числитель и знаменатель на величину К2:
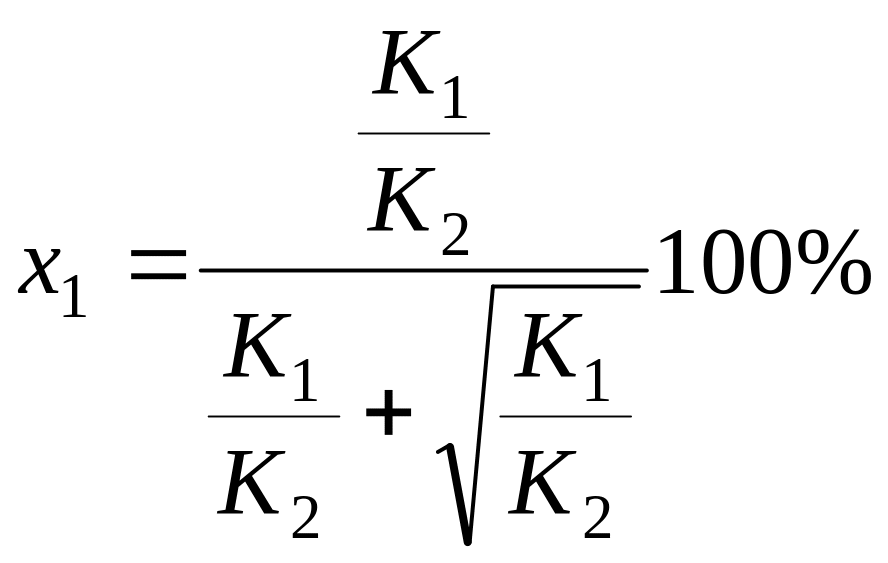
Проанализируем данную формулу:
K1/K2 |
pK |
х1, % |
100 |
2 |
91 |
1000 |
3 |
96,9 |
10 000 |
4 |
99 |
100 000 |
5 |
99,68 |
ВЫВОД:
раздельное титрование двух слабых
кислот с погрешностью 1%
возможно при условии:
![]() ,
pK
4.
,
pK
4.
После ТЭ1 титруется в основном слабая кислота НА2:
![]()
Величина рН в ТЭ2 будет определяться процессом гидролиза соли слабой кислоты НА2:
![]()
2.6.3. Титрование полипротонных кислот (н3ро4)
Этот случай титриметрии аналогичен титрованию нескольких кислот (смесей кислот).
Кислоты, содержащие две и более кислотые группы, называются полипротонными (полиосновными).
Как правило, нейтрализация одной кислотной группировки приводит к перераспределению электронов внутри молекулы, что затрудняет нейтрализацию следующей кислотной группировки. Вследствие этого ионизация таких соединений протекает ступенчато и каждая из стадий характеризуется своей константой ионизации:
H3PO4
=
H+
+ H2PO4, ![]()
H2PO4
= H+
+ HPO42, 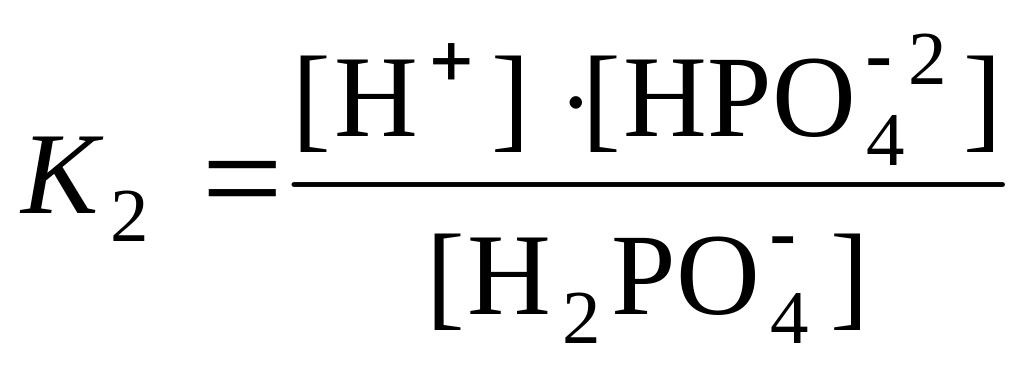
HPO42
= H+
+ PO43, 
Как правило, K1 K2 K3 и т.д. Если отношение , то при титровании наблюдается два раздельных скачка рН, как и в случае титрования смеси двух различных кислот.
Рассмотрим более подробно титрование 0,1 М раствора H3PO4 раствором 0,1 М NaOH.
H3PO4 H2PO4 HPO42 PO43
Ортофосфорная дигидрофосфат- гидрофосфат- ортофосфат-ион
кислота
K1=7,2410-3 K2=6,1710-8 K3=4,5710-13
рK1 = 2,14 рK2 = 7,21 рK3 = 12,34
Концентрация водородных ионов в 0,1 М растворе ортофосфорной кислоты будет определяться в основном константой ионизации по первой ступени:
![]()
![]()
![]()
До первой точки эквивалентности кислота титруется по первой ступени. В растворе H3PO4 и NaH2PO4– буферная смесь. Расчет рН проводится по формуле для буферной смеси:
![]()
![]()
При х1 = 50 % значение рН = рK1 = 2,14.
В ТЭ1 рН раствора определяется концентрацией соли NaH2PO4, которая участвует в процессах ионизации и гидролиза в соответствии с уравнениями:
H2PO4 = HPO42 + H+ (K2)
H2PO4 + Н+ = H3PO4 (K1)
Уравнение материального баланса: [H+] + [H3PO4] = [HPO42].
Равновесные концентрации определяются соответствующими константами равновесия, тогда полученное выражение можно решить относительно [H+]:
![]()
Умножив левую и правую часть полученного уравнения на (K1[H+]), получаем следующее выражение:
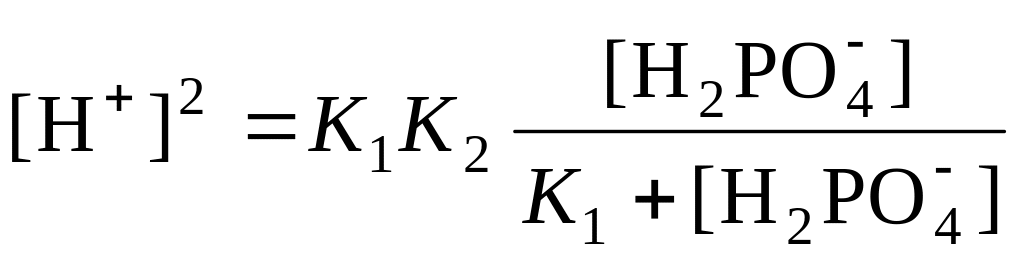
При K1 [H2PO4], что обычно выполняется при титровании не очень разбавленных растворов кислот, можно записать:
![]()
тогда ![]()
Для фиксирования данной точки эквивалентности подойдет индикатор метиловый оранжевый рТ ~ 4.
До второй точки эквивалентности кислота титруется по второй ступени. В растворе смесь NaH2PO4 и Na2HPO4 – буферная смесь. Расчет рН проводим по формуле буферной смеси:
![]()
![]()
При х2 = 50 % величина рН = рK2 = 7,21.
В ТЭ2 в растворе будет находиться в основном соль гидроортофосфат натрия Na2HPO4 и расчет рН аналогичен п.3:
![]()
Можно использовать индикаторы: фенолфталеин (рТ ~ 9), тимолфталеин (рТ ~ 10) и др.
Титрование по третьей ступени. В растворе смесь Na2HPO4 и Na3PO4 – буферная смесь:
![]()
![]()
Для х3 = 50% значение рН = рK3 = 12,34.
В ТЭ3 в растворе находится в основном соль Na3PO4, которая гидролизуется в соответствии с уравнением:
PO43 + H2O = HPO42 + OH.
![]()
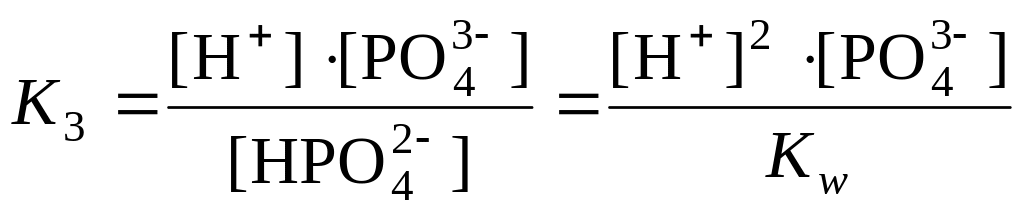
![]()
![]()
После третьей точки эквивалентности рН раствора определяется избыточной концентрацией титранта NaOH:
![]()
Кривая титрования фосфорной кислоты приведена на рис. 2.4.
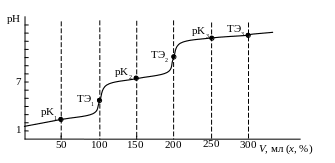
Рис. 2.4. Кривая титрования ортофосфорной кислоты Н3РО4 0,1 М раствором щелочи NaOH 0,1 М
ВЫВОД: Оттитровать ортофосфорную кислоту можно только по первой или второй ступени:
H3PO4 + NaOH = NaH2PO4 + H2O, MЭ(H3PO4) = М(H3PO4);
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, MЭ(H3PO4)= М(H3PO4);
Оттитровать H3PO4 по третьей ступени невозможно, т.к. K3 10-7 (очень мала) и, следовательно, нет четкого перехода, нет скачка титрования. Можно применить косвенный метод титрования заместителя. Для чего в раствор H3PO4 вводят CaCl2 и выделившуюся сильную кислоту титруют щелочью:
2H3PO4
+ 3Ca2+
= Ca3(PO4)2
+ 6H+, MЭ(H3PO4)=![]() М(H3PO4).
М(H3PO4).
