
- •Титриметрические методы анализа
- •Содержание
- •1. Общая характеристика титриметрических методов анализа
- •1.1. Требования к химическим реакциям титрования
- •1.2. Классификация реакций, применяемых в титриметрии
- •Кислотно-основное титрование (протолитометрия).
- •Окислительно-восстановительное титрование (редоксиметрия).
- •1.3. Стандартные растворы – титранты
- •1.4. Способы выражения концентрации стандартных растворов
- •1.5. Закон эквивалентов
- •1.6. Общие приемы титрования
- •1.7. Кривые титрования
- •2. Кислотно-основное титрование (протолитометрия)
- •2.1. Теории кислотно-основного взаимодействия
- •2.2. Буферные растворы
- •2.3. Кривые титрования сильных протолитов
- •2.3.1. Титрование сильной кислоты раствором сильного основания
- •2.3.2. Титрование сильного основания раствором сильной кислоты
- •2.3.3. Анализ кривых титрования
- •2.4. Кислотно-основные индикаторы
- •2.5. Титрование слабого протолита сильным протолитом
- •2.5.1. Титрование слабой кислоты сильным основанием
- •2.5.2. Титрование слабого основания сильной кислотой
- •2.5.3. Особенности титрования слабых протолитов
- •2.6. Титрование смеси протолитов , полипротонных кислот, поликислотных оснований
- •2.6.1. Титрование смеси двух кислот – сильной и слабой
- •2.6.2. Титрование двух слабых кислот
- •2.6.3. Титрование полипротонных кислот (н3ро4)
- •2.6.4. Титрование поликислотных оснований (Na2co3)
- •2.7. Источники ошибок в титриметрическом анализе
- •3. Комплексиметрические методы анализа (комплексиметрия)
- •3.1. Общая характеристика метода
- •3.2. Комплексонометрия
- •3.2.1. Кривые титрования в комплексонометрии
- •3.2.2. Влияние кислотности раствора
- •3.2.3. Влияние дополнительных лигандов
- •3.2.4. Определение точки эквивалентности в методе комплексонометрии. Металлоиндикаторы
- •3.2.5. Особенности метода комплексонометрии
- •4. Окислительно-восстановительное титрование (редоксиметрия)
- •4.1. Общая характеристика метода
- •4.2. Кривые окислительно-восстановительного титрования
- •4.3. Определение точки эквивалентности в методе редоксиметрии
- •4.4. Факторы, влияющие на величину редоксипотенциала
- •4.4.1. Применимость формулы Нернста
- •4.4.2. Влияние ионной силы раствора на величину редоксипотенциала
- •4.4.3. Влияние рН раствора на величину редоксипотенциала
- •4.4.4. Влияние комплексообразования или образования малорастворимых соединений на величину редоксипотенциала
- •4.5. Особенности редоксиметрии
- •4.5.1. Предварительная подготовка пробы к анализу
- •4.5.2. Константы равновесия окислительно-восстановительных реакций
- •4.5.3. Скорость и механизм окислительно-восстановительных реакций
- •4.5.4. Устойчивость водных растворов окислителей и восстановителей
- •4.5.5. Факторы, влияющие на скорость окислительно-восстановительной реакции
- •4.6. Методы окислительно-восстановительного титрования
- •4.6.1. Перманганатометрия
- •4.6.2. Дихроматометрия
- •4.6.3. Хромометрия
- •4.6.4. Иодометрия
- •4.6.5. Ванадатометрия
- •4.6.6. Цериметрия
- •4.6.7. Броматометрия
- •Литература
3.2.1. Кривые титрования в комплексонометрии
Особенности комплексонометрического титрования лучше всего рассмотреть при построении и анализе теоретических кривых титрования.
Кривые титрования (по аналогии с методом протолитометрии) строят в координатах: отрицательный логарифм концентрации иона определяемого элемента (–lgCMe = pMe) – объем добавленного титранта в мл или %% от стехиометрически необходимого количества.
ПРИМЕР.
Кривая титрования ионов Ca+2 (C0 = 0,01 моль/л, V0 – объем раствора) раствором ЭДТА (Ст = 0,01 М) при рН = 11–12.
Ca+2 + H2Y-2 = CaY-2 + 2H+ lgCaY = pKCaY = 10,6
(CaY = 1/KCaY)
До начала титрования исходная концентрация ионов кальция С0 = 0,01 М.
pMе = pCa = -lgC0 = 2
В процессе титрования до точки эквивалентности.
Поскольку устойчивость комплексного иона CaY2- высока, то можно считать, что количество связанного в комплексный ион кальция равно количеству добавленного титранта.
Доля оттитрованного кальция:
![]()
отсюда: ![]()
Концентрация свободных (не связанных в комплекс) ионов кальция:
![]()
(без учета разбавления)
![]()
![]() ,
где х=(100
– х)
,
где х=(100
– х)
В точке эквивалентности концентрация свободных ионов кальция определяется ионизацией комплексного иона CaY-2:
![]()
отсюда ![]()
![]()
![]()
После точки эквивалентности в растворе избыток комплексона III, диссоциация комплекса подавляется, концентрация катионов Ca2+ в растворе уменьшается.
Концентрация комплексного иона в растворе: [CaY2-] C0.
Избыточная концентрация титранта:
![]()
![]()
Используя константу
образования комплексоната кальция
![]() ,
найдем концентрацию кальция в растворе:
,
найдем концентрацию кальция в растворе:
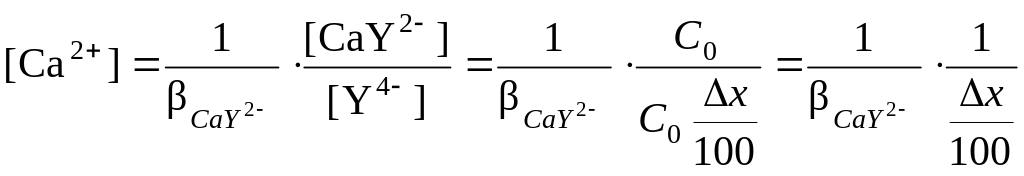
![]() ,
где х
= (х
– 100).
,
где х
= (х
– 100).
Если х 100 (т.е. х 200 %), то рМе lg.
Составим таблицу значений рМе и построим кривую титрования (рис. 3.1):
Vт, мл (х, %) |
[Ca+2], моль/л |
pCa |
0 |
0,01 |
2 |
50 |
510-3 |
2,3 |
90 |
110-3 |
3 |
99 |
110-4 |
4 |
99,9 |
110-5 |
5 |
100 |
510-7 |
6,3 |
100,1 |
2,510-8 |
7,6 |
101 |
2,510-9 |
8,6 |
110 |
2,510-10 |
9,6 |
200 |
– |
10,6 (lg) |
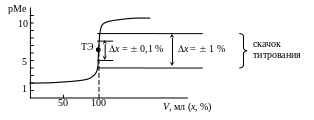
Рис. 3.1. Кривая титрования ионов Са2 (С0 = 0,01 М) раствором комплексона III (Ст = 0,01 М) (рН ~ 11–12)
Скачок титрования: ![]()
![]()
Чем больше С0(Ме) и чем более устойчив комплекс MY (чем больше MY), тем больше величина скачка титрования.
Можно считать, что
скачок титрования
![]() является минимально возможным для
правильного поведения комплексонометрического
анализа, тогда, в случае х
=
1 %,
является минимально возможным для
правильного поведения комплексонометрического
анализа, тогда, в случае х
=
1 %, ![]()
х
=
0,1 %, ![]()
С другой стороны если С0 min = 0,01 M, то титровать с погрешностью не хуже 1 % можно элементы, для которых устойчивость комплексов характеризуется lgMеY 810, т.е. 1081010 (K 10-810-10).
3.2.2. Влияние кислотности раствора
При расчете кривой титрования мы считали, что равновесная концентрация [Y4-] не зависит от концентрации водородных ионов. Однако, это в общем случае, неверно. Для определения действительной равновесной концентрации ионов [Y4-], входящей в константу устойчивости комплексного иона [MYn-4], необходимо учесть процесс ионизации ЭДТУ, которая является 4-х основной кислотой:
H4Y H3Y- H2Y2- HY3- Y4-
K1 = 1,010-2 K2 = 2,110-3 K3 = 6,910-7 K4 = 5,510-11
pK1 = 2 pK2 = 2,7 pK3 = 6,2 pK4 = 10,3
Кроме этого в сильнокислых растворах (рН 2) необходимо учитывать образование цвиттер-ионов H5Y+ и H6Y2+ (растворимость ЭДТУ в HCl резко возрастает).
Суммарная концентрация ЭДТА в растворе определяется суммой всех форм (ионных и молекулярной), присутствующих в растворе (при рН 2 можно не учитывать цвиттер-ионы):
СЭДТА = [Y4-] = [Y4-] + [HY3-] + [H2Y2-] + [H3Y-] + [H4Y].
Выразим молярную долю свободных ионов [Y4-], которые участвуют в образовании комплекса:
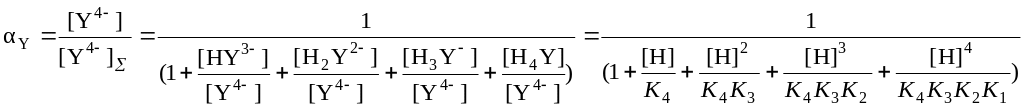
В большинстве
практических расчетов (особенно при
рН 6) можно
пренебречь степенными членами по Н+,
т.е.
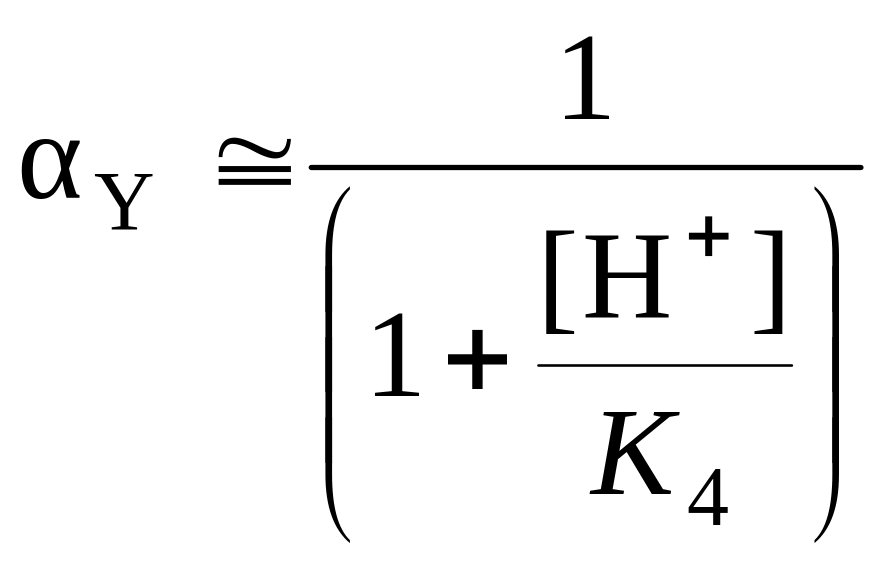
pH |
2 |
3 |
4 |
5 |
6 |
8 |
9 |
10 |
11 |
12 |
Y |
3,710-14 |
2,510-11 |
3,310-9 |
410-7 |
2,210-5 |
510-3 |
0,05 |
0,35 |
0,83 |
0,98 |
Таким образом, с уменьшением рН (повышением кислотности) доля и соответственно концентрация свободных ионов [Y4–] уменьшается и пропорционально уменьшается концентрация комплексного соединения металла [MYn-4] (при данной концентрации ЭДТА).
Рассмотрим титрование ионов Са2+ (С0 = 0,01 M) раствором комплексона III, как и в разделе 3.2.1, но при трех значениях рН: рН = 5
рН = 9
рН = 11
Реакция титрования: Ca2+ + H2Y2- = CaY2- + 2H+
В исходном растворе pCa = pC0 = 2.
Титрование до точки эквивалентности. На начальном участке кривой титрования, когда концентрация ионов металла велика, изменение рН раствора практически не влияет на величину рМе. Расчет можно проводить по формуле (раздел 3.2.1):
В точке эквивалентности незначительная концентрация Ca2+, обусловленная диссоциацией комплексного соединения, существенно зависит от рН. При расчете равновесной концентрации свободных ионов металла в константу образования комплексного иона необходимо подставлять концентрацию [Y4-] = Y[Y4-].
С учетом того, что [CaY2-] C0, [Ca2+] [Y4-], получаем:
![]()
из чего следует:
![]()
![]()
Таким образом,
значение рМе в точке эквивалентности
уменьшается (поскольку 1)
на величину
![]() по сравнению с теоретическим значением.
по сравнению с теоретическим значением.
После точки эквивалентности при расчете равновесной концентрации свободных ионов металла также необходимо учесть, что:
[Y4-] = Y[Y4-],
[CaY-2] Co,
![]()
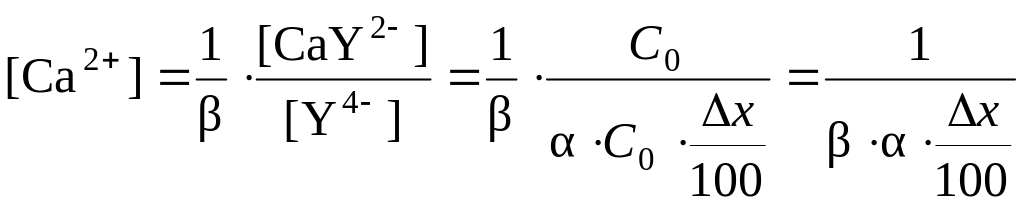
![]()
Таким образом, конечная ветвь титрования смещается вниз на величину lg по сравнению с теоретической кривой титрования.
Таким образом, для выбранных трех значений рН получаем следующие данные:
-
pH
Y
lgY
1/2 lgY
5
410-7
-6,4
-3,2
9
0,05
-1,3
-0,65
11
0,83
-0,08
-0,04
Кривые титрования при данных значениях рН приведены на рис. 3.2.
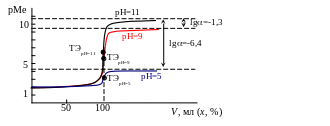
Рис. 3.2. Кривая титрования ионов Са2+ (С0 = 0,01 М) раствором комплексона III (Ст = 0,01 М) при значениях рН=5, рН=9, рН=11
Величина скачка титрования с учетом рН уменьшается на величину lgY:
![]()
Если принять исходную концентрацию металла С0 = 0,01 М, рМеmin = 2, то оттитровать такой раствор с погрешностью х = 0,11 % возможно, если lgYMеY = 108, т.е. условная константа образования комплекса YMеY = 1010108. Чем выше кислотность раствора (чем меньше рН), тем меньше Y и тем более устойчивым должен быть комплекс при прочих равных условиях.
ВЫВОДЫ:
Если MеY = 1091015, то титрование возможно только в щелочной среде при рН 10 (Ca2+, Mg2+, Fe2+, Mn2+, UO22+ и др.). Кроме того, необходимо принимать меры, чтобы в процессе титрования кислотность растворов не повышалась (при титровании на 1 моль ЭДТА выделяется 2 моля Н+).
Если MеY 1020, титровать можно в кислой среде при рН = 24 (Bi3+, Co3+, Fe3+, Th4+, U4+, Zr4+ и др.).
Для стабилизации рН раствора в ходе титрования вводят буферные растворы, например, аммиачный буфер (NH3H2O + NH4Cl) с рН = 9-10, ацетатный буфер (HAc + NaAc) с рН = 4-5 и др.
