
- •1.Общие положения
- •1.1. Экономические и экологические аспекты коррозии
- •1.2. Классификация корррозионных процессов.
- •1.3 Цели и методы коррозионных исследований
- •2. Теоретические основы химической коррозии
- •2.1. Коррозия металлов в жидких неэлектролитах
- •2.2. Газовая коррозия металлов
- •Контрольные вопросы.
- •3. Теория электрохимической коррозии
- •3.1. Механизм электрохимической коррозии
- •3.1.1. Коррозионные гальванические элементы
- •3.1.2. Термодинамическая возможность электрохимической коррозии. Стандартные электродные потенциалы
- •3.1.3. Обратимые электродные потенциалы. Уравнение Нернста
- •3.1.4. Необратимые электродные потенциалы. Диаграммы Пурбе.
- •3.2. Кинетика коррозионных процессов
- •3.2.1. Кинетика электродных процессов
- •Iкорр » k ÖaNa(Hg) (3.14.)
- •3.2.2. Коррозионные диаграммы
- •3.2.3. Кинетика катодных процессов
- •3.2.4. Кинетика анодных процессов
- •3.3. Пассивность металлов. Теории, практическое применение.
- •3.4. Многоэлектродные системы
- •3.5. Определение тока коррозии методом поляризационного сопротивления
- •3.6. Внутренние и внешние факторы электрохимической коррозии
- •3.6.1. Внутренние факторы электрохимической коррозии
- •3.6.2. Внешние факторы электрохимической коррозии
- •Контрольные вопросы
- •4. Методы защиты от коррозии
- •4.1. Защита металлов от коррозии покрытиями
- •4.1.1. Металлические защитные покрытия
- •4.1.2. Неметаллические неорганические защитные покрытия
- •4.1.3. Органические защитные покрытия
- •Взаимодействие лкм с твердой поверхностью
- •Способы нанесения лкм на поверхность
- •Органические защитные покрытия
- •4.2. Электрохимическая защита
- •4.2.1. Катодная защита
- •4.2.3. Анодная защита
- •4.2.4. Электрическая дренажная защита
- •4.3. Защита металлов от коррозии обработкой коррозионной среды
- •4.3.1. Ингибиторная защита
- •4.3.1.1. Ингибиторы кислотной коррозии металлов
- •4.3.1.2. Ингибиторы коррозии металлов в воде и водных растворах солей
- •4.3.1.3. Ингибиторы атмосферной коррозии металлов
- •4.3.1.4. Ингибиторы коррозии металлов в неводных жидких средах
- •4.3.2. Удаление и ввод кислорода.
- •4.3.3. Образование солевых пленок из солей жесткости
- •4.4. Защита металлов от коррозии путем воздействия на конструкцию
- •4.4.1. Предотвращение контактной коррозии.
- •4.4.2. Учет влияния напряженного состояния на скорость коррозии.
- •4.4.3. Учет распределения температуры между элементами конструкции
- •Контрольные вопросы
- •5. Примеры решения задач.
- •6. Лабораторный практикум
- •6.4.Оксидирование алюминия
- •6.5.Электролитическое цинкование стали
- •6.6.Фосфатирование стали
- •Рекомендуемая литература:
4.3.1.2. Ингибиторы коррозии металлов в воде и водных растворах солей
В качестве ингибиторов коррозии металлов в воде и водных растворах солей используют:
- окислители-пассиваторы, уменьшающие скорость коррозии металлов за счет торможения анодного процесса - нитриты, хроматы, бихроматы щелочных металлов и др. Окислитель в водном растворе играет роль дополнительного деполяризатора, облегчает протекание катодного процесса и тем самым способствует переводу металла в пассивное состояние (см. рис. 4.3.1.). Пассиваторы являются хорошими, но опасными ингибиторами. При неверно выбранной концентрации, в присутствии ионовCl- или при несоответствующей рН среды, они могут вызвать очень опасную точечную коррозию; - соединения, образующие нерастворимые пленки вторичных продуктов коррозии в результате взаимодействия с продуктами анодной или катодной реакций - фосфаты Na3PO4, Na2HPO4, полифосфаты Na3P3O10 и др., силикаты Na2SiO3, соли цинка, марганца и кальция, некоторые органические вещества, например, амины, тиолы (меркаптаны) и др. При этом переход металла в пассивное состояние облегчается за счет снижения минимального критического тока пассивации (см. рис. 4.3.2.а).);
соединения, уменьшающие начальную поляризуемость анодного процесса, что также может облегчить переход металла в пассивное состояние (см. рис. 4.3.2.б).). Органические ингибиторы адсорбируются только на поверхности металла и не адсорбируются на продуктах коррозии. Поэтому их весьма часто применяют при кислотном травлении металлов для очистки последних от ржавчины, окалины и накипи.
Рис.
3.3.1. Принцип ингибирующего действия
окислителей-пассиваторов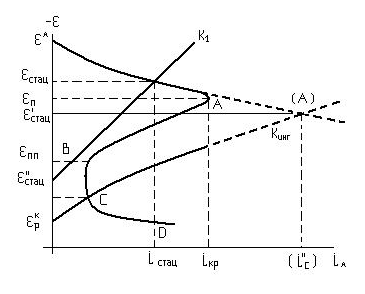
Наиболее широкое применение в качестве органических ингибиторов нашли: ПБ-8 - продукт конденсации моноэтаноламина с уротропином, бензоат натрия, бензоат и трехзамещенный фосфат моноэтаноламина, октадециламин C18H37NH2, гексадециламин C16H33NH2 и др. Уменьшение скорости коррозии при введении в раствор этих органических ингибиторов связано с образованием на поверхности нерастворимых пленок.
Подобные пленки способны ингибировать анодное растворение металла не только за счет чисто барьерного адсорбционного механизма, но и благодаря присущим им свойствам ионообменной мембраны, контролирующей доставку анионов к поверхности металла. Разработан принципиально новый подход к проблеме ингибирования питтинговой коррозии: создавая на поверхности металла адсорбционный модифицирующий слой, обладающий высокой селективностью по отношению к ионам-ингибиторам, можно существенно снизить концентрацию этих ионов, необходимую для обеспечения устойчивой пассивации.
4.3.1.3. Ингибиторы атмосферной коррозии металлов
По характеру действия и свойствам ингибиторы атмосферной коррозии подразделяют на:
- контактные, действие которых ограничено местом их соприкосновения с поверхностью защищаемого металла;
- летучие, которые отличаются высокой упругостью пара, способны насыщать замкнутое пространство своими парами и защищать изделия от атмосферной коррозии за счет образования адсорбционных пленок.
Рис.
4.3.2. Принцип ингибирующего действия
соединений, образующих нерастворимые
пленки (а) и соединений, снижающих
начальную поляризуемость анодного
процесса (б).
В качестве контактного ингибитора широко используется нитрит натрия, образующий на поверхности металла пассивную пленку. Его применяют:
- для межоперационной защиты стальных деталей путем смачивания в 10-15% растворе NaNO2 и 0,5% Na2CO3;
- для антикоррозионной обработки деталей, предназначенных для длительного хранения, путем пассивирования в горячем растворе, содержащем 25-30% NaNO2 и 0,3-0,6% Na2CO3, или путем упаковки в оберточную бумагу, пропитанную 10-15% раствором NaNO2, а затем в сухую парафиновую бумагу;
- для защиты от коррозии деталей в процессе обработки резанием путем введения в смазочно-охлаждающие жидкости от 0,2 до 2% NaNO2.
В качестве летучих замедлителей коррозии применяют различные органические и неорганические соединения: нитриты замещенных аминов ( дициклогексиламина, диизопропиламина, диизобутиламина, дибензиламина, моноэтаноламина и др.), сложные эфиры карбоновых кислот (n-бутилбензоат, моноэтанолбензоат), хроматы циклогексиламина, дициклогексиламина, гексилметилдиамина, неорганические диаммонийные соединения (углекислый аммоний, углекислый аммиакат меди), смеси некоторых летучих веществ с нитритом натрия (нитрит-уротропиновая смесь, нитрит-фосфатная смесь и др.) и т. п.
