
- •Введение
- •Тема № 1. Значение продукции овощеводства, плодоводства и виноградарства в питании человека. План:
- •2. Значение условий хранения и переработки плодоовощной продукции, круглогодичное рациональное питание.
- •3. Перспективы развития отрасли хранения и переработки плодоовощной продукции.
- •1. Хранение плодов в регулируемой газовой среде (ргс)
- •2. Хранение плодов по системе са и ulo.
- •3. Применение озона при хранении свежих овощей и фруктов
- •4. Роль метаболических процессов, протекающих в плодах и овощах, в получении высококачественного урожая, и создании оптимальных условий для его хранения.
- •5. Улучшение биологической, энергетической и пищевой ценности плодов и овощей как способ получения продуктов для качественного питания.
- •Тема № 2. Характеристика основных компонентов химического состава плодоовощной продукции (значение для людей, растений и во время хранения и переработки). План:
- •Строение и свойства биоорганических молекул.
- •Функции биомолекул в живых организмах.
- •2. Белки. Аминокислоты. Классификация белков и их характеристика.
- •Строение и свойства ак:
- •Свойства ак:
- •Классификация ак
- •Классификация ак по особенностям r-групп
- •Биосинтез ак
- •Химическое строение белка. Характеристика основных связей в белковой молекуле.
- •Ковалентные
- •Нековалентные связи
- •Уровни структурной организации белков.
- •Классификации белков.
- •Классификация белков по форме.
- •Классификация по растворимости.
- •Классификация по наличию небелковых компонентов.
- •Физико-химические свойства белков:
- •3. Нуклеотиды и нуклеиновые кислоты.
- •4. Углеводы. Характеристика углеводов. Моно-, ди- и полисахариды. Клетчатка, пектиновые вещества. Значение углеводов. Общая характеристика.
- •Классификация углеводов.
- •Строение углеводов.
- •Синтез, распад и превращение углеводов в растении.
- •5. Растительные липиды, их физиологическое значение.
- •Состав растительных масел.
- •Основные константы масел.
- •Прогоркание и гидрогенизация масел.
- •Биосинтез и распад липидов в растительном организме.
- •6. Витамины. Классификация. Водорастворимые и жирорастворимые витамины.
- •Характеристика водорастворимых витаминов.
- •Потребность в витаминах у растений.
- •Динамика аскорбиновой кислоты в плодах и овощах.
- •7. Элементы минерального питания. Макро- и микроэлементы, их значение для людей, животных и растений.
- •Макроэлементы:
- •Микроэлементы:
- •Эфирные масла.
- •Фенольные соединения, их свойства, разнообразие и роль в растительном организме.
- •5. Полимерные фенольные соединения. К ним относятся:
- •Общая характеристика и функции гликозидов.
- •Алкалоиды и их роль в растении.
- •Тема № 3. Физико-химические основы биохимических процессов. План:
- •Механизм действия ферментов (гипотеза индуцированного соответствия – д. Кошланд):
- •Энергия активации.
- •Единицы измерения активности ферментов.
- •Классификация ферментов.
- •Зависимость скорости ферментативных реакций от температуры и реакции среды (рН), концентрации фермента и субстрата.
- •Ферменты класса гидролаз, амилазы, инвертазы, пектолитические и протеолитические ферменты.
- •Дегидрогеназы: флавиновые ферменты, маликодегидрогеназа, глюкозодегидрогеназа, цитродегидрогеназа и т.Д.
- •Оксиредуктазы: пероксидаза, полифенолоксидаза, аскорбиноксидаза, каталаза, цитохромоксидаза. Участие оксиредуктаз в основном процессе обмена – дыхании.
- •Активность ферментов в свежих плодах и овощах. Активность ферментов в ходе переработки плодов и овощей. Использование пектолитических ферментов в процессе переработки плодоовощной продукции.
- •Процесс ингибирования. Понятие об ингибиторах. Ингибиторы ферментативных реакций.
- •Список рекомендованной литературы
Химическое строение белка. Характеристика основных связей в белковой молекуле.
В белковых молекулах есть ковалентные (более прочные) и нековалентные (относительно слабые) химические связи.
Ковалентные
Пептидная связь (ковалентная) – характеризуется тем, что:
находится в одной плоскости.
образуется в результате взаимодействия –СООН (–СОО-) одной АК и –NH2 (–NH3+) другой АК, в результате реакции дегидратации.
водород в аминогруппе почти всегда занимает транс- положение по отношению к кислороду и карбоксильной группе.
каждая пептидная связь образует максимальное количество водородных связей.
Связь C–N– является частично двойной из-за взаимодействия электронной пары азота с электронной системой карбоксильной группы, что ограничивает вращение вокруг этой связи.

Пептидная связь.
Дисульфидная связь – образуется в результате отщепления 2-х атомов водорода от остатков цистеина.

Дисульфидная связь.
Нековалентные связи
Водородная связь >С = О…..H–N<
Гидрофобная – образуется в результате сближения неполярных групп.
Ионная связь (солевая, электровалентная), образуется между – СОО- и +H3N –
Уровни структурной организации белков.
Первичная структура – число и последовательность аминокислот в полипептидной цепи, соединённых друг с другом пептидными связями.
Вторичная структура – упорядоченное расположение гибких полипептидных цепей, возникающих за счёт водородных связей.
α-спираль
-складчатый слой
суперспирализация – тройная спираль.
Третичная структура – это способ сворачивания белков в глобулу, поддерживается связями 3-х типов: ионные, водородные, дисульфидные, а также гидрофобными взаимодействиями.







1 домен 2 домен 3 домен
Гидрофобные цепи оказываются внутри глобулы, а гидрофильные – снаружи, вокруг в результате этого образуется гидратная оболочка.
Четвертичная структура – это способ укладки полипептидных цепей относительно друг друга.
Mr ≥ 50.000 – олигомеры, состоят из 2-х и более полипептидных цепей.


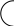
 гемм
гемм


α-субъединица
глобула

β-субъединица
Гемоглобин.
Классификации белков.
Классификация, основанная на биологических функциях:
1. Белки ферменты – каталитическая функция (рибонуклеазы, лигазы, рестриктазы, карбоксилазы и т.д.).
2. Транспортные белки – транспортная функция, отвечают за перенос низкомолекулярных соединений через мембрану (транслоказы (во внутренней мембране митохондрий (адениннуклеотидтраслоказа)), цитохромы (электротранспортазы) – в дыхательной цепи).
3. Запасные белки – запасная функция.
4. Сократительные белки – тубулин (микротрубочки).
5. Структурные белки – структурные белки мембран.
6. Яды – защитная функция – яды – рицин (касторка, клещевина).
7. Репрессорные белки (регулируют биосинтез блокирующей части ДНК).
8. Регуляторные белки (гормоно-рецепторные комплексы, бактериородопсин (энергию света переводит в химическую энергию)).
Другие белки: монелин (в африканских растениях).
