- •Абсолютная и относительная погрешности.
- •2. Классификация погрешностей
- •По форме представления:
- •2. По причине возникновения:
- •3. По характеру проявления:
- •5. Генеральная и выборочная совокупность
- •6. Среднее арифметическое выборочной совокупности. Случайное отклонение.
- •7. Выборочное стандартное отклонение. Дисперсия
- •8. Среднеквадратичное отклонение
- •9. Нормальное распределение
- •10. Распределение Стьюдента
- •11. Требование к пробе анализа. Генеральная, средняя, лабораторная и анализируемая проба
- •12. Отбор проб газов, жидкостей и твердых веществ.
- •13. Отбор проб пищевой продукции и продовольственного сырья.
- •14. Общие принципы подготовки проб к анализу
- •15. Метод разложения проб
- •16. Растворение проб
- •17. Сплавление пробы
- •18. Пиролиз пробы
- •19. Метод разделения и концентрирования
- •20. Сущность титриметрии
- •21. Стандартизация растворов титрантов
- •22. Точка эквивалентности
- •23. Точка конца титрования
- •24. Кривые титрования
- •Кривая титрования реакции кислотно-оснавного взаимодействия между нсi и NaOh
- •Кривая титрования слабой кислоты и сильного основания
- •Кривая титрования многоосновных кислот и оснований
- •25. Способы титрования
- •26. Индикаторы и правила выбора индикатора
- •27. Гальванический элемент
- •28. Общие принципы электрохимических методов анализа. Классификация электродов и электродных систем.
- •29. Метод прямой кондуктометрии
- •30. Безэлектродная кондуктометрия
- •31. Кондуктометрическое титрование
- •32. Сущность потенциометрического анализа.
- •33. Методы прямой потенциометрии
- •34. Электроды сравнения и индикаторный электрод
- •35. Ионоселективные электроды
- •1. Первичные:
- •2. Сложные и многомембранные
- •36. Методы потенциометрического титрования
- •38. Сущность кулонометрического анализа.
- •42. Схема установки полярографического анализа
- •43. Методы полярографии
- •44. Метод дифференциальной полярографии
- •45. Инверсионная вольтамперометрия
- •48. Основы хроматографии:
- •50. Хромотографич колонки:
- •52. Радиоактивность. Методы регистрации радиоактивности
42. Схема установки полярографического анализа
1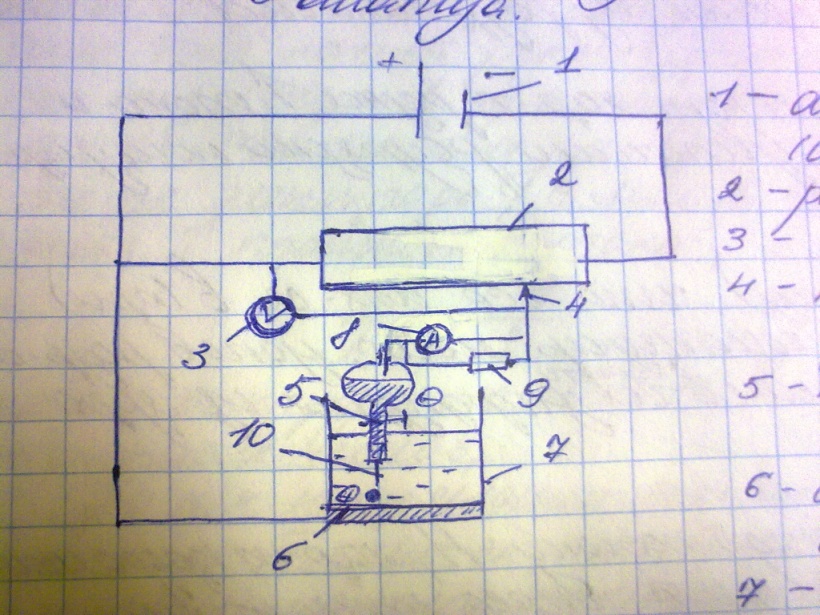 -аккумулятор
-аккумулятор
2-реастат
3-вольтметр
4-подвижный контакт реастата
5-капельный ртутный катод (электрод)
6-широкий ртутный анод(электрод)
7-электролизер с анализируемым раствором
8-амперметр
9-шунтирующее сопротивление
10-каппиляр капельного катода
Капельный ртутный электрод содержит трубку с ртутью и платиновым контактом.
Из трубки, ртуть, попадаетв ртутный резервуар, из которого по капилляру вытекает в виде капелек в электролит, который находится в электролизере(7). Поверхность капли ртути, пока она не оторвалась от капилляра и по составу и по размеру остается почти неизменной, поэтому потенциал разряжения каждого иона не меняется.
Затем потенциальное разряжение начинает менятся, такая капля не пригодна длая анализа. Однако в это время она отрывается от электрода и не участвуют в электролизе, а на ее месте образуется новая, с обновленной поверхностью, через которую и проходит анализ.
Постепенно перемещ. Подвижный контакт(4) по реастату(2), плавно увеличивая напряжение электродов(5) и (6), которая меняется с помощью вольтметра(3), а силу тока в электролизере определяется с помощью амперметра(8). Параллельно подключается шунтирующий резистор(9), позволяющий использовать 1 и тот же амперметр(8), для достаточно точного определения, как слабых, так и сильных, если концентрация ионов велика.
43. Методы полярографии
Методы полярографии. 1. Метод градуировочного графика. При этом методе снимают несколько полярограмм стандартных образцов, по высоте Н и концентрации С строят градуировочный график, чаще всего это прямая проходящая от начала координат: Н = f(C). По высоте волны Н неизвестного образца определяют его концентрацию про градуировочному графику.
2. Метод стандарта. В это методе присутствуют строго определенные условия, в которых снимают полярограммы стандартного и анализируемого раствора. Концентрацию неизвестного раствора находят по следующей формуле: Сх=Сст* (Нх/Нст) , где Нх,ст – высота волны, искомого раствора и стандартного. Сст – концентрация стандартного растворо. 3. Метод добавок. В этом методе учитывают линейный характер зависимости Iх = к*Сх . Если в раствор добавить известное количество стандартного раствора то сила тока изменяется и станет равной в соответствии с этой зависимостью Iх+ст = к(Сх+Сст). Сх определяют , поскольку Сст известно, а Iх.
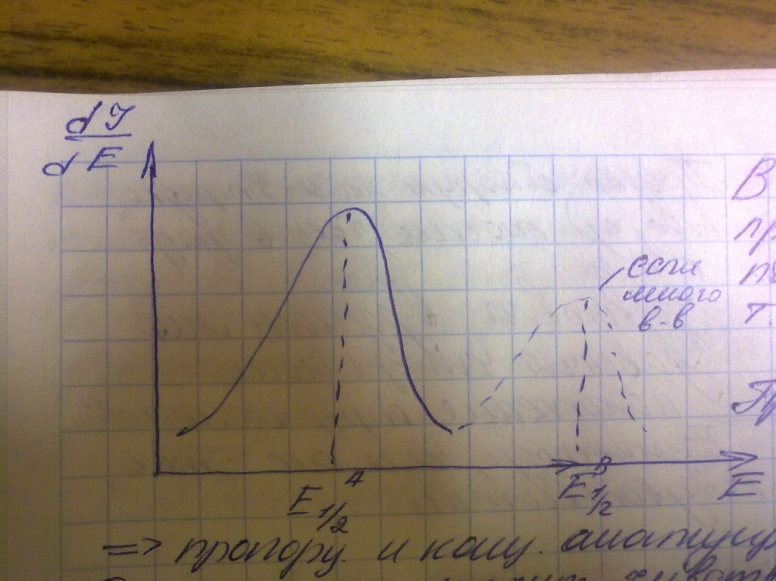
44. Метод дифференциальной полярографии
Этот метод применяется для анализа смесей содержащих вещества с близкими параметрами полуволн.
В этом случае зависимость представляет собой набор пиков с мах в точках соответствующих потенциалов полуволн.
Этот метод, значительно чувствителен, чем другие методы полярографии.
Дифференцированные кривые получают либо графическое дифференцирование, с помощью специальных электрических схем.