
- •2В: Необратимые поликонденсационные процессы.
- •2.Влияние основных факторов на поликонденсацию в расплаве.
- •2.Поликонденсация в расплаве. Кинетика процесса.
- •3.Полимераналогичные превращения. Реакционная спос-сть полимеров.
- •Передача цепи через растворитель, мономер, инициатор, регулятор мм полимера.
- •Типы и характер реакций поликонденсации.
- •Стадии поликонденсационных процессов. Образование реакционных центров.
- •Способность мономера к радикально-цепной полимеризации.
- •Катионная полимеризация. Инициирование процесса.
- •3.Стадии поликонденсационных процессов. Ступенчатый рост цепей.
- •1. Регулирование и ингибирование радикальной полимеризации.
- •2 Кинетика поликонденсации.
- •3 Циклизация при полимеранологичных превращениях.
- •1. Предельная температура процесса. Влияние давления и конверсии на радикальную полимеризацию.
- •2. Поликонденсация в растворе. Роль растворителя в процессе
- •Поликонденсация в растворе, влияние бинарных растоврителей.
- •Побочные реакции при поликонденсации в расплаве.
Типы и характер реакций поликонденсации.
Многие химические реакции монофункциональных веществ (нуклеофильного и элсктрофильного замещения, присоединения, рекомбинации, координации) при осуществлении их на полифункциональных соединениях приводят к образованию цепных молекул. При синтезе полимеров к названию типа реакции органической химии добавляется приставка «поли». Каждый тип реакций поликонденсации подразделяют с учетом специфики протекающих превращений. Например, процессы полизамещения включают реакции полиэтерификакии:
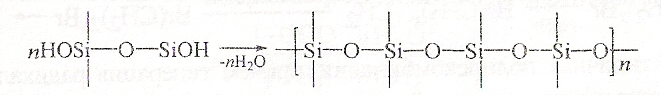
полипереэтерификации:
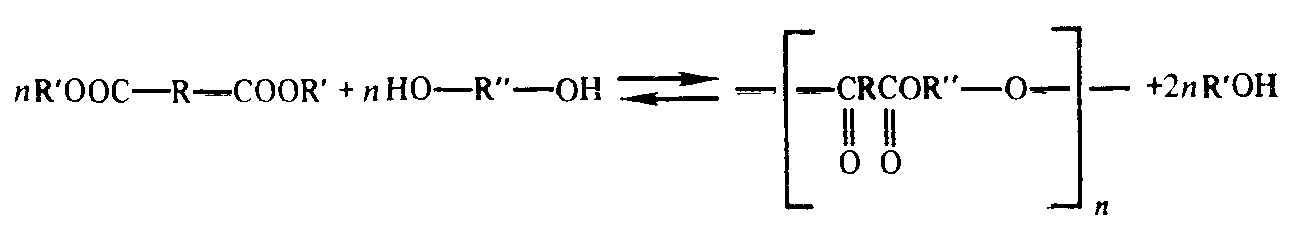
где R*= CH3, R”= C2H5.
полиамидирования:
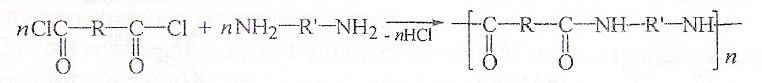
полиалкилирования:
 и
др.
и
др.
К радикальным процессам поликонденсации относятся реакции полирекомбинации. При нагревании мономера с подвижным атомом водорода в присутствии перекиси образуется алкильный радикал, который способен к рекомбинации:
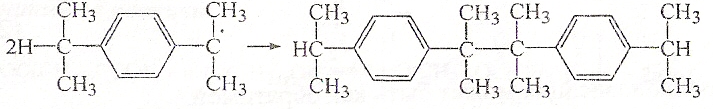 ,
,
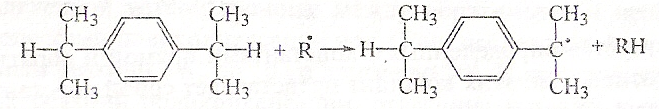
Далее происходит отрыв третичного атома водорода от димера и последующая рекомбинация образовавшегося радикала с ему подобным. В результате радикальная по механизму реакция приводит к ступенчатой конденсации цепи:
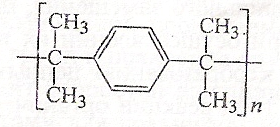
Второй пример радикального ступенчатого процесса - получение полиэтилена поликонденсационньм методом:
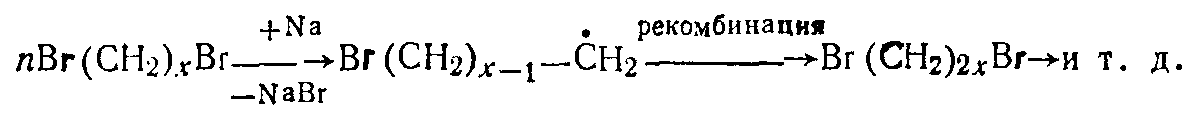
Это типичная полирекомбинация, при этом генерация раликов осуществляется за счет взаимодействия концевых С-Вг-связей с натрием.
Поликоординация, используемая для синтеза полимеров хелатной (клешневидной) структуры, обычно сопровождается и процессами замещения. Так, при взаимодействии дифенилфосфоновой кислоты с диацетатами металлов М(ОСОСНз): выделяется уксусная кислота и образуются полимеры мостиковой структуры с «выравненными» связями между центральным атомом Р и атомами кислорода:
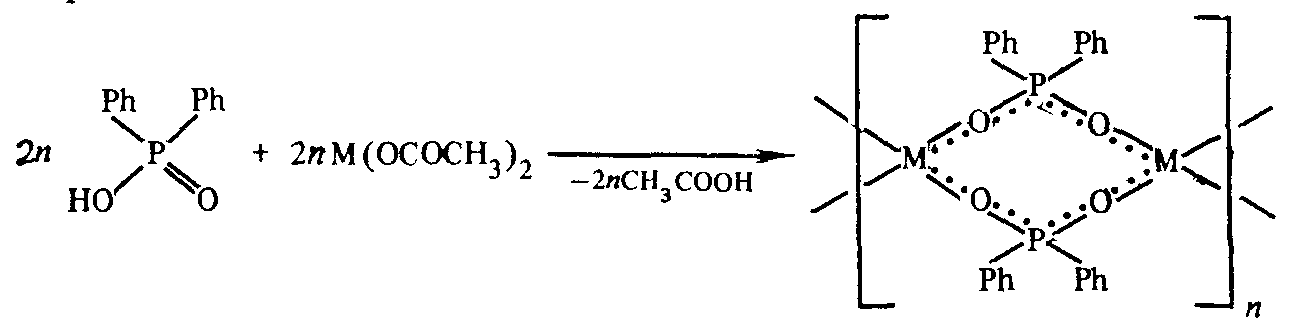
Стадии поликонденсационных процессов. Образование реакционных центров.
Ступенчатые процессы синтеза, так же как и цепные, включают три основные стадии: образование реакционных центров; ступенчатый рост цепей; прекращение роста цепей.
Образование реакционных центров. Многие мономеры с ОН-, СООН-. ROCO-. С1СО-, H2N, HS- и другими функциональными группами содержат реакционные центры, например атомы Н, способные к химическим реакциям при определенной температуре и наличии катализатора.
По механизму образования активных центров полнконденсационные процессы классифицируют на катионную, анионную, ионно-координационную, свободно-радикальную поликонденсацию. Примером первого типа могут быть реакции полиэтерификации и полиамидировання. катализируемые протонами. Механизм реакции включает протонирование карбоксильной группы:
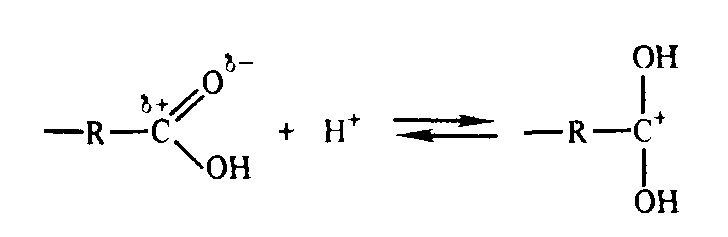
(Источник H+ - исходная или специально вводимая кислота) и последующую атаку ионом карбония OH- группы гликоля:
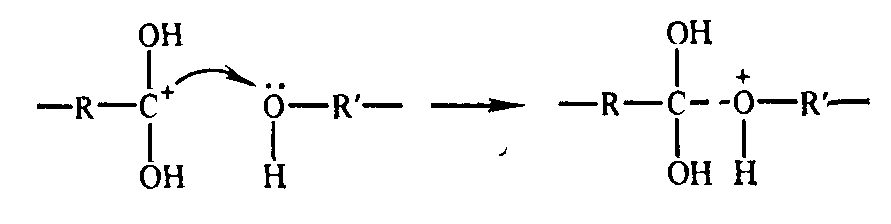
Оксоновый катион стабилизируется эли минированием протона, который, присоединяясь к одной из ОН-групп, способствует последующему отщеплению воды:
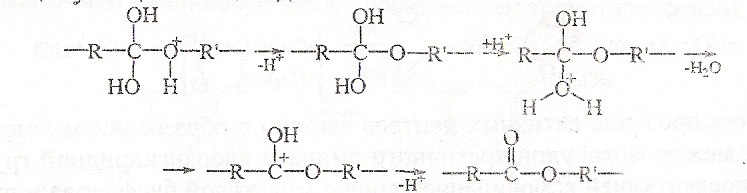
При полиамидировании процесс начинается с протонирования аминогруппы мономера и взаимодействия образовавшегося аммонийного катиона с карбоксильной группой:
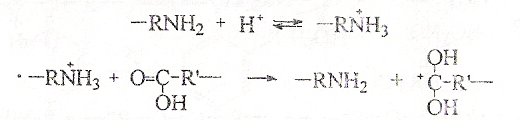
Дальнейшее превращение реакционного центра (карбкатиона) аналогично приведенному выше механизму:
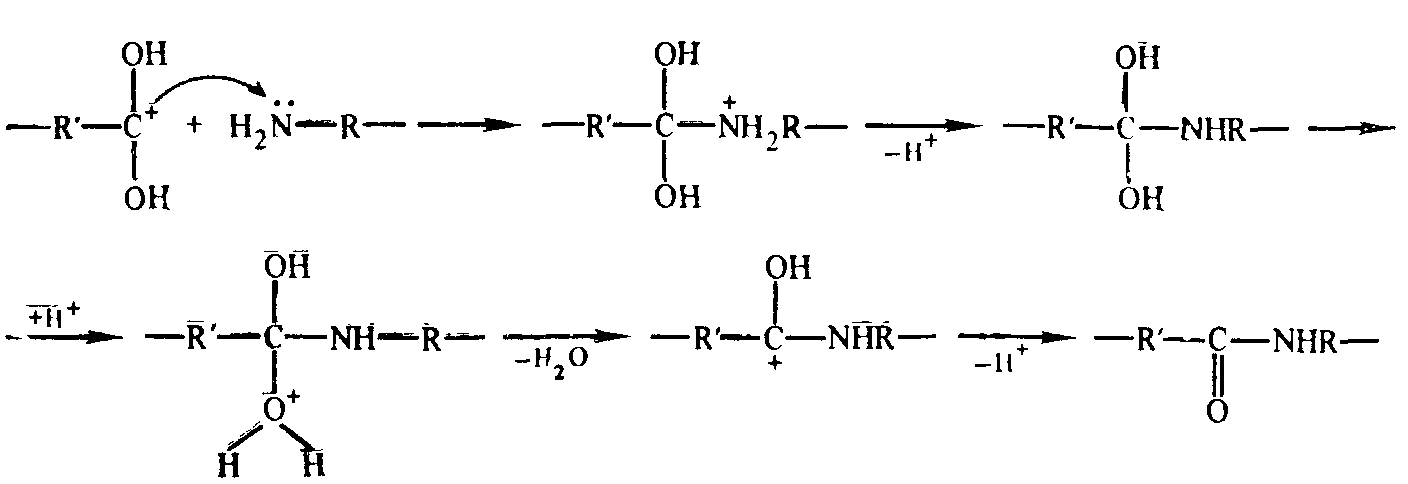
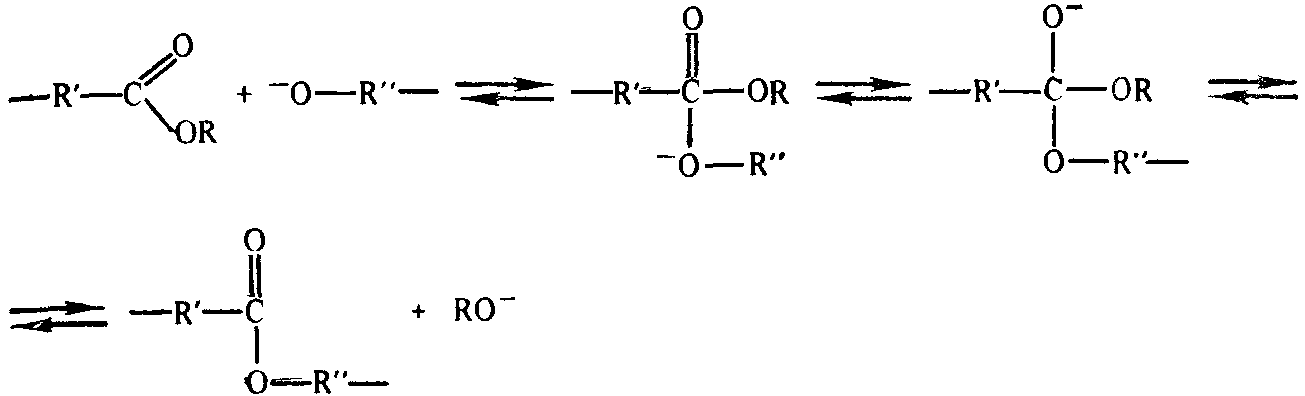
Примером анионной поликонденсации является катализируемая гликолятами щелочных металлов полипереэтерификация эфиров дикарбоновых кислот гликолями:

Образование активного центра связано с атакой гликолевого аниона на атом углерода карбонильной группы и образованном оксониевого аниона, превращение которого с элиминированием аниона RО- приводит к формированию межзвенной связи между реагирующими олигомерами:
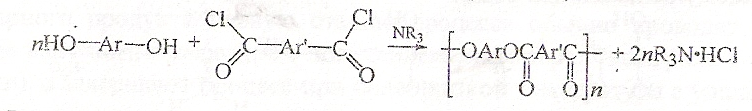
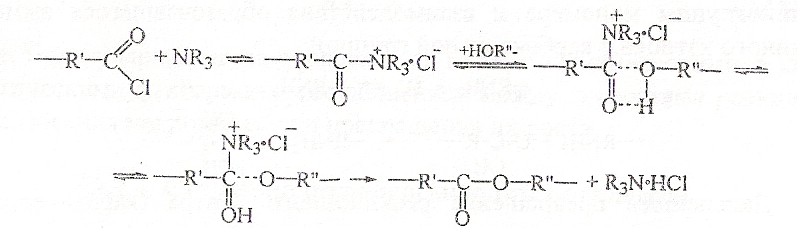
Ионно-координационный механизм характерен идя поликонденсации дихлорангидридов дикарбоновых кислот с бисфенолами в присутствии третичных аминов (синтез полиарилатов):
Формирование активных центров связано с образованием ионной связи между молекулой третичного амина и хлорангидридной группой, последующей координацией соли с молекулой бисфенола и превращениями по схеме:
Примером, когда функциональные группы формируются непосредственно в поликонденсационном процессе, служит образование фенолформальдегидных смол в присутствии ионных катализаторов - кислот, щелочей, солей органических оснований:
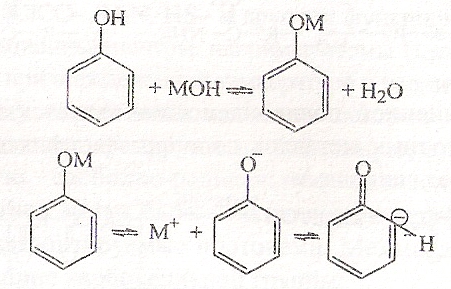
Атом щелочного металла М способен к перераспределению электронной плотности в ядре с локализацией ее в орто-положении, которое к атакуется молекулой альдегида RCOH:
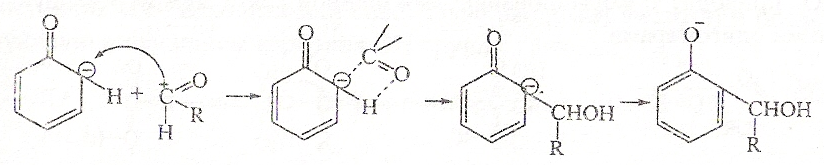
С близкой скоростью может идти замещение атома водорода в пара-положении фенола.
При избытке альдегида происходит дальнейшее замещение атомов Н в цикле о- или п-метинолфенолов с образованием триметилолфенола:
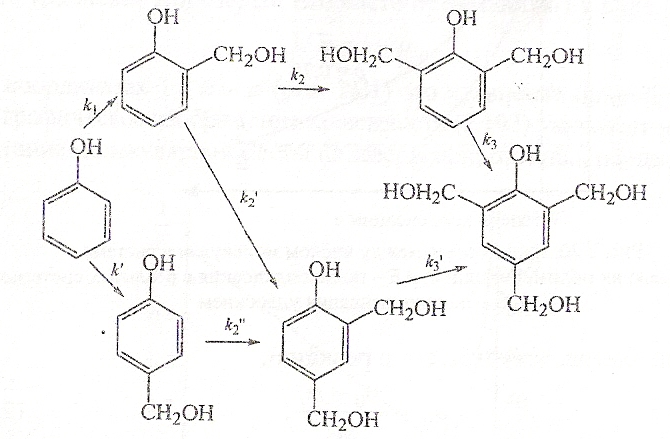
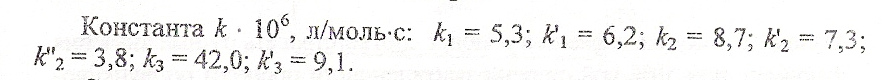
БИЛЕТ № 6:
