
- •В.Н. Захарченко Курс физической химии
- •Часть 1. Химическая термодинамика
- •Предисловие
- •Основные обозначения
- •Введение
- •Системы
- •Энергия и способы ее обмена между средой и системой
- •Параметры системы. Процессы
- •Теплота. Тепловое равновесие. Нулевое начало термодинамики
- •Уравнения состояния
- •Глава 1. Первое начало термодинамики
- •Глава 2. Термохимия
- •Глава 3. Процессы с идеальным газом
- •Глава 4. Второе начало термодинамики
- •Глава 5. Характеристические термодинамические функции
- •Глава 6. Системы переменного состава. Химический потенциал
- •Глава 7. Химическое равновесие
- •Глава 8. Фазовые превращения и фазовые равновесия
- •Глава 9. Коллигативные свойства растворов и осмотические явления
- •Глава 10. Непрерывные системы
- •Глава 11. Элементы статистической термодинамики
- •Глава 12. Основные понятия термодинамики неравновесных процессов
- •Приложения
- •Предметный указатель
- •Глава 1. Первое начало термодинамики 21
- •Глава 2. Термохимия 26
- •Глава 3. Процессы с идеальным газом 39
- •Глава 4. Второе начало термодинамики 53
- •Глава 5. Характеристические термодинамические функции 72
- •Глава 6. Системы переменного состава. Химический потенциал 89
- •Глава 7. Химическое равновесие 111
- •Глава 8. Фазовые превращения и фазовые равновесия 130
- •Глава 9. Коллигативные свойства растворов и осмотические явления 165
- •Глава 10. Непрерывные системы 174
- •Глава 11. Элементы статистической термодинамики 180
- •Глава 12. Основные понятия термодинамики неравновесных процессов 194
Глава 2. Термохимия
2 - 1. Химические реакции
Химическая реакция рассматривается как процесс, приводящий к качественным изменениям в системе.
Примем следующую обобщенную форму записи химической реакции:
1A1+2A2++iAi+=1`A1`+2`A2 `++j `Aj `+ (2 - 1)
В уравнении (2 - 1) использованы следующие обозначения:
A1,A2,,Ai,,A1`,A2`,,Aj`, - символы веществ, вступающих в реакцию и образующихся в ходе реакции (объединенное название - участники реакции),
1,2,i,1`,2`,j`, - стехиометрические коэффициенты.
Записываемые в левой части равенства вещества принимаются вступающими в реакцию и часто называются исходными веществами. Другое их название - реактанты.
Вещества, записываемые в правой части равенства, считаются образующимися в результате реакции. Для них используются названия: конечные вещества или продукты реакции.
При проведении термодинамических расчетов часто записывают реакции, которые реально не могут быть осуществлены. В качестве примера проведем реакцию получения анилина в результате прямого взаимодействия бензола с аммиаком:
C6H6 + NH3 = C6H5NH2 + H2.
Воображаемое проведение реакций, в том числе и реально невозможных, является одной из особенностей использования термодинамических методов.
Термодинамические расчеты принято проводить для реакции в целом и на 1 моль выбранного вещества. В первом случае количества реагирующих веществ, выражаемых в молях, равны стехиометрическим коэффициентам. Например, расчеты в целом для реакции
2H2 + O2 = 2H2O
проводятся из условия, что в реакцию вступают 2 моль водорода и 1 моль кислорода, а в результате реакции образуется 2 моль воды. При расчетах на 1 моль выбранного вещества могут применяться дробные стехиометрические коэффициенты. В частности, для расчетов, связанных с образованием 1 моль воды, эта же реакция должна быть записана следующим образом:
H2 + 1/2O2 = H2O.
Приведем еще один пример. Для расчетов, связанных с получением 1 моль оксида алюминия из металлического алюминия и кислорода, эта реакция должна быть записана следующим образом:
2Al + 3/2O2 = Al2O3 .
Наиболее часто расчеты на 1 моль выбранного вещества проводятся для реакций образования и реакций сгорания.
Реакциями образования называются реакции (в том числе и воображаемые, т.е. проводимые мысленно), приводящие к получению 1 моль данного вещества из простых веществ. Покажем еще несколько примеров реакций образования:
2Na + S + 2O2 = Na2SO4,
Fe + 3/2Cl2 = FeCl3,
2Na + 1/2H2 + P + 2O2 = Na2HPO4.
Реакциями сгорания называются реакции, относящиеся обычно к взаимодействию органических соединений с кислородом и приводящие к их окислению до CO2 и H2O. Приведем примеры реакций сгорания:
C4H10 + 13/2O2 = 4CO2 + 5H2O,
C6H12O6 + 6O2 = 6CO2 + 6H2O.
В реакциях сгорания соединений, содержащих азот, серу, галогены, конечными продуктами, кроме диоксида углерода и воды, принимаются соответственно N2, SO2, и HF, HCl, HBr и т.д. Например:
C6H5NH2 +31/4O2 = 6CO2 + 7/2H2O + 1/2N2,
ClCH2COOH + 3/2O2 = 2CO2 + H2O + HCl,
C2H5SH +9/2 O2 = 2CO2 + 3H2O + SO2.
Агрегатное состояние вещества чаще всего указывают с помощью нижнего индекса.
В реакциях
C6H5NH2(ж) + 31/4O2(г) = 6CO2(г) + 7/2H2O(ж) + 1/2N2(г)
Zn(кр) +1/2O2(г) = ZnO(кр)
анилин и вода являются жидкостями, кислород, диоксид углерода и азот - газами, а цинк и оксид цинка - твердыми кристаллическими веществами.
В некоторых случаях кристаллическую природу твердого вещества установить крайне трудно. В связи с этим указывают, что просто вещество находится в твердом состоянии, используя символ (тв). Если же вещество имеет несколько кристаллических модификаций, то указывают, какая именно принимает участие в данной реакции.
2 - 2. Тепловые эффекты реакций
Тепловым эффектом реакции называют теплоту, которая выделяется системой или поглощается при проведении реакции.
Почти всегда реакции проводят либо при постоянном объеме, для чего реагенты помещают в замкнутый сосуд с жесткой оболочкой, либо при постоянном давлении.
Теплота при постоянном объеме, как указывалось в предыдущей главе, для простой системы равна изменению внутренней энергии системы U, а теплота при постоянном давлении равна изменению энтальпии Н.
Если в ходе реакции теплота выделяется из системы, т.е. U<0 или H<0, то реакция называется экзотермической. Поглощение системой теплоты, чему отвечает U>0 или H>0, происходит при эндотермической реакции. Реакции, не сопровождающиеся тепловым эффектом, называются атермическими.
Изучение тепловых эффектов химических реакций и влияние на них внешних факторов (главным образом температуры) составляет предмет одного из важнейших разделов термодинамики - термохимии.
Изучение тепловых эффектов реакций проводится с конца XVIII в. Первые исследования в этой области были проведены А. Лавуазье и П. Лапласом. Ими была предложена одна из первых конструкций прибора для термохимических исследований - калориметра. Техника калориметрических измерений в течение двух столетий непрерывно совершенствовалась. В настоящее время точность приводимых данных по калориметрии для многих реакций превышает 0,01%.
В термодинамике анализируются не только реально протекающие реакции, но и воображаемые процессы.
Например, вполне реальной является реакция
CH4(г) + 2O2(г) = CO2(г) + 2H2O(ж),
теплоту которой при постоянном давлении обозначим H(d).
Реакция
CO2(г) + 2H2O(ж) = CH4(г) + 2O2(г),
тепловой эффект которой обозначим H( r), в обычных условиях невозможна.
Теплоты обеих реакций связаны соотношением
H( r) = -H(d).
Общее правило в этом случае такое же, как и для всех термодинамических процессов:
Теплота обратной реакции равна теплоте прямой реакции, взятой со знаком минус.
2 - 3. Закон Гесса и следствия из него
В предыдущем параграфе указывалось, что в простой системе при постоянном объеме теплота химической реакции равна изменению внутренней энергии, а при постоянном давлении - изменению энтальпии:
QV=U и QP=H. (2 - 1)
Так как внутренняя энергия и энтальпия являются функциями состояния, то и теплота химической реакции в простой системе при постоянном объеме или при постоянном давлении приобретает те же свойства, что и изменение термодинамических функций (внутренней энергии или энтальпии), а именно: независимость от пути процесса (приращение функций зависит только от начального и конечного состояния системы) и аддитивность.
Поскольку в данном случае процессом является химическая реакция, ее путь состоит из определенных стадий с образованием различных промежуточных соединений. Следовательно, от этих стадий не должна зависеть суммарная теплота реакции.
Этот результат является следствием первого начала термодинамики.
Он был открыт Г.И. Гессом в 1840 г. еще до того, как было сформулировано первое начало термодинамики.
Приведем уточненную формулировку закона Гесса:
Тепловой эффект реакции, проводимой при постоянном объеме или при постоянном давлении без совершения полезной работы, не зависит от стадий реакции, а определяется только начальным и конечным состоянием веществ.
Чтобы подчеркнуть, что закон Гесса применим только к простым системам, при его формулировке указывается, что система не совершает полезную работу.
В некоторых случаях для того, чтобы воспользоваться законом Гесса, сложную систему, совершающую полезную работу, приходится превращать в простую систему.
Например, гальванический элемент (батарейка для питания электронной аппаратуры или электрический аккумулятор) в обычном виде является сложной системой, так как совершает электрическую работу. Если его поместить в калориметр, а затем подключить к устройствам, потребляющим электрическую энергию, то прямыми измерениями его температуры оценить теплоту протекающей реакции не удается. Часть энергии из системы утекает к потребляющему ее устройству. Чтобы воспользоваться законом Гесса, эту утечку необходимо предотвратить. С этой целью электрическую цепь следует замкнуть внутри калориметра. Таким образом, гальванический элемент в ходе реакции уже не совершает полезную работу и превращается в простую систему.
Особое значение для накопления термохимических данных и создания справочной литературы, позволяющей проводить термохимические расчеты на основе справочных величин, имеют следствия из закона Гесса.
Первое следствие из закона Гесса
Возьмем в качестве примера проводимую при постоянном давлении следующую реакцию:
2NaOH + H2SO4 = Na2SO4 + 2H2O, (а)
теплоту которой обозначим НХ.
Пусть известны теплоты образования из простых веществ всех участников реакции:
Na + 1/2O2 + 1/2H2 = NaOH Hf NaOH,
H2 +S +2O2 = H2SO4 Hf H2SO4 ,
2Na + S + 2O2 = Na2SO4 Hf Na2SO4,
H2 + 1/2O2 = H2O Hf H2O.
Мысленно проведем реакцию (а) при постоянном давлении.
Вначале получим из веществ, вступающих в реакцию (NaOH, H2SO4) и взятых в количествах, равных стехиометрическим коэффициентам, простые вещества. Общая теплота этой стадии окажется равной (-2HfNaOH -НfS H2O4). Затем из простых веществ получим продукты реакции в количествах, равных стехиометрическим коэффициентам. Теплота этой стадии равна (HfNa2SO4 + +2HfH2O).
Суммарная теплота всего процесса равна
HX = (HfNa2SO4 + 2HfH2O) - (2HfNaOH + HfH2SO4).
Обобщая полученный результат, для любой реакции можно записать
H = j`HfAj` - iHfAi (2 - 2)
U = j`UfAj` - iUfAi (2 - 3)
В равенствах (2 - 2) и (2 - 3) система обозначений согласуется с записанной в общей форме реакцией (2 - 1).
Равенства (2 - 2) и (2 - 3) являются математической записью первого следствия из закона Гесса:
Теплота реакции, проводимой при постоянном давлении (или при постоянном объеме), равна разности суммы умноженных на стехиометрические коэффициенты изменений энтальпии (или внутренней энергии) реакций образования продуктов реакции и суммы с учетом стехиометрических коэффициентов изменений энтальпии (или внутренней энергии) реакций образования исходных веществ.
Второе следствие из закона Гесса
Первым следствием из закона Гесса очень трудно пользоваться для расчета теплоты реакции с участием органических соединений. Синтез органических соединений очень часто проводится через большое число стадий с небольшими выходами. Поэтому прямые измерения теплоты образования органических соединений во многих случаях невозможны.
Однако подавляющее большинство органических соединений прекрасно горит в среде кислорода и теплоты сгорания органических соединений сравнительно легко определимы.
Покажем использование этой особенности органических соединений на следующем примере.
Мысленно проведем реакцию
3 HCCH + H2C=CH2 C6H5-CH2-CH3, (b)
ацетилен этилен этилбензол
теплоту которой обозначим НY.
Теплоты сгорания органических соединений таковы:
C2H2 + 5/2O2 = 2CO2 + H2O HcombC2H2,
C2H4 + 3 O2 = 2CO2 + 2H2O HcombC2H4,
C8H10 +21/2 O2 = 8CO2 + 5H2O HcombC8H10,
Вообразим, что эта же реакция (b) может протекать иным путем.
Вначале сгорают исходные вещества, взятые в количествах, равных стехиометрическим коэффициентам. Теплота реакции на этой стадии равна (3HcombC2H2 + HcombC2H4). Далее пусть из образовавшихся в результате сгорания исходных веществ диоксида углерода и воды получаются этилбензол и кислород. Теплота реакции на второй стадии равна (-HcombC8H10). Суммарный тепловой эффект реакции равен
HY = (3HcombC2H2 + HcombC2H4) - HcombC8H10.
Обобщение результата можно представить в следующих формах:
для реакций, протекающих при постоянном давлении,
H = iHcombAi + j`HcombAj` (2 - 4)
для реакций, протекающих при постоянном объеме,
U = iUcombAi + j`UcombAj` (2 - 5)
Равенства (2 - 4) и (2 - 5) выражают второе следствие из закона Гесса:
Теплота реакции, проводимой при постоянном давлении (или при постоянном объеме), равна соответственно разности умноженных на стехиометрические коэффициенты сумм изменений энтальпии (или внутренней энергии) реакций сгорания исходных веществ и продуктов реакции.
2 - 4. Влияние температуры на тепловой эффект реакции. Уравнения Кирхгофа
Температура может оказывать существенное влияние на тепловой эффект химической реакции. Иногда значительное изменение температуры может изменять даже знак теплового эффекта (переход от экзотермической реакции к эндотермической или от эндотермической к экзотермической).
Уравнение, характеризующее влияние температуры на тепловой эффект химической реакции, можно вывести следующим образом.
Пусть энтальпии исходных веществ и продуктов реакции в соответствии с реакцией (2 - 1) равны
HA1, HA2, ..., HAi,... HA1`, HA2,` ..., HAj`,...
энтальпии энтальпии
исходных веществ продуктов реакции
Суммарная энтальпия исходных веществ выражается так:
Н1= iHAi ,
а суммарная энтальпия продуктов реакции равна
H2 = j`HAj .`
Переход из исходного состояния в конечное, т.е. протекание реакции, приводит к изменению энтальпии
H = H2 - H1 = j`HAj` - iHAi , (2 - 6)
представляющему собой тепловой эффект реакции.
Дифференцируя равенство (2 - 6) по температуре при постоянном давлении, получим
![]() .
(2 - 7)
.
(2 - 7)
Напомним, что производная энтальпии вещества k по температуре является теплоемкостью при постоянном давлении
![]() .
.
Поэтому равенство (2 - 7) приобретает следующий вид:
![]() (2 - 8)
(2 - 8)
Уравнение ( 2 - 8), отражающее зависимость теплового эффекта от температуры, называется уравнением Кирхгофа в дифференциальной форме.
Еще один тип уравнения Кирхгофа в дифференциальной форме относится к реакциям, проводимым при постоянном объеме:
![]() (2 - 9)
(2 - 9)
Интегрирование дифференциальных уравнений Кирхгофа в температурных пределах от Т1 до Т2 дает
 (2 - 10)
(2 - 10)
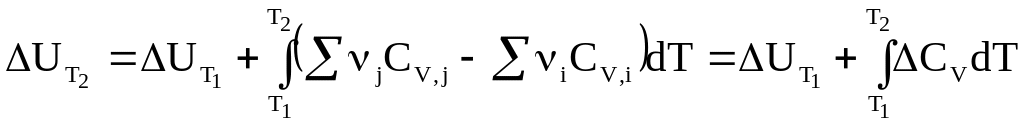 (2 - 11)
(2 - 11)
Обращаем внимание на то, что разности, заключенные в скобки, в уравнениях (2 - 10) и (2 - 11) затем обозначены символами CP и CV.
Уравнения (2 - 10) и (2 - 11) называются
уравнениями Кирхгофа в интегральной
форме. В них входят теплоты реакции
при температуре Т1 (![]() )
и при температуре Т2 (
)
и при температуре Т2 (![]() ).
).
Уравнения Кирхгофа позволяют рассчитывать тепловые эффекты реакций в широком диапазоне температур, используя только справочные данные. В частности, теплоту реакции при определенной температуре можно рассчитать на основе первого или второго следствия из закона Гесса, а затем по известным из справочной литературы значениям теплоемкости тепловой эффект рассчитывается для другой температуры.
В справочниках зависимость теплоемкости веществ от температуры, как правило, приводится в виде степенных рядов следующих типов:
CP = a + bT + cT2 + ...
CP = a + bT + c`T-2
Диапазон температур, для которого температурная зависимость теплоемкости выполняется, четко оговаривается. Проведение вычислений при температурах, выходящих за пределы (особенно верхние) диапазона, недопустимо.
Уравнения Кирхгофа позволяют решать и некоторые качественные задачи. Например, зная, что теплоемкость пара всегда меньше теплоемкости жидкости, можно утверждать, что с повышением температуры теплота (изменение энтальпии) испарения жидкости уменьшается.
2 - 5. Стандартное термохимическое состояние
Применение закона Гесса и уравнений Кирхгофа для проведения расчетов тепловых эффектов реакций требует соблюдения ряда жестких ограничений. Несоблюдение условий, при которых должны приводиться расчеты, может привести к ошибочным результатам. В качестве иллюстрации изложенного рассмотрим проводимую в калориметре реакцию:
2NaOH + H2SO4 = Na2SO4 + H2O.
Для этого смешаем кристаллы щелочи с серной кислотой и определим экспериментально сопровождающее смешивание реагентов изменение энтальпии Не . Сравним полученный тепловой эффект с результатами расчета по первому следствию из закона Гесса, для чего используем справочные данные по теплотам образования из простых веществ гидроксида натрия в кристаллической форме, серной кислоты в виде жидкости, кристаллов сульфата натрия и жидкой воды. Расчетное значение изменения энтальпии Нс будет заметно отличаться от Не. Дело в том, что условия экспериментального определения теплоты смешивания щелочи с кислотой не совпадают с условиями применения закона Гесса. После реакции в калориметре остаются вместе кристаллы сульфата натрия и воды, а они взаимодействуют друг с другом, образуя, в частности, кристаллогидраты типа Na2SO410H2O. Теплота этого процесса, не учтенная при расчете, вызывает различия между обоими результатами.
Приведенный пример позволяет сделать следующий вывод:
Для расчета теплового эффекта реакции на основе закона Гесса вещества, вступающие в реакцию и после ее проведения, должны находиться в том состоянии, в котором они приводятся в справочниках (чистые вещества в виде кристаллов, включая кристаллогидраты, жидкостей или газов).
Исторически сложилось так, что экспериментальное определение тепловых эффектов реакций проводилось при разных температурах. Например, первые конструкции калориметров содержали погружаемый в лед стакан, в котором протекала реакция. Выделяющаяся теплота оценивалась по массе растаявшего льда. Естественно, что тепловой эффект, найденный подобным образом, относился к 273 К. Другие измерения проводились при «комнатной» температуре, за которую одни исследователи принимали 18 оС, а другие - 20 оС. Полученные разными авторами результаты часто оказывались несопоставимыми, так как они относились к разным условиям, что затрудняло работу по накоплению термохимических данных для справочников. В связи с этим Международный союз по чистой и прикладной химии (International Union of Pure and Applied Chemistry), сокращенно именуемый IUPAC, предложил все термохимические данные относить только к одной температуре: 25 оС, или 298 К. Эта температура является стандартной термохимической температурой.
Тепловой эффект реакции, особенно с участием газов, может зависеть от давления. Поэтому давление, при котором оценивается теплота реакции, также было стандартизировано. В качестве стандартного было принято давление, равное 1 атм = 1,01325105 Па.
Следующий стандарт связан с кристаллической формой простых веществ, из которых образуются соединения. Например, для реакции
С(кр) + O2 (г) = CO2 (г)
углерод можно использовать как в виде графита, так и в виде алмаза. Реакция кислорода с каждой из перечисленных кристаллических модификаций сопровождается разными тепловыми эффектами. Существует несколько кристаллических модификаций серы, олова, фосфора и т.д. С использованием каждой из них можно получить отличающуюся от других теплоту образования химического соединения. В связи с этим было предложено для определения теплоты образования или сгорания соединения использовать только ту модификацию, которая наиболее устойчива при температуре 298 К и давлении1,013105 Па. В частности, при этих условиях наиболее устойчивой кристаллической модификацией углерода является графит, фосфора - белый фосфор, серы - моноклиническая сера и т.д. Нельзя использовать для определения теплоты образования или сгорания переохлажденные жидкости и стеклообразные вещества, так как эти состояния также неустойчивы.
Итак, стандартные термохимические данные по тепловым эффектам образования химических соединений относятся к температуре 298 К, давлению 1,01325 105 Па и наиболее устойчивой форме простых веществ, находящихся при данной температуре и данном давлении.
Изменение энтальпии, определяемое при стандартных условиях, обозначается следующим образом:
символ стандартного давления
Ho298
символ стандартной температуры.
Подобным образом обозначается стандартное изменение внутренней энергии Uо298.
