
- •В.Н. Захарченко Курс физической химии
- •Часть 1. Химическая термодинамика
- •Предисловие
- •Основные обозначения
- •Введение
- •Системы
- •Энергия и способы ее обмена между средой и системой
- •Параметры системы. Процессы
- •Теплота. Тепловое равновесие. Нулевое начало термодинамики
- •Уравнения состояния
- •Глава 1. Первое начало термодинамики
- •Глава 2. Термохимия
- •Глава 3. Процессы с идеальным газом
- •Глава 4. Второе начало термодинамики
- •Глава 5. Характеристические термодинамические функции
- •Глава 6. Системы переменного состава. Химический потенциал
- •Глава 7. Химическое равновесие
- •Глава 8. Фазовые превращения и фазовые равновесия
- •Глава 9. Коллигативные свойства растворов и осмотические явления
- •Глава 10. Непрерывные системы
- •Глава 11. Элементы статистической термодинамики
- •Глава 12. Основные понятия термодинамики неравновесных процессов
- •Приложения
- •Предметный указатель
- •Глава 1. Первое начало термодинамики 21
- •Глава 2. Термохимия 26
- •Глава 3. Процессы с идеальным газом 39
- •Глава 4. Второе начало термодинамики 53
- •Глава 5. Характеристические термодинамические функции 72
- •Глава 6. Системы переменного состава. Химический потенциал 89
- •Глава 7. Химическое равновесие 111
- •Глава 8. Фазовые превращения и фазовые равновесия 130
- •Глава 9. Коллигативные свойства растворов и осмотические явления 165
- •Глава 10. Непрерывные системы 174
- •Глава 11. Элементы статистической термодинамики 180
- •Глава 12. Основные понятия термодинамики неравновесных процессов 194
Глава 11. Элементы статистической термодинамики
11 - 1. Термодинамическая вероятность
Вообразим следующий эксперимент, реальное проведение которого невозможно.
В системе (возможно, ею окажется идеальный газ) каким-то образом пометим и сфотографируем все молекулы с таким расчетом, чтобы можно было определить их энергию. Результаты такого эксперимента представим в виде таблицы, в которой приводятся все возможные значения энергии молекул в системе и число молекул с каждым значением энергии.
Таблица 11 - 1.
Условное распределение молекул по энергиям
Значения энергии |
1 |
2 |
3 |
|
|
i |
|
|
Число молекул с данным значением энергии |
N1 |
N2 |
N3 |
|
|
Ni |
|
|
Если молекулы помечены, т.е. различимы, то появляется возможность подсчитать число способов распределения молекул по значениям энергии наподобие того, как рассчитывается размещение жильцов по домам (см. приложение). Для этого воспользуемся формулой
![]() . (11
- 1)
. (11
- 1)
Число способов распределения молекул по энергиям W называется также числом способов реализации данной системы или (что наиболее распространено) термодинамической вероятностью .
Отметим, что термодинамическую вероятность с математической вероятностью объединяет название и единственное свойство, с которым познакомимся при дальнейшем рассмотрении этого понятия. Различия между ними весьма существенны. Минимальное значение математической вероятности равно 0 (невозможное событие), а максимальное равно 1 (абсолютно достоверное событие). Минимальное значение термодинамической вероятности составляет 1 (молекулы могут быть распределены по энергиям единственным способом). Верхнего предела для термодинамической вероятности нет.
Если бы значения чисел были невелики, то для расчетов термодинамической вероятности можно было воспользоваться уравнением (11 - 1) в исходной форме. Для больших чисел, а именно с ними приходится сталкиваться, оперируя с числом молекул в системе, применяется замечательное приближение
![]() ,
(11 - 2)
,
(11 - 2)
называемое формулой Стирлинга .
Можно воспользоваться более грубым, но достаточным для наших целей приближением, учитывающим, что для больших чисел n>>2 и ln n<<n,
![]() .
(11 - 3)
.
(11 - 3)
Расчетная формула для термодинамической вероятности системы с реальным числом частиц принимает следующий вид:
![]() .
.
Так как Ni=N, то формула становится еще проще:
![]() .
(11 - 4)
.
(11 - 4)
Найдем термодинамическую вероятность системы, образованной сложением равновесных подсистем, одна из которых содержит aN частиц, а другая содержит bN частиц. Относительное распределение частиц по энергиям в равновесных системах совпадает. Поэтому расчет термодинамической вероятности по составной формуле (11 - 4) приводит к следующему:
![]()
Принимая во внимание, что число подсистем значительно меньше числа частиц в каждой из них, т.е. a+ b<<Ni, получим
![]()
или
![]() ,
(11 - 5)
,
(11 - 5)
так как
![]() .
.
Формула (11 - 5) показывает, что термодинамическая вероятность системы, полученной сложением подсистем, равна произведению термодинамических вероятностей подсистем. Это свойство термодинамической вероятности называется мультипликативностью .
Мультипликативность характерна и для математической вероятности. Как известно, математическая вероятность исхода нескольких независимых событий равна произведению вероятностей исхода каждого из них.
11 - 2. Зависимость между термодинамической вероятностью и энтропией. Формула Больцмана
Одним из свойств энтропии является аддитивность. При сложении двух равновесных систем a и b, энтропии которых соответственно равны Sa и Sb, энтропия вновь образованной системы находится из условия
![]() .
(11 - 6)
.
(11 - 6)
Если энтропия является функцией
термодинамической вероятности, то эта
функция
![]() должна обладать свойством, вытекающим
из мультипликативности термодинамической
вероятности:
должна обладать свойством, вытекающим
из мультипликативности термодинамической
вероятности:
![]() .
.
Свойством аддитивности при мультипликативности аргумента обладает логарифмическая функция
![]() (11 - 7)
(11 - 7)
Формула (11 - 7), устанавливающая зависимость между энтропией и термодинамической вероятностью, была предложена Л.Больцманом и называется формулой Больцмана .
11 - 3. Распределение Больцмана
Обратимся к системе с дискретным спектром значений энергии молекул: 1,2,3, ...,i , ...
Если этими значениями энергии обладают молекулы, числа которых соответственно равны N1, N2, N3, ..., Ni,..., то общее число частиц в системе равно
![]() ,
(11 - 8)
,
(11 - 8)
а полная энергия системы равна
![]() .
(11 - 9)
.
(11 - 9)
Энтропию системы найдем по формуле Больцмана
![]() .
(11 - 10)
.
(11 - 10)
Для изолированной системы условием равновесия является максимум энтропии. Поэтому для нахождения распределения числа частиц по энергиям необходимо найти условие этого максимума. Простое дифференцирование функции S по числу частиц в данном случае непригодно, так как кроме основного уравнения (11 - 10) имеются дополнительные уравнения с теми же независимыми величинами - уравнения связи - (11 - 8) и (11 - 9). В этих условиях для нахождения экстремума используется метод неопределенных множителей Лагранжа. В соответствии с этим методом составляется функция
![]()
или
![]() ,.
,.
где 1 и 2 - неопределенные множители Лагранжа.
Дифференцирование функции Ф с учетом
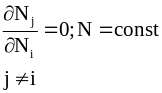
позволяет найти условие максимума энтропии:
![]() .
(11 - 11)
.
(11 - 11)
Преобразуем уравнение (11 - 11)
![]()
и введем новые обозначения для входящих в него констант:
![]() .
.
Их применение упрощает форму записи уравнения (11 - 11)
![]() .
(11 - 12)
.
(11 - 12)
Потенцирование уравнения (11 - 12) дает
![]()
или, обозначив
![]() ,
получим
,
получим
![]() .
(11 - 13)
.
(11 - 13)
От константы можно избавиться следующим образом.
Суммируя Ni, получим
![]() .
(11 - 14)
.
(11 - 14)
Деление (11-13) на (11-14) дает
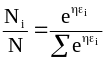 .
(11 - 15)
.
(11 - 15)
Уравнение (11 - 15) связывает число молекул (или других частиц) со значениями их энергии в системе. Таким образом, поставленная задача могла бы считаться решенной, если бы был ясен смысл входящей в уравнение (11-15) величины . Чтобы установить его, прологарифмируем уравнение (11 - 15)
![]() ,
,
умножим обе части уравнения на Ni
![]()
и просуммируем
![]()
или
![]() .
(11 - 16)
.
(11 - 16)
Обращаясь к уравнению (11 - 10), можно
заметить, что левая часть равенства (11
- 16) равна
![]() .
Следовательно,
.
Следовательно,
![]() .
(11 - 16а)
.
(11 - 16а)
При заданном энергетическом спектре системы, т.е. наборе значений энергии, и заданном числе частиц в системе последний член правой части равенства (11 - 16) является константой.
Исходя из изложенного, найдем приращения левой и правой частей равенства (11 - 16)
![]() .
.
Из второго постулата термодинамики для системы, находящейся при постоянном объеме и не совершающей полезную работу, следует
![]() .
.
Сравнение двух последних уравнений дает
![]() .
(11 - 17)
.
(11 - 17)
С учетом соотношения (11 - 17) уравнение, описывающее распределение частиц по энергиям, принимает следующий вид:
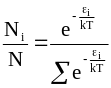 (11 - 18)
(11 - 18)
Уравнение (11 - 18) называется уравнением Больцмана .
Входящая в уравнение (11 - 18) константа k называется константой Больцмана. Экспонента , определяющая относительное число частиц с данной энергией, называется фактором Больцмана . Сумма экспонент, входящая в знаменатель правой части уравнения (11 - 18), называется суммой по состояниям . Очень часто она обозначается f.
11 - 4. Константа Больцмана. Методы ее определения. Среднее значение энергии частиц
Установить зависимость между константой Больцмана и другими фундаментальными постоянными можно, приравняв величину средней энергии молекул, найденную разными способами.
С этой целью рассмотрим одноатомный идеальный газ, заключенный в кубическую емкость с длиной ребра а.
Пусть молярная масса вещества равна М, а средняя скорость движения молекул газа при температуре Т равна .
Энергия молекул определяется только кинетической составляющей, равной
![]() ,
,
где NA - постоянная Авогадро (отношение молярной массы к постоянной Авогадро представляет собой массу одной молекулы).
Найдем импульс, получаемый стенкой при нормальном ударе одной молекулы:
![]() .
.
Для того, чтобы определить число ударов молекул в единицу времени, необходимо учитывать, что движение молекул по каждому координатному направлению равновероятно. Поэтому принимается, что 1/3 молекул движется от одной стенки куба к противоположной и обратно.
Количество вещества n, содержащегося в кубической емкости с объемом а3, найдем по уравнению состояния идеального газа
![]() ,
,
а число молекул составляет
![]() .
.
Как уже указывалось, 1/3 из этого числа движется в заданном направлении, причем каждая молекула совершает в единицу времени число пробегов от стенки и обратно, которое определяется равенством
![]() .
.
Следовательно, число ударов всех молекул в единицу времени равно
![]() ,
,
а сила ударов по стенке составляет
![]() .
.
Давление газа равно
![]() .
.
Отсюда
![]() и средняя энергия одноатомной молекулы
составляет
и средняя энергия одноатомной молекулы
составляет
![]() .
(11 - 19)
.
(11 - 19)
Теперь найдем среднюю энергию молекулы, используя распределение Больцмана. Для этого несколько преобразуем формулу Больцмана.
Вновь обратимся к постулату о равноценности движения по всем направлениям и будем исходить из следующего условия.
Пусть для некоторой части молекул одноатомного газа импульсы находятся в пределах от Px до Px+dPx, от Py до Py+dPy и от Pz до Pz+dPz.
Согласно распределению Больцмана доля
этих молекул в общем числе молекул прямо
пропорциональна фактору Больцмана![]() .
Кроме того, она должна быть прямо
пропорциональна выделенному объему
поля импульсов dPxdPydPz.
Принимая, что число молекул dN
с энергией и заданным
объемом поля импульсов dPxdPydPz
является очень малой величиной,
распределению Больцмана можно придать
следующий вид:
.
Кроме того, она должна быть прямо
пропорциональна выделенному объему
поля импульсов dPxdPydPz.
Принимая, что число молекул dN
с энергией и заданным
объемом поля импульсов dPxdPydPz
является очень малой величиной,
распределению Больцмана можно придать
следующий вид:
![]() .
(11 - 20)
.
(11 - 20)
В уравнении (11 - 20) - коэффициент пропорциональности. Для его определения воспользуемся тем, что общее число молекул в системе является постоянной величиной: N=const. Интегрирование уравнения (11 - 20) дает
![]() .
.
Следовательно,
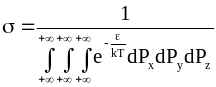
и распределение молекул одноатомного газа принимает вид:
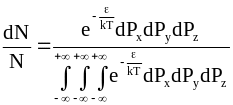 .
(11 - 21)
.
(11 - 21)
Уравнение (11 - 21) можно дальше преобразовывать, переходя к полярным координатам.
Элемент объема шарового слоя в полярных координатах равен
![]() .
.
Зависимость между энергией и импульсами можно представить следующим образом:
![]()
или
![]() ,
,
из чего следует для частиц постоянной массы m
![]() .
.
Заменим элемент объема поля импульсов на величину, определяемую только энергией молекул:
![]()
Переход от поля импульсов к распределению по энергии приводит к изменению пределов интегрирования. Скорость молекул может быть положительной и отрицательной, и пределы интегрирования по импульсам могут быть от + до -. Энергия может иметь минимальное значение, равное 0 и максимальное - условно равное .
С учетом изложенного получаем
![]() .
.
Интеграл в приведенном выше уравнении является табличным интегралом следующего типа:
![]() ,
,
где
![]() Кроме того,
Кроме того,
![]() .
.
Таким образом, уравнение Больцмана для распределения молекул по энергиям в непрерывном спектре можно записать в следующем виде:
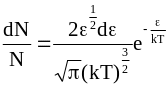 . (11 - 22)
. (11 - 22)
Среднее значение какой-либо величины
![]() при непрерывном распределении частиц
представляет собой деленный на общее
число частиц интеграл произведения
этой величины на число молекул, обладающих
ее значением Х:
при непрерывном распределении частиц
представляет собой деленный на общее
число частиц интеграл произведения
этой величины на число молекул, обладающих
ее значением Х:
![]() .
.
Среднее значение энергии молекул одноатомного газа определяется по уравнению
![]()
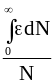 (11 - 23)
(11 - 23)
или с учетом уравнения (11 - 22)
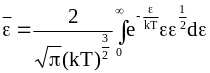 .
.
Обращаясь вновь к табличному интегралу, найдем
![]() .
(11 - 24)
.
(11 - 24)
Сравнивая (11 - 19) и (11 - 24), имеем
![]() . (11 - 25)
. (11 - 25)
Молекулы одноатомного идеального газа участвуют только в поступательном движении по трем координатным направлениям. Число направлений движения называется также числом степеней свободы .
В предположении равноценности движения по каждому направлению уравнения (11 - 19) и (11 - 24) позволяют сделать важный вывод:
В идеальном газе на каждую степень свободы приходится энергия, равная 1/2kT.
Многоатомные молекулы кроме поступательного участвуют во вращательном движении. В частности, для двухатомных молекул существуют еще две степени вращательного движения.
Следовательно, энергия молекул двухатомного идеального газа равна 5/2kT.
Внутренняя энергия идеального газа определяется только кинетической составляющей молекул. Для одного моля частиц
![]() .
.
В связи с этим производные внутренней энергии по температуре при постоянном объеме таковы:
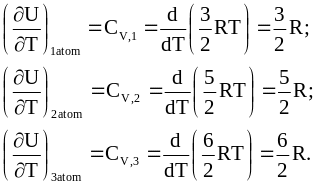 (11 - 26)
(11 - 26)
Уравнения (11 - 26) объясняют природу теплоемкости идеального газа.
11 - 5. Примеры использования распределения Больцмана
Распределение частиц по высоте
Энергия частицы, находящейся на высоте h от отсчетного уровня в поле силы тяжести и имеющей массу m, плотность p, равна
![]() ,
(11 - 27)
,
(11 - 27)
а на отсчетном уровне она равна о. В уравнение (11 - 27) входит также плотность среды m.
Пусть Nh обозначает число частиц на высоте h, а No - на отсчетном (нулевом) уровне.
Число частиц на каждом уровне можно определить по уравнению Больцмана (11 - 18). Разделив Nh на No, можно избавиться от суммы по состояниям
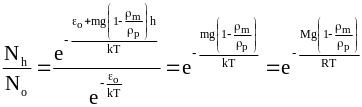 . (11
- 28)
. (11
- 28)
Последняя часть уравнения (11 - 28) представлена в форме, содержащей молярную массу M=mNA и универсальную газовую постоянную R=kNA.
Совпадение уравнения (11 - 28) с уравнением (10 - 9), следующим из уравнений классической термодинамики, очевидно.
Уравнение (11 - 28) было использовано Перреном для экспериментального определения константы Больцмана и постоянной Авогадро.
Распределение заряженных частиц в электрическом поле
Энергия иона в электрическом поле равна
![]() ,
,
где о - составляющая энергии, не зависящая от электрического поля,
i - знак заряда иона («+» для катиона и «-» для аниона),
z - заряд иона в атомных единицах заряда,
- электрический потенциал в данной точке раствора.
Приняв , что электрический потенциал в точке, значительно отдаленной от заряженной поверхности, равен нулю, можно найти отношение числа частиц в этих точках. Так как это отношение прямо пропорционально отношению концентраций, то получаемое уравнение совпадет с уравнением (10 - 11).
11 - 6. Связь между суммой по состояниям и термодинамическими функциями
Напомним, что сумма по состояниям представляет собой сумму всех возможных значений фактора Больцмана для данной системы
![]() .
(11 - 29)
.
(11 - 29)
Дифференцирование уравнения (11 - 29) по температуре при постоянном объеме дает

Разделив обе части равенства на f и умножив на kT2, получим
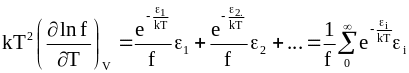 ..
..
Умножение на N приводит к следующему равенству:
![]() ,
,
правая часть которого представляет внутреннюю энергию системы.
Следовательно,
![]() .
(11 - 30)
.
(11 - 30)
Из уравнений (11 - 16а) и (11 - 17) найдем
![]() .
(11 - 31)
.
(11 - 31)
Откуда
![]() .
(11 - 32)
.
(11 - 32)
Таким образом, методы статистической термодинамики дают возможность рассчитывать термодинамические функции по суммам по состояниям. Вычисление энтальпии, энергии Гельмгольца и энергии Гиббса не составит труда, если известны внутренняя энергия и энтропия системы.
Так как молекулы находятся одновременно в поступательном, вращательном, колебательном и др. движениях, то сумма по состояниям определяется этими составляющими. В простейших молекулах эти виды движения можно принять независимыми и возможен расчет для отдельных форм движения с использованием квантово-механических представлений.
Экспериментальной базой для вычисления сумм по состояниям служат спектры молекул.
