
- •В.Н. Захарченко Курс физической химии
- •Часть 1. Химическая термодинамика
- •Предисловие
- •Основные обозначения
- •Введение
- •Системы
- •Энергия и способы ее обмена между средой и системой
- •Параметры системы. Процессы
- •Теплота. Тепловое равновесие. Нулевое начало термодинамики
- •Уравнения состояния
- •Глава 1. Первое начало термодинамики
- •Глава 2. Термохимия
- •Глава 3. Процессы с идеальным газом
- •Глава 4. Второе начало термодинамики
- •Глава 5. Характеристические термодинамические функции
- •Глава 6. Системы переменного состава. Химический потенциал
- •Глава 7. Химическое равновесие
- •Глава 8. Фазовые превращения и фазовые равновесия
- •Глава 9. Коллигативные свойства растворов и осмотические явления
- •Глава 10. Непрерывные системы
- •Глава 11. Элементы статистической термодинамики
- •Глава 12. Основные понятия термодинамики неравновесных процессов
- •Приложения
- •Предметный указатель
- •Глава 1. Первое начало термодинамики 21
- •Глава 2. Термохимия 26
- •Глава 3. Процессы с идеальным газом 39
- •Глава 4. Второе начало термодинамики 53
- •Глава 5. Характеристические термодинамические функции 72
- •Глава 6. Системы переменного состава. Химический потенциал 89
- •Глава 7. Химическое равновесие 111
- •Глава 8. Фазовые превращения и фазовые равновесия 130
- •Глава 9. Коллигативные свойства растворов и осмотические явления 165
- •Глава 10. Непрерывные системы 174
- •Глава 11. Элементы статистической термодинамики 180
- •Глава 12. Основные понятия термодинамики неравновесных процессов 194
Глава 7. Химическое равновесие
7 - 1. Сродство химической реакции
Вновь запишем уравнение реакции в общей форме
1A1 +2A2 + ... +iAi +...= 1`B1 +2`B2 +...+j`Bj +... (7 - 1)
Пусть в ходе реакции количество вещества A1 изменяется на dna1 моль, вещества А2 - на dna2, ..., вещества Ai - на dnai, ..., вещества В1 - на dnb1, ...
В соответствии с одним из важнейших стехиометрических законов химии - законом эквивалентов - числа молей связаны между собой соотношением
![]() (7 - 2)
(7 - 2)
Вводимая соотношением (7 - 2) величина получила несколько названий: химическая переменная, число пробегов химической реакции и др.
Используя химическую переменную, введем еще одну величину А, которая называется сродством химической реакции.
Приводимое ниже выражение является определением сродства
![]() (7 - 3)
(7 - 3)
Так как при постоянных Р и Т изменение энергии Гиббса со знаком минус равно максимальной полезной работе (dG = W`max), а бесконечно малое изменение химической переменной d не изменяет состава системы, то
сродство имеет смысл максимальной полезной работы реакции при условии, что количества вступивших в реакцию и образовавшихся в ходе ее веществ равны стехиометрическим коэффициентам в уравнении этой реакции, а состав системы остается практически неизменным.
Подстановка W`max вместо dG в выражение (7 - 3) приводит к еще одной форме определения сродства
![]() .
(7 - 3а)
.
(7 - 3а)
Напомним, что в общем случае приращение энергии Гиббса определяется равенством
![]() .
.
Согласно определению сродства частная производная энергии Гиббса берется при постоянном давлении и постоянной температуре. Для данного случая можно записать
![]() .
(7 - 4)
.
(7 - 4)
Учитывая, что
![]() ,
,
из равенств (7 - 3) и (7 - 4) следует
![]() (7 - 5)
(7 - 5)
Уравнение (7 - 5) играет огромную роль при описании химических процессов и химического равновесия.
Отметим, что сродство может быть выражено и с помощью других термодинамических функций, приращения которых при постоянных соответствующих параметрах равны максимальной полезной работе со знаком минус.
В дополнение к уравнениям (7 - 3) и (7 -3а) запишем следующие уравнения:
![]() ;
(7 - 3b)
;
(7 - 3b)
![]() ;
(7 - 3c)
;
(7 - 3c)
![]() .
(7 - 3d)
.
(7 - 3d)
7 - 2. Основное условие химического равновесия
Условие химического равновесия является частным случаем более общих условий равновесия, приводимых в табл. 5-1 (см. стр. 55). Для постоянного давления и постоянной температуры критерием равновесия является минимум энергии Гиббса. Из условия dG = 0 следует, что при химическом равновесии выполняется условие
A = 0. (7 - 6)
Следовательно, основным условием химического равновесия является равенство нулю сродства реакции.
Из уравнения (7 - 6) образуется вторая форма общего условия химического равновесия
![]() (7 - 7)
(7 - 7)
или
![]() (7 - 8)
(7 - 8)
Последнее уравнение показывает, что при установлении химического равновесия сумма умноженных на стехиометрические коэффициенты химических потенциалов исходных веществ равна сумме умноженных на стехиометрические коэффициенты химических потенциалов продуктов реакции.
7 - 3. Химическое равновесие в гомогенных системах
Гомогенными системами являются системы, имеющие одинаковый состав и одинаковые свойства во всех точках.
Вначале рассмотрим находящуюся при постоянных Р и Т систему, представляющую собой идеальную газовую смесь, в которой установилось химическое равновесие.
В этом случае химический потенциал вещества выражается в форме k=ko + RTlnPk. Подстановка этой формы в уравнение (7 - 8) дает:
![]() ;
;
![]() .
(7 - 9)
.
(7 - 9)
При постоянной температуре можно использовать новую константу KP, определяемую выражением
![]() . (7 - 10)
. (7 - 10)
Сочетание уравнения (7 - 9) с выражением (7 - 10) приводит к уравнению
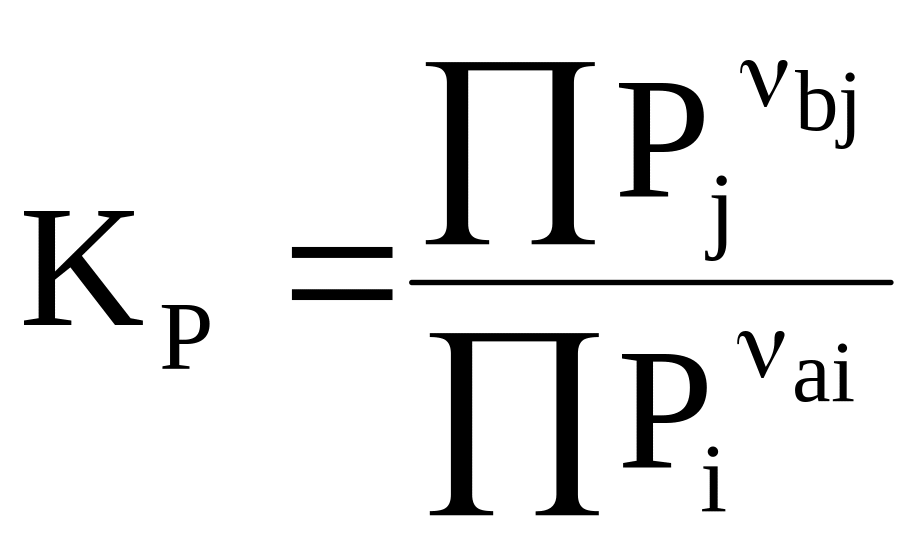 .
(7 - 11)
.
(7 - 11)
(Символ
означает произведение. Например,
![]() ).
).
Уравнение (7 - 11) называется законом действующих масс для идеальной газовой смеси.
Входящая в уравнение (7 - 11) константа КР называется константой равновесия при постоянном давлении.
Для реальной газовой системы химический потенциал выражается в форме K =Ko + RTlnfK. Применение ее вместе с уравнением (7 - 8) дает еще одну форму выражения закона действующих масс
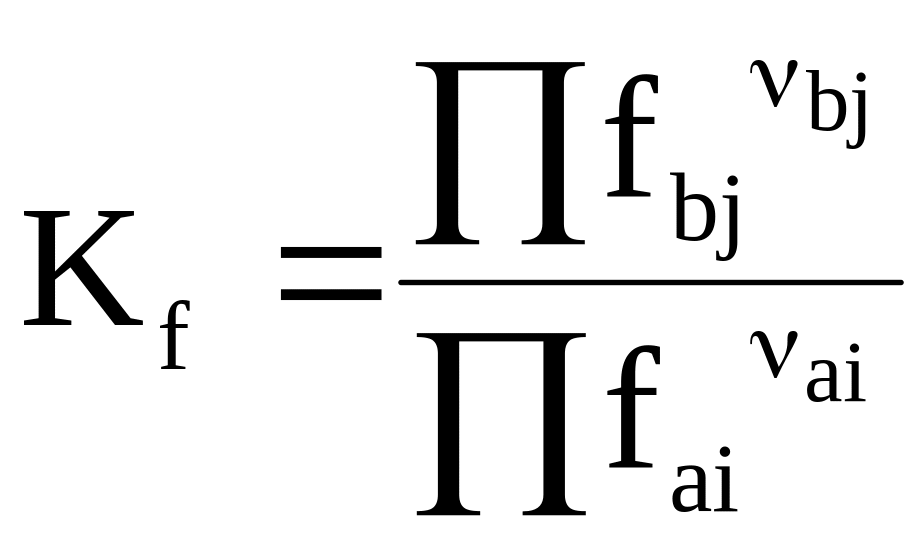 .
(7 - 12)
.
(7 - 12)
Константа равновесия Kf используется для реальных газовых систем.
Для идеальных и реальных растворов закон действующих масс выражается соответственно уравнениями:
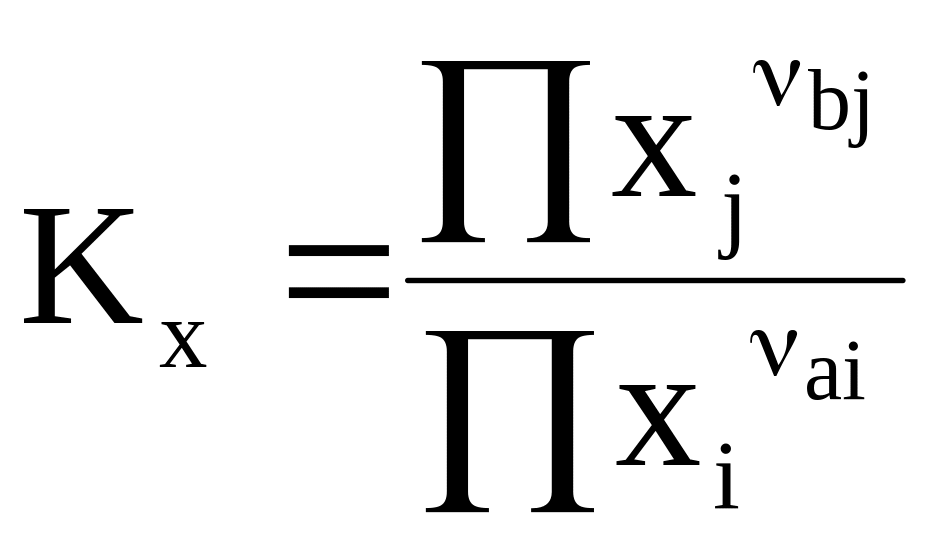 (7 - 13)
(7 - 13)
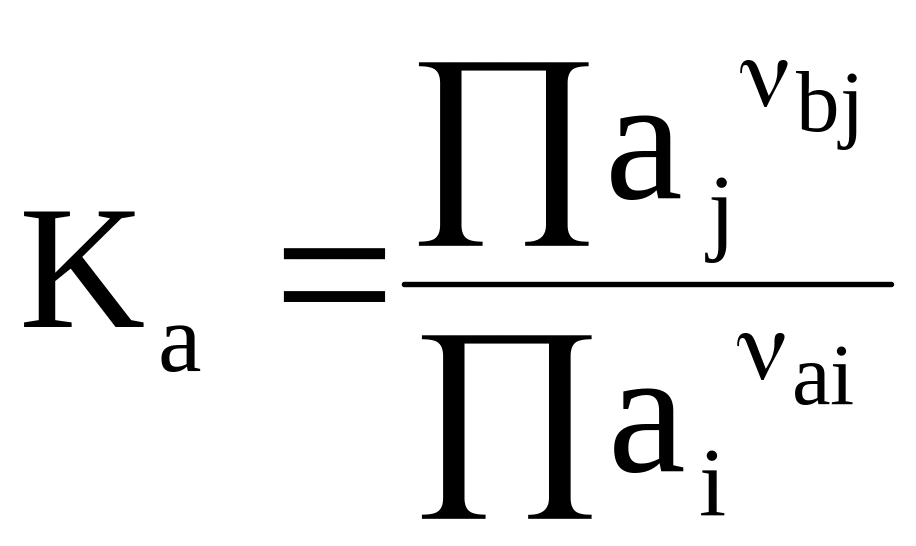 (7 - 14)
(7 - 14)
7 - 4. Химическое равновесие в гетерогенных системах
Наиболее частые случаи гетерогенного равновесия относятся к системам, в которых содержатся одновременно твердые вещества и жидкий раствор или газовая смесь.
Напомним, что части системы, имеющие одинаковый состав и одинаковые физические свойства, называются фазами.
Если твердые фазы состоят из чистых кристаллических веществ, то их химические потенциалы являются константами, так как термодинамическая активность чистого кристаллического вещества равна 1. Поэтому ни молярная доля, ни термодинамическая активность таких веществ в уравнения, отражающие закон действия масс, не входят.
Рассмотрим некоторые примеры.
Равновесие в системе c реакцией C(h) + CO2 (g) = 2СO (g).
Если принять, что СО2 и СО являются идеальными газами, а углерод - чистым кристаллическим веществом, то уравнение закона действия масс принимает следующий вид:
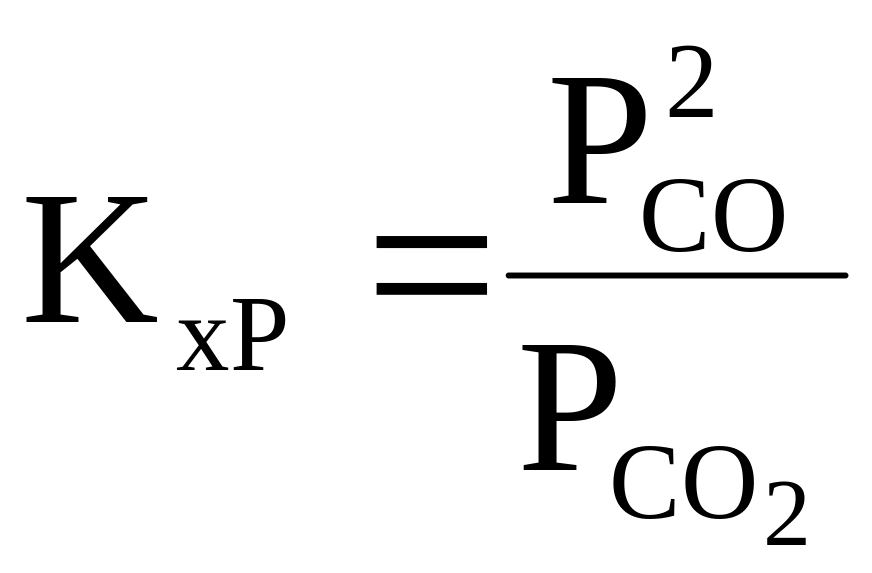 .
.
Равновесие между труднорастворимой солью и раствором, содержащим входящие в ее состав ионы.
Пусть в состав труднорастворимой соли входят ионы: Cat+y и An-x. Равновесие между труднорастворимой солью и ионами можно представить следующим образом:
CatxAny = xCat+y + yAn-x.
Соль является чистым кристаллическим веществом, термодинамическая активность которого равна 1. Закон действующих масс для данного случая выражается уравнением
![]() (7 - 15)
(7 - 15)
Уравнение (7 - 15) выражает известное из аналитической и неорганической химии произведение растворимости SP.
7 - 5. Соотношение между различными константами равновесия для газовых систем
Кроме приведенных выше констант равновесия КР и Кx, установленных для газовых систем, находящихся при постоянном давлении, рассмотрим константу, описывающую равновесие при постоянном объеме.
Используя уравнение состояния идеального газа в форме
![]() ,
,
парциальное давление в случае постоянного объема газовой фазы можно выразить через молярную концентрацию Ci:
![]() .
(7 - 16)
.
(7 - 16)
Подстановка правой части выражения (7 - 16) вместо парциального давления в уравнение для химического потенциала дает
![]() .
.
Объединив все константы, запишем уравнение для химического потенциала при постоянном объеме в традиционной форме
![]() . (7 - 17)
. (7 - 17)
Подстановка выражения (7 - 17) в общее уравнение для химического равновесия приводит к еще одной форме закона действующих масс, применяемой при постоянном объеме
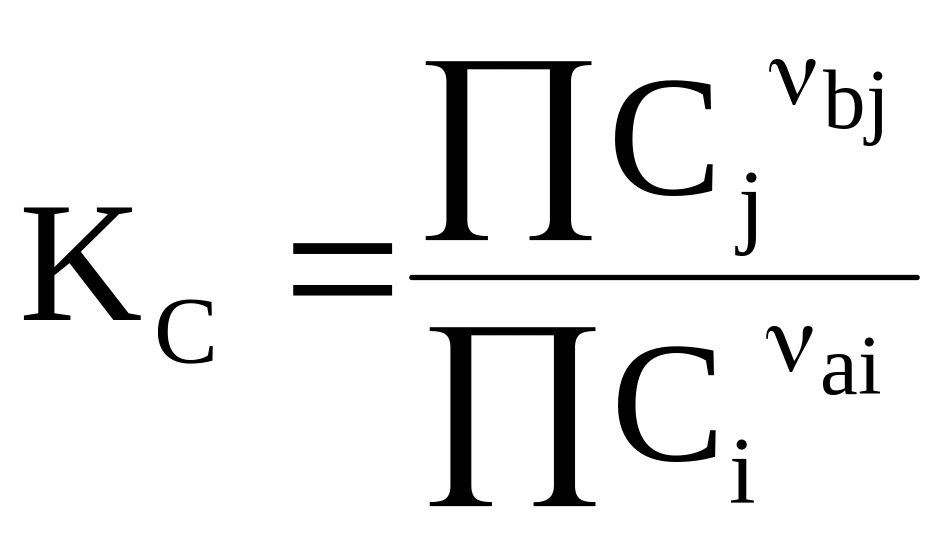 . (7 - 18)
. (7 - 18)
Константа КС называется константой равновесия при постоянном объеме.
Константы КР, Кх и КС являются основными константами равновесия для идеальных газовых смесей, в которых протекают химические реакции. Найдем соотношения, связывающие их друг с другом, для чего воспользуемся уравнением (7 - 16) и следующим выражением:
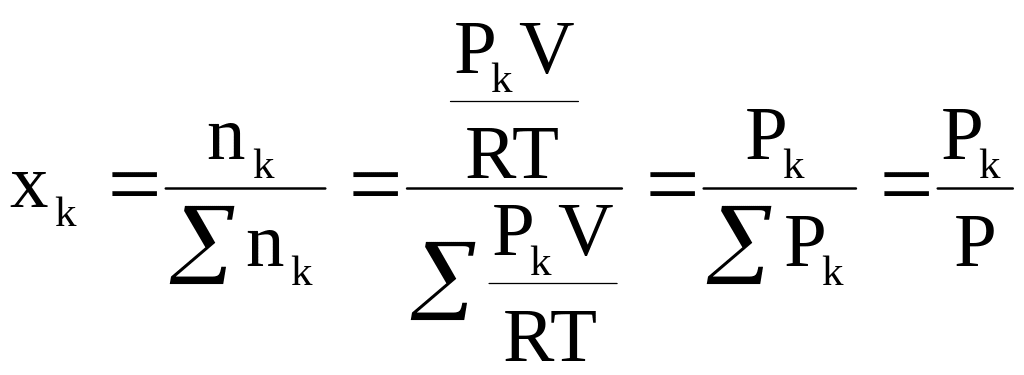 (7 - 19)
(7 - 19)
или
![]() .
(7 - 20)
.
(7 - 20)
Подставляя в уравнение (7 - 11) вместо Pk правую часть равенства (7 - 20), получим
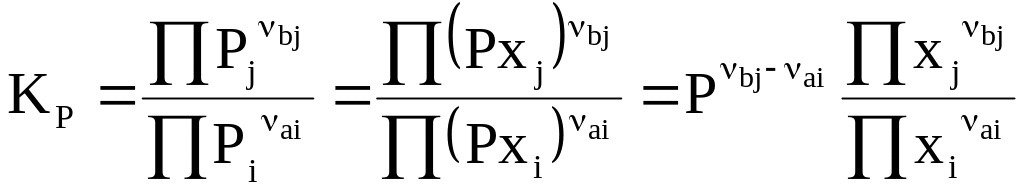 .
(7 - 21)
.
(7 - 21)
Обозначив bj - ai и приняв во внимание уравнение (7 - 13), получим
![]() . (7 - 22)
. (7 - 22)
Подстановка правой части равенства (7 - 16) вместо Pk в уравнение (7 - 11) приводит к уравнению
![]() . (7 - 23)
. (7 - 23)
Уравнения (7 - 22) и (7 - 23) позволяют связать друг с другом основные константы равновесия для идеальных газов.
7 - 6. Зависимость между сродством химической реакции и константами равновесия
Из выражений (7 - 5) и (7 - 11) следует
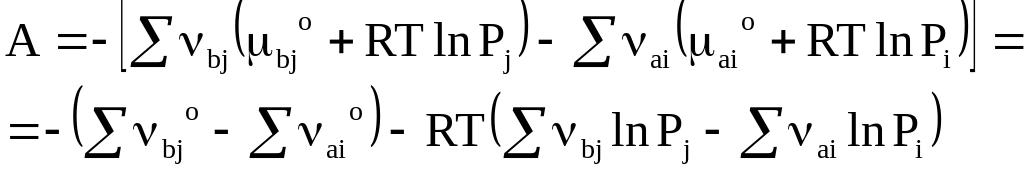
или
 (7 - 24)
(7 - 24)
Уравнение (7 - 24) устанавливает зависимость между константой равновесия и сродством химической реакции для идеальных газов.
Для идеальных и реальных конденсированных систем аналогичные уравнения соответственно имеют следующий вид:
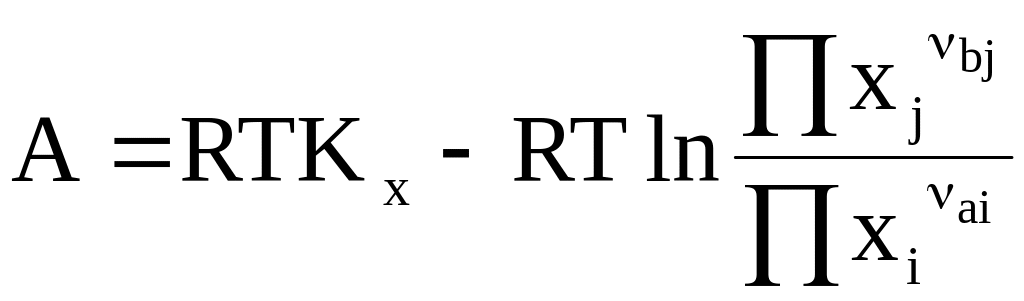 (7 - 25)
(7 - 25)
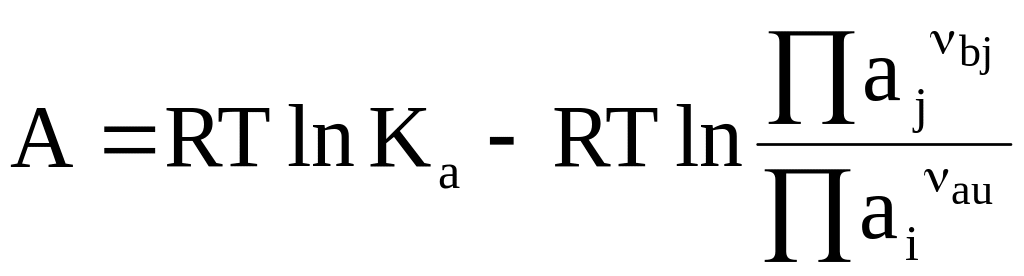 (7 - 26)
(7 - 26)
Уравнения (7 - 24) - (7 - 26) называются уравнениями изотермы химической реакции или уравнениями максимальной работы химической реакции.
Так как сродство имеет смысл максимальной полезной работы реакции при практически неизменном ее составе, то, зная константу равновесия и действующие парциальные параметры (давления, летучести, молярные доли, активности), можно рассчитать, чему равна максимальная полезная работа при количествах превращаемых или образующихся веществ, равных стехиометрическим коэффициентам.
Отметим, что парциальные величины, входящие в уравнения (7 - 24) - (7 - 26), являются действующими (неравновесными), а величины, входящие в уравнения (7 - 11), (7 - 12), (7 - 13) и др., являются равновесными, т.е. отвечающими только условию равновесия.
Если все вещества, вступающие в реакцию и образующиеся в ходе ее, находятся в стандартном состоянии, то сродство, отвечающее этому условию, называется стандартным сродством и как все величины, относящиеся к стандартному состоянию, обозначается Ао.
Напомним, что стандартное давление (а для реальных газовых систем стандартная летучесть) равно 1,01325105 Па и активности или молярные доли в стандартном состоянии (чистого вещества в устойчивой форме) равны 1. Подстановка этих значений в уравнения (7 - 24) - (7 - 26) приводит к следующим уравнениям для стандартного сродства:
![]() (7 - 27)
(7 - 27)
![]() (7 - 28)
(7 - 28)
![]() (7 - 29)
(7 - 29)
С понятием стандартного сродства связано понятие стандартного изменения энергии Гиббса Go, определение которому дается равенством
![]() (7 -
30)
(7 -
30)
Из уравнений (7 - 27) - (7 - 29) следует
![]() (7
- 31)
(7
- 31)
![]() (7 - 32)
(7 - 32)
![]() (7 - 33)
(7 - 33)
7 - 7. Влияние температуры на константу равновесия
Уравнение (5 - 73) дает возможность представить температурную зависимость энергии Гиббса в удобной форме. Применительно к стандартному изменению энергии Гиббса это уравнение принимает следующий вид:
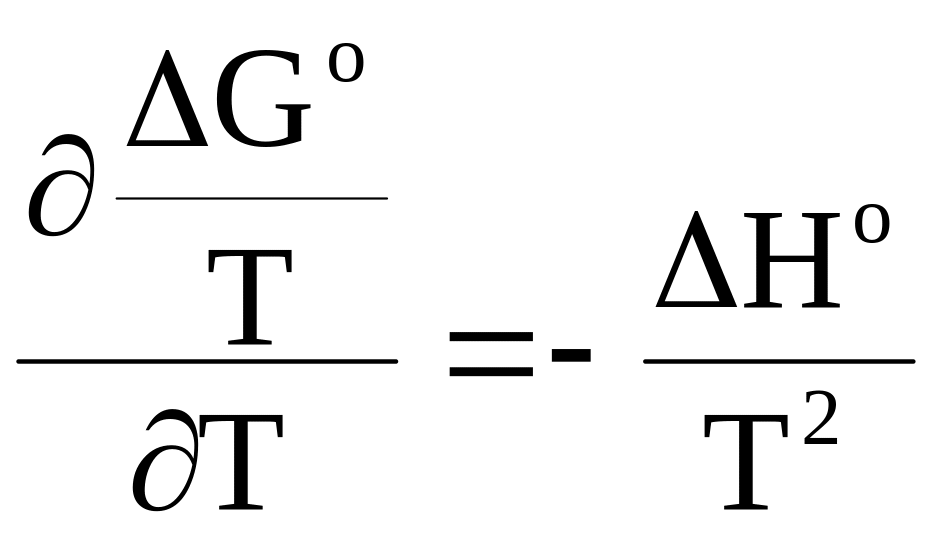 .
.
Подстановка правых частей равенств (7 - 31) - (7 - 33) вместо Gо приводит к следующему:
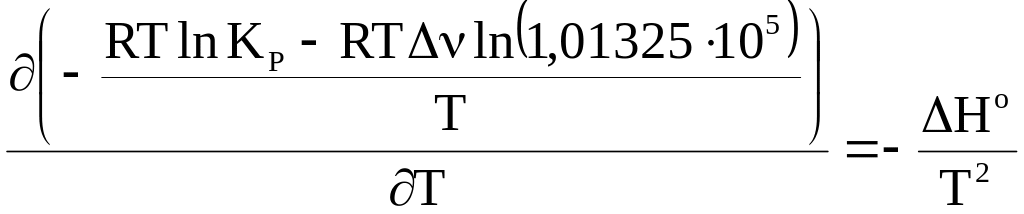
или
![]() . (7 - 34)
. (7 - 34)
Название уравнения 7 - 34 - уравнение изобары химической реакции Вант-Гоффа.
В изохорических условиях используются константа КС и термодинамическая функция U. Соответствующее уравнение для постоянного объема имеет следующий вид (приводим без вывода):
![]() .
(7 - 35)
.
(7 - 35)
Уравнение (7 - 35) называется уравнением изохоры химической реакции Вант-Гоффа.
7 - 8. Проблема расчета константы равновесия по термохимическим данным
Разделив переменные и проинтегрировав уравнение (7 ‑ 34) от нуля температур, получим
![]() ,
(7 - 36)
,
(7 - 36)
где I` - постоянная интегрирования.
Далее можно воспользоваться интегральной формой уравнения Кирхгофа
![]()
и найти зависимость константы равновесия только от термохимических величин, к которым относится тепловой эффект реакции при стандартных условиях Но и теплоемкости веществ Сk.
Однако для решения этой задачи необходимо найти постоянную интегрирования I`.
Здесь мы повторно встречаемся с той же проблемой, которая возникла при интегрировании уравнений Гиббса - Гельмгольца.
Ни первое, ни второе начало термодинамики не дают способ определения этой константы. Потребовались новые данные, позволившие установить эту константу. С ними мы познакомимся в следующем параграфе.
7 - 9. Тепловой закон Нернста как формулировка третьего начала термодинамики
В. Нернст, изучая зависимость тепловых эффектов реакции и теплоемкости от температуры, заметил, что по мере приближения к абсолютному нулю температур разность умноженных на стехиометрические коэффициенты теплоемкостей продуктов реакции и исходных веществ СР начинает быстро уменьшаться. Так как разность теплоемкостей представляет собой производную теплового эффекта реакции Н от температуры, можно было сделать вывод, что при абсолютном нуле температур эта производная становится равной нулю. В результате этих исследований обнаружилось, что при низких температурах изменение энтропии в ходе реакции также быстро приближается к нулю. Так как энтропия равна взятой со знаком минус производной энергии Гиббса от температуры, то можно было предположить, что и эта производная стремится к нулю.
Эти результаты были обобщены Нернстом в виде постулата, который был назван тепловым законом Нернста. Иногда установленную Нернстом закономерность называют тепловой теоремой.
Формулировка теплового закона Нернста такова:
При абсолютном нуле температур функции Н = H(Т) и G =G(T) конденсированных систем имеют общую касательную , параллельную оси температур.
Математическая форма записи теплового закона имеет следующий вид:
![]() (7 - 37)
(7 - 37)
Тепловой закон Нернста является самостоятельным постулатом термодинамики и представляет собой одну из двух формулировок третьего начала термодинамики.
7 - 10. Следствия из теплового закона Нернста
Некоторые положения, которые мы рассмотрим здесь как следствия из теплового закона Нернста, послужили основанием для его формулировки.
Следствие 1.
При абсолютном нуле температур энтропия системы, в которой протекает химическая реакция, не изменяется.
![]() (7 - 38)
(7 - 38)
Следствие 2.
При абсолютном нуле температур теплоемкость системы не изменяется.
![]() (7 - 38а)
(7 - 38а)
Следствие 3.
Для конденсированных систем постоянные интегрирования в уравнениях Гиббса - Гельмгольца и изобары химической реакции равны 0.
Это следствие основано на применении интегральной формы уравнения Гиббса - Гельмгольца
![]() .
.
В соответствии с равенством (7 - 37) производная G по температуре должна быть равна 0. Это возможно лишь при условии что,
![]() .
(7 - 39)
.
(7 - 39)
Последнее следствие открыло возможности расчета константы равновесия по термохимическим данным. Схему таких расчетов можно представить следующим образом.
Интегральная форма уравнения Гиббса - Гельмгольца с учетом выражения (7 - 39) принимает вид:
![]() .
(7 - 40)
.
(7 - 40)
Интегральная форма уравнения Кирхгофа может быть представлена для данного случая так:
![]() .
(7 - 41)
.
(7 - 41)
Подстановка вместо Н правой части уравнения (7 ‑ 41) в уравнение (7 - 40) дает
![]() .
(7 - 42)
.
(7 - 42)
Если температурная зависимость теплоемкостей установлена, а тепловой эффект реакции может быть рассчитан по следствиям из закона Гесса, то уравнение (7 - 42) позволяет найти изменение энергии Гиббса, в том числе и стандартную величину. Далее по уравнениям (7 - 31) - (7 - 33) рассчитываются соответствующие константы равновесия.
Для систем, содержащих газы, тепловой закон в прямой форме не применим.
Нернст предложил для расчета констант равновесия в газовых и гетерогенных системах воспользоваться циклическим процессом, который включал бы в себя переход из конденсированного состояния в газовое и соответствующую химическую реакцию. Интегрирование уравнения Клапейрона - Клаузиуса для процессов испарения и возгонки приводит к появлению констант, называемых химическими постоянными jk. Нернст показал, что алгебраическая сумма химических постоянных равна постоянной интегрирования уравнения изобары для газовых систем, т.е. I= j`jj`-iji j.
7 - 11. Постулат Планка как формулировка третьего начала
М. Планк предложил еще одну формулировку третьего постулата, названную постулатом Планка:
При абсолютном нуле температур энтропия совершенных (идеальных) кристаллов чистого вещества равна 0.
Математическая запись постулата Планка такова:
![]() . (7 - 43)
. (7 - 43)
Постулат Планка выполняется для чистых твердых веществ, у которых кристаллы не имеют ни дефектов строения, ни дефектов включения, а термодинамическая активность равна 1.
Ранее указывалось, что существуют состояния чистых веществ, у которых термодинамическая активность не может считаться равной 1. К их числу относится стеклообразное состояние. Отсутствие кристаллической структуры, в которую возможен потенциальный переход стеклообразной структуры, означает неприменимость для него постулата Планка.
Таким образом, вещества со стеклообразной структурой при абсолютном нуле температур могут иметь энтропию, отличную от нуля.
Постулат Планка позволил решить проблему нахождения абсолютного значения энтропии для чистых веществ, имеющих при абсолютном нуле температур кристаллическую структуру.
Существенным дополнением к постулату Планка является равенство нулю теплоемкости при абсолютном нуле температур. Значения функции СР = СР( Т) , начиная с абсолютного нуля температур, для многих веществ известны.
Абсолютная энтропия чистого кристаллического вещества, не претерпевающего аллотропических переходов при нагревании от абсолютного нуля температур до данной температуры, вычисляется по уравнению (4 - 12):
![]() .
.
Если в дальнейшем происходит изменение кристаллической структуры (аллотропический переход) или фазовый переход при температуре Т1, то этот процесс сопровождается тепловым эффектом Н1. Изменение на этой стадии энтропии окажется равным
![]() .
.
Последующее повышение температуры до нового фазового перехода приводит к
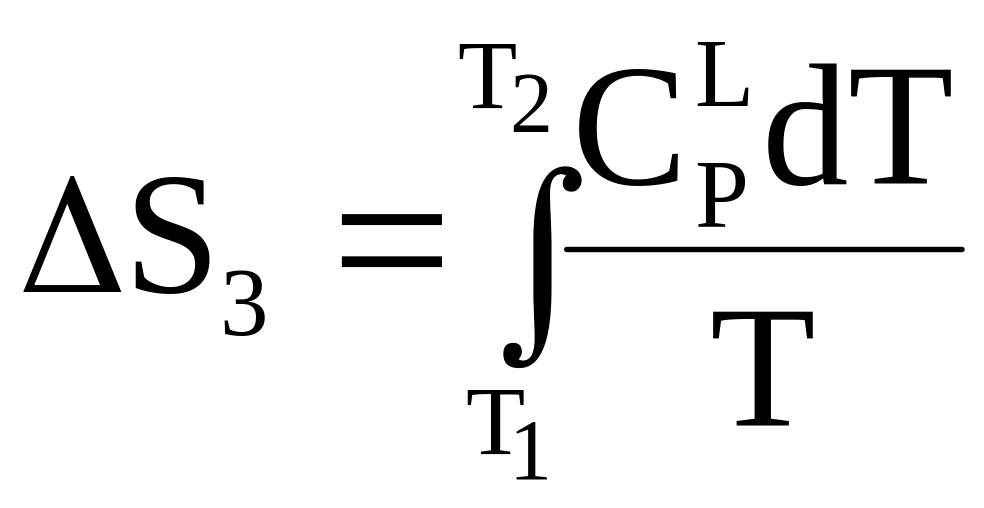 .
.
Новый фазовый переход при температуре Т2 вновь увеличит энтропию на S3
![]() .
.
Дальнейшее повышение температуры вновь приводит к увеличению энтропии
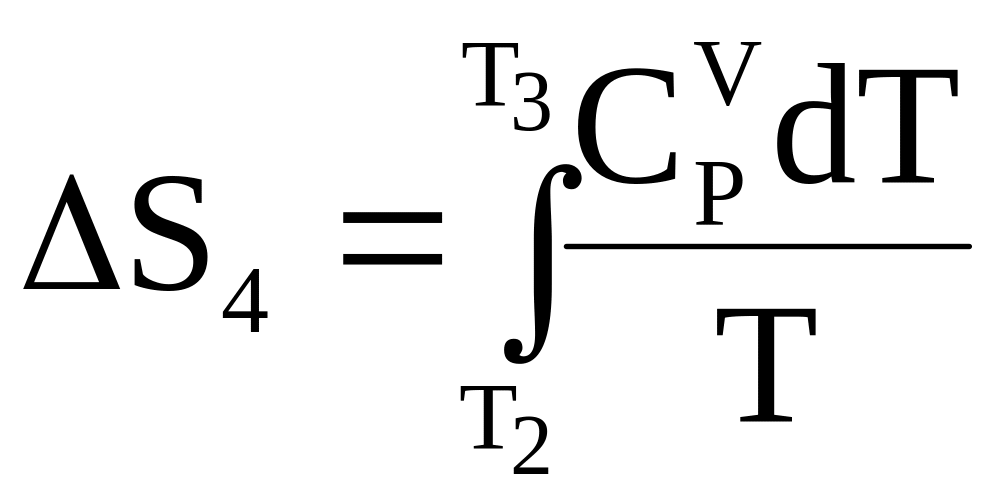 .
.
Если при температуре Т3 происходит следующий фазовый переход, то вновь изменение энтропии окажется равным отношению изменения энтальпии к температуре фазового перехода и т.д.
Абсолютное значение энтропии представляет собой сумму изменений энтропии на всех стадиях процесса вплоть до данной температуры
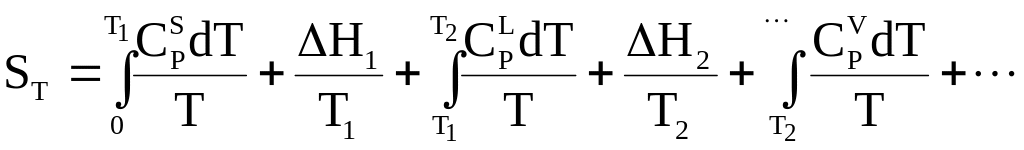 (7 - 44)
(7 - 44)
По уравнению (7 - 44) рассчитывается
абсолютная величина энтропии для
внесения в справочники химических
величин. По принятым условиям IUPAC
эти данные относятся к стандартной
температуре и стандартному давлению.
Стандартная энтропия обозначается
![]() .
.
7 - 12. Расчет равновесия по методу абсолютных энтропий
Общее изменение энтропии в ходе реакции при стандартной температуре находят как разность суммы произведений стехиометрических коэффициентов и энтропий продуктов реакции и суммы произведений стехиометрических коэффициентов и энтропий исходных веществ (используется свойство аддитивности энтропии):
![]() .
(7 - 45)
.
(7 - 45)
Изменение энтальпии определяется по закону Гесса
![]() .
.
Стандартное при 298 К изменение энергии Гиббса равно
![]() .
(7 - 46)
.
(7 - 46)
Величины, входящие в уравнение (7 - 46),
приводятся в справочниках. Далее можно
рассчитать константу равновесия К(298)
при температуре 298 К, используя
уравнение
![]() .
.
Для других температур вводятся температурные поправки в тепловой эффект реакции с использованием интегральной формы уравнения Кирхгофа и в уравнение для расчета энтропии с учетом теплоемкостей
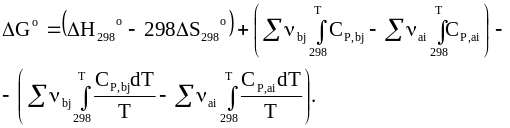 (7 ‑ 47)
(7 ‑ 47)
Далее рассчитывается константа равновесия по уравнению
![]() (7 - 48)
(7 - 48)
7 - 13. Общий принцип смещения равновесия
Для узкого температурного интервала интегрирование уравнения можно проводить, полагая, что стандартная теплота реакции Но не зависит от температуры. Результатом такого интегрирования уравнения изобары Вант-Гоффа является
![]() .
(7 - 49)
.
(7 - 49)
Несложный анализ уравнения (7 - 49) показывает, что для эндотермической реакции, идущей с поглощением теплоты системой (), повышение температуры приводит к увеличению константы равновесия и повышению содержания в системе веществ, образование которых связано с тепловыми затратами. В случае экзотермической реакции, наоборот, с повышением температуры равновесие смещается в сторону исходных веществ.
Равновесие в реакции
N2 + 3H2 = 2NH3
при повышении давления смещается в сторону образования продуктов реакции, а в реакции
2NO2 = 2NO + O2
при повышении давления равновесие смещается в сторону исходных веществ.
Рассмотренные примеры влияния температуры или давления на изменение положения равновесия являются частными случаями общей закономерности, установленной в конце 80-ых годов XIX в. Ле Шателье и Брауном.
Принцип Ле Шателье - Брауна можно сформулировать следующим образом:
При действии фактора, выводящего систему из равновесного состояния, возникают процессы, уменьшающие влияние этого фактора.
Назовем выведение системы из равновесного состояния возмущением. В соответствии с принципом Ле Шателье - Брауна система как бы сопротивляется действию возмущающего фактора, выводящего систему из равновесия ( в рассматриваемых случаях - изменения температуры или давления).
Принцип Ле Шателье - Брауна, сформулированный вначале как интуитивно установленная закономерность, получил обоснование на основе второго постулата термодинамики.
Как уже указывалось, равновесному состоянию системы отвечает равенство сродства нулю:
![]() .
.
При небольшом возмущении системы вариация сродства составит А и выполняется равенство
![]() ,
,
следовательно, должно соблюдаться условие
![]() . (7 - 50)
. (7 - 50)
Выражение (7 - 50) следует из уравнений (7 - 3), (7 - 3b) и др., а именно: dG = Ad при Р,Т = const; dF = Ad при V,T = const и т.д.
Случай равенства в выражении (7 - 50) при любом значении d означает равновесие в системе, а неравенство определяет область применимости принципа Ле Шателье - Брауна.
Неприменимость принципа Ле Шателье - Брауна может быть вызвана переходом системы из менее устойчивого (метастабильного) состояния к более устойчивому. В частности, принцип Ле Шателье - Брауна не применяется к процессам, протекающим со взрывом.
Принцип Ле Шателье - Брауна не приводит к каким-либо количественным результатам. Однако он оказывается весьма полезным для оценки тенденций изменений в системе при изменении как внешних параметров, так и состава системы.
