
- •В.Н. Захарченко Курс физической химии
- •Часть 1. Химическая термодинамика
- •Предисловие
- •Основные обозначения
- •Введение
- •Системы
- •Энергия и способы ее обмена между средой и системой
- •Параметры системы. Процессы
- •Теплота. Тепловое равновесие. Нулевое начало термодинамики
- •Уравнения состояния
- •Глава 1. Первое начало термодинамики
- •Глава 2. Термохимия
- •Глава 3. Процессы с идеальным газом
- •Глава 4. Второе начало термодинамики
- •Глава 5. Характеристические термодинамические функции
- •Глава 6. Системы переменного состава. Химический потенциал
- •Глава 7. Химическое равновесие
- •Глава 8. Фазовые превращения и фазовые равновесия
- •Глава 9. Коллигативные свойства растворов и осмотические явления
- •Глава 10. Непрерывные системы
- •Глава 11. Элементы статистической термодинамики
- •Глава 12. Основные понятия термодинамики неравновесных процессов
- •Приложения
- •Предметный указатель
- •Глава 1. Первое начало термодинамики 21
- •Глава 2. Термохимия 26
- •Глава 3. Процессы с идеальным газом 39
- •Глава 4. Второе начало термодинамики 53
- •Глава 5. Характеристические термодинамические функции 72
- •Глава 6. Системы переменного состава. Химический потенциал 89
- •Глава 7. Химическое равновесие 111
- •Глава 8. Фазовые превращения и фазовые равновесия 130
- •Глава 9. Коллигативные свойства растворов и осмотические явления 165
- •Глава 10. Непрерывные системы 174
- •Глава 11. Элементы статистической термодинамики 180
- •Глава 12. Основные понятия термодинамики неравновесных процессов 194
Глава 1. Первое начало термодинамики
1 - 1. Формулировка первого начала термодинамики
Первое начало термодинамики, или первый закон термодинамики, относится к важнейшим законам природы.
Известно около двух десятков формулировок первого начала. Однако все они эквивалентны, и, если принять в качестве основной любую из них, то все остальные окажутся следствиями из нее.
Обратимся к балансу энергии системы. С учетом принятой системы знаков (теплота, Q, подводимая к системе и приводящая к увеличению ее энергии, принимается положительной, а работа, W, совершаемая системой и, следовательно, уменьшающая ее энергию, - также положительна) можем записать выражение для баланса энергии в следующей форме:
dU=Q - W. (1 - 1)
Опыт показывает, что
работа любого кругового процесса равна его теплоте.
Математическая форма записи этого утверждения такова:
![]() .
(1 - 2)
.
(1 - 2)
Приведенное утверждение и есть одна из многих формулировок первого начала термодинамики.
Из этой формулировки следует, что после любого кругового процесса внутренняя энергия не изменяется
![]() .
(1 - 3)
.
(1 - 3)
Следовательно, каким бы образом ни происходило изменение внутренней энергии при переходе системы из исходного состояния, которое в дальнейшем будет символически обозначаться (1), в конечное, для которого будет использоваться символ (2), изменение внутренней энергии всегда будет одним и тем же:
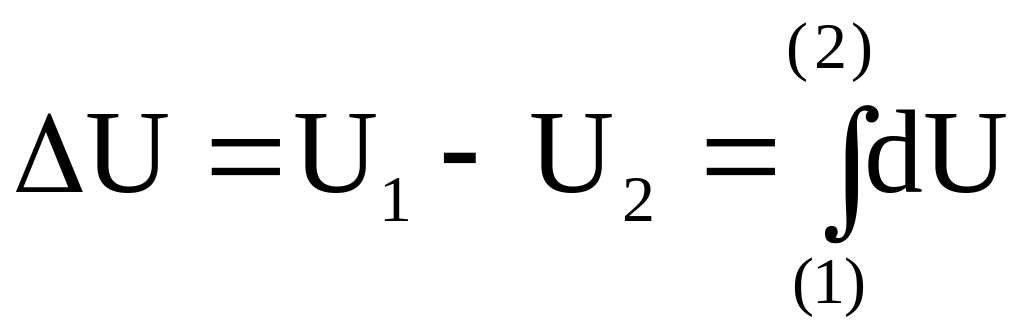 .
(1 - 4)
.
(1 - 4)
Для бесконечно малого приращения внутренней энергии, как величины не зависящей от процесса, используется символ d. Этим подчеркивается отличие изменения внутренней энергии от элементарной работы и теплоты, для которых применяется символ . Теплота и работа зависят от процесса. Проиллюстрируем это утверждение следующим примером. Элементарная максимальная работа простой системы равна W=PdV. При переходе системы от исходного состояния (1) до конечного состояния (2) (этим состояниям отвечают значения параметров P1, V1, T1 и P2, V2, T2) конечная работа определяется интегралом
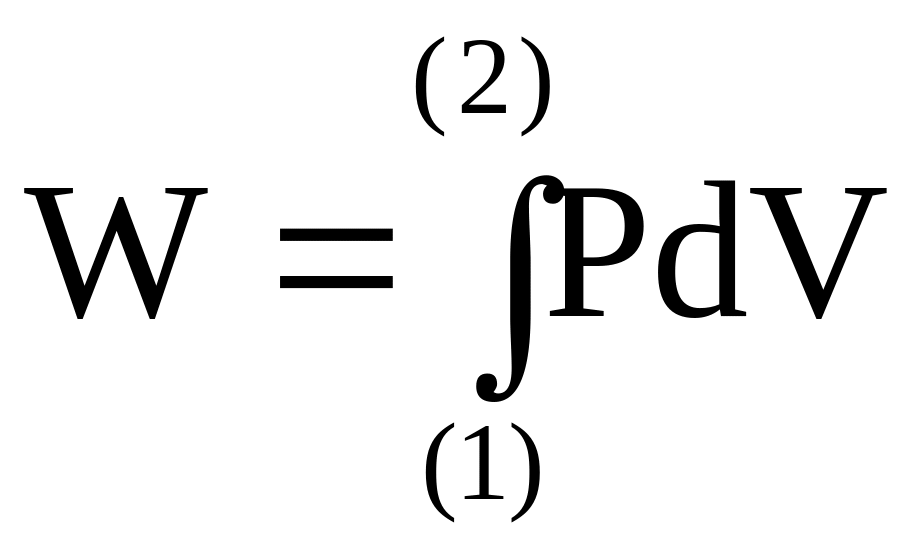 ,
(1 - 5)
,
(1 - 5)
величина которого зависит от вида функции P=P(V). Так как каждая кривая соответствует своему процессу, то работа различных процессов при переходе из общего исходного состояния (1) в общее конечное состояние (2) окажется различной.
Теплота процесса перехода из состояния (1) в состояние (2) определяется равенством
Q=U+W, (1 - 6)
в котором для одних и тех же начальных состояний и одних и тех же конечных состояний изменение внутренней энергии U остается постоянным. Следовательно, изменение работы в зависимости от пути (процесса) влечет за собой зависимость теплоты Q от типа процесса (пути изменения параметров).
Внутренняя энергия представляет собой функцию параметров системы U=U(V,T).
Изменение внутренней энергии dU является полным приращением функции, определяемой параметрами системы V, T (давление не является независимой величиной, потому что оно является функцией этих параметров в соответствии с уравнением состояния), и его можно выразить следующим образом:
![]() .
(1 - 7)
.
(1 - 7)
Используя другие пары параметров P,V или P,T, можно написать соответствующие выражения для полного приращения функции U.
1 - 2. Теплоемкости системы
Теплоемкостью системы в данном процессе называют отношение теплоты процесса к вызванному этой теплотой изменению температуры
![]() .
(1 - 8)
.
(1 - 8)
Символ тождества () означает, что выражение (1 - 8) является определением теплоемкости С.
С системой можно проводить неограниченное число процессов и для каждого должна быть своя теплоемкость.
Однако из всего множества в термодинамике принято выделять четыре важнейших процесса:
процесс при постоянном объеме (V=const), или изохорический (изохорный) процесс;
процесс при постоянном давлении (P=const), или изобарический (изобарный) процесс;
процесс при постоянной температуре (T=const), или изотермический (изотермный) процесс;
процесс без теплообмена (Q=0), или адиабатический (адиабатный) процесс.
Теплоемкость изохорического процесса обозначается Cv, а изобарического процесса - Cp. Нетрудно заметить, что постоянной температуре, т.е. изотермическому процессу, соответствуют два значения теплоемкости: + и - . Адиабатический процесс характеризуется теплоемкостью, равной 0.
Размерность теплоемкости Дж/моль/К означает, что она относится к 1 моль вещества.
Теплоемкости Сv и Сp реальных систем зависят от температуры. Обычно эта зависимость представляется в справочной литературе в виде степенных рядов.
Используя справочные данные по теплоемкостям, расчет теплоты процессов при постоянном давлении и при постоянном объеме проводят по формулам:
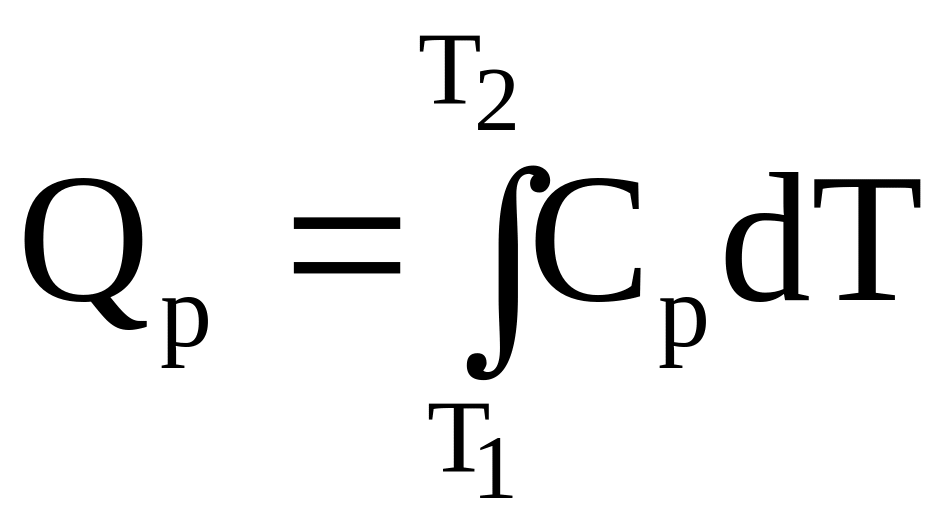 ;
(1 - 9)
;
(1 - 9)
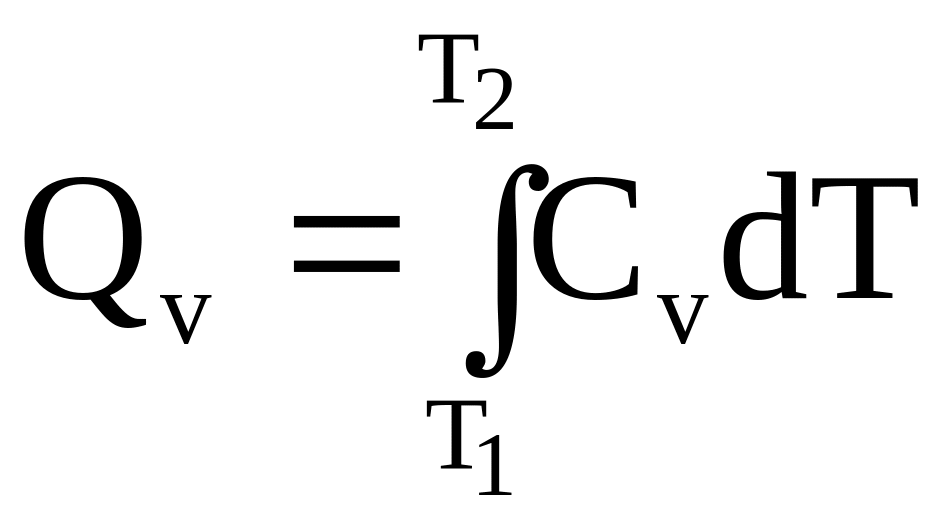 .
(1 - 10)
.
(1 - 10)
1 - 3. Теплота и термодинамические функции
В соответствии с уравнением для баланса энергии (1 - 1) при постоянном объеме (механическая работа не совершается) в простой системе теплота равна изменению внутренней энергии
Qv = dU = СvdT (1 - 11)
или
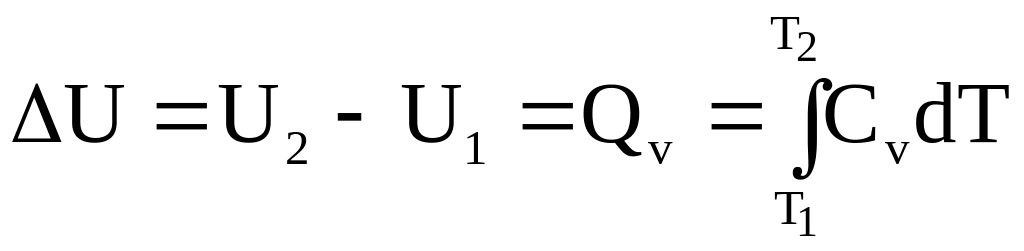 .
(1 - 12)
.
(1 - 12)
Для расчета теплоты при постоянном давлении вводится новая термодинамическая функция энтальпия H:
H U + PV. (1 - 13)
(Заметим, что первоначально буква Н читалась как «эта» (греч.), а затем она стала читаться как буква латинского алфавита).
Энтальпия обладает такими же основными свойствами термодинамической функции, какими обладает и внутренняя энергия, а именно:
ее изменение не зависит от процесса, а определяется начальным и конечным состоянием системы;
функция Н подобно внутренней энергии обладает свойством аддитивности.
Приращение энтальпии выражается соотношением
![]() .
(1 - 14)
.
(1 - 14)
Сумма dU + PdV соответствует теплоте, которая в простой системе равна сумме изменения внутренней энергии и механической работы. Следовательно, при постоянном давлении
dH = Qp ; (1 - 15)
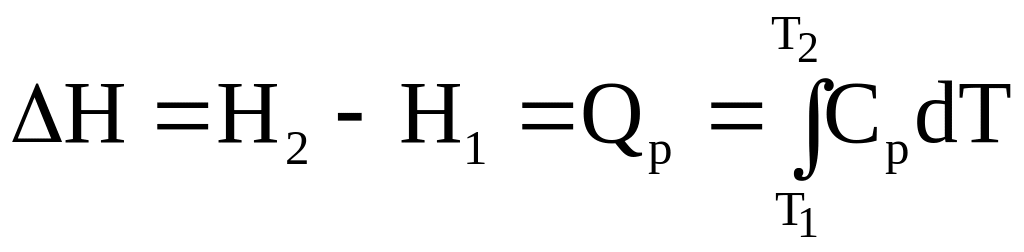 .
(1 - 16)
.
(1 - 16)
