
- •В.Н. Захарченко Курс физической химии
- •Часть 1. Химическая термодинамика
- •Предисловие
- •Основные обозначения
- •Введение
- •Системы
- •Энергия и способы ее обмена между средой и системой
- •Параметры системы. Процессы
- •Теплота. Тепловое равновесие. Нулевое начало термодинамики
- •Уравнения состояния
- •Глава 1. Первое начало термодинамики
- •Глава 2. Термохимия
- •Глава 3. Процессы с идеальным газом
- •Глава 4. Второе начало термодинамики
- •Глава 5. Характеристические термодинамические функции
- •Глава 6. Системы переменного состава. Химический потенциал
- •Глава 7. Химическое равновесие
- •Глава 8. Фазовые превращения и фазовые равновесия
- •Глава 9. Коллигативные свойства растворов и осмотические явления
- •Глава 10. Непрерывные системы
- •Глава 11. Элементы статистической термодинамики
- •Глава 12. Основные понятия термодинамики неравновесных процессов
- •Приложения
- •Предметный указатель
- •Глава 1. Первое начало термодинамики 21
- •Глава 2. Термохимия 26
- •Глава 3. Процессы с идеальным газом 39
- •Глава 4. Второе начало термодинамики 53
- •Глава 5. Характеристические термодинамические функции 72
- •Глава 6. Системы переменного состава. Химический потенциал 89
- •Глава 7. Химическое равновесие 111
- •Глава 8. Фазовые превращения и фазовые равновесия 130
- •Глава 9. Коллигативные свойства растворов и осмотические явления 165
- •Глава 10. Непрерывные системы 174
- •Глава 11. Элементы статистической термодинамики 180
- •Глава 12. Основные понятия термодинамики неравновесных процессов 194
Глава 10. Непрерывные системы
10 - 1. Характеристика непрерывных систем
Системы с непрерывным изменением свойств и состава называются непрерывными . Они занимают особое положение, отличаясь как от гомогенных систем, в которых состав и свойства во всех точках одинаковы, так и от гетерогенных систем, в которых свойства изменяются скачкообразно при переходе от одной фазы к другой.
В качестве примера непрерывной системы можно было бы привести газ, заключенный в длинный вертикально установленный на земной поверхности цилиндр. Если высота газа в таком цилиндре будет составлять десятки метров, то можно легко обнаружить изменение давления с высотой. Например, давление кислорода при нормальной температуре (298 К) уменьшается на высоте, близкой к 4 км, почти в два раза. Таким образом, земную атмосферу можно считать системой, приближающейся к непрерывной. Вблизи заряженной поверхности в растворе, содержащем ионы, образуется непрерывная система, напоминающая земную атмосферу. Ее называют «ионной атмосферой». В центробежном поле наблюдается непрерывное распределение по высоте макромолекул.
Вышеприведенные примеры показывают, что непрерывные системы образуются в поле внешних сил. При исчезновении внешнего поля диффузионные процессы приводят к выравниванию концентраций в системе и она становится однородной.
Каждая точка системы, находящейся в поле действия внешних сил, характеризуется потенциалом внешнего поля или просто потенциалом. Поверхность, на которой расположены точки с одинаковым значением потенциала, называется эквипотенциальной поверхностью . Перемещение dn моль вещества из точки, в которой потенциал равен 1, в точку с потенциалом 2 сопровождается работой, равной
![]() ,
(10 - 1)
,
(10 - 1)
где - фактор количества вещества (его также называют фактором массы и коэффициентом количества вещества или массы).
Приведем несколько примеров, поясняющих применение величин, входящих в уравнение (10 - 1).
Если система находится в поле силы тяжести, то потенциал в точке, находящейся на высоте hi, равен
![]() ,
,
где g - ускорение силы тяжести, а фактор количества вещества составит
![]() ,
,
где М - молярная масса вещества.
Делитель 1000 вводится в связи с тем, что молярная масса выражается г/моль, а масса в системе СИ выражается в килограммах.
Работа по перемещению dn моль вещества из точки (1) в точку (2) составит
![]() .
.
Если система совершает несколько типов работ, то
![]() .
(10 - 2)
.
(10 - 2)
В уравнении (10 - 2) потенциалы определяют разные виды работы (i ) и относятся к точкам (1) и (2).
10 - 2. Условия равновесия в непрерывной системе. Полный потенциал
Сродство и работа связаны соотношением
![]() ,
(10 - 3)
,
(10 - 3)
в котором первая сумма произведений химических потенциалов на стехиометрические коэффициенты относится к точке (2), а вторая - к точке (1).
Производная работы внешнего поля по химической переменной с учетом уравнения (10 - 2) дает
![]() .
(10 - 4)
.
(10 - 4)
В равновесной непрерывной системе работа над внешней средой не совершается. Поэтому условием равновесия служит выражение
![]() . (10 - 5)
. (10 - 5)
Величины, входящие в левую и правую части уравнения (10 - 5), относятся к разным точкам системы.
Если в точках (1) и (2) непрерывной системы происходит существенное относительное изменение концентрации только одного вещества m, то для него можно записать
![]() .
(10 - 6)
.
(10 - 6)
При отсутствии процесса ассоциации -
диссоциации соблюдается равенство
![]() ,
и уравнение еще более упрощается:
,
и уравнение еще более упрощается:
![]() .
(10 - 7)
.
(10 - 7)
Уравнение (10 - 7) используется для описания условия равновесия в непрерывных системах. Вытекающая из уравнения (10 - 7) величина tot называется полным потенциалом .
10 - 3. Частные случаи равновесия в непрерывных системах
Барометрическое уравнение
Барометрическое уравнение устанавливает зависимость давления газа по высоте. Существуют восходящие еще к Лапласу многочисленные методы вывода этого уравнения. В данном случае воспользуемся тем, что газ, находящийся в поле силы тяжести, является непрерывной системой, содержащей один компонент - газ с молярной массой М.
Химический потенциал газа зависит от его парциального давления, которое в данном примере совпадает с общим давлением на высоте h:
![]() ;
;
![]() .
.
Величины, определяющие потенциал и фактор количества вещества, рассматривались в п.1. Их подстановка в уравнение (10 - 7) дает
![]() .
.
После преобразований получим
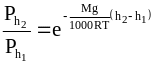 .
(10 - 8)
.
(10 - 8)
Уравнение (10 - 8) называется барометрическим уравнением .
Распределение концентрации по высоте
В достаточно разбавленном растворе химический потенциал можно выразить через молярную концентрацию
![]() .
.
Если растворяемое вещество имеет плотность 2,, а растворитель - плотность 1, то потенциал в заданной точке выражается с учетом архимедовой поправки
![]() .
.
Подстановка соответствующих величин в уравнение (10 - 7) дает
![]()
После преобразований получим
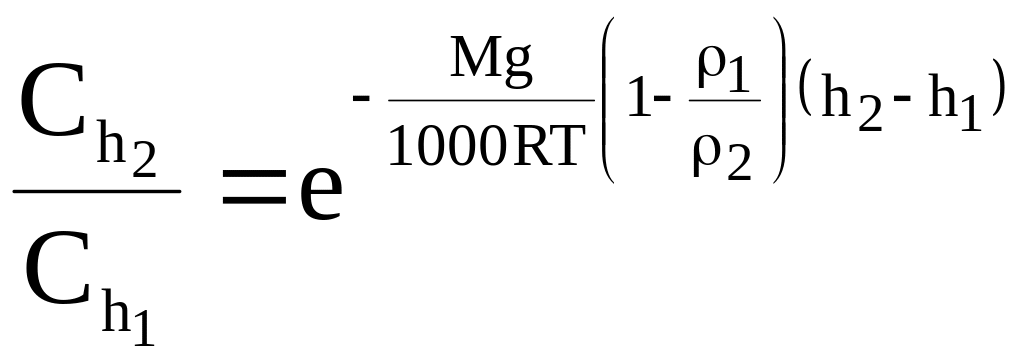 .
(10 - 9)
.
(10 - 9)
Расчеты по уравнению (10 - 9) показывают, что для обычных молекул концентрация с высотой изменяется настолько слабо, что эти изменения экспериментально определить невозможно. Однако для коллоидных частиц, содержащих порядка тысяч первичных молекул, концентрация резко изменяется с высотой.
Для достижения заметного изменения концентрации макромолекул с высотой силу тяжести заменяют центробежной силой.
Равновесие в электрическом поле
При переносе одного моля ионов с атомным зарядом (+1) из точки с электрическим потенциалом 1 в точку с потенциалом 2 фактор количества вещества оказывается равным числу Фарадея F. Если переносится 1 моль ионов с зарядом z, то фактор количества составит zF. С учетом изложенного в системе (при отсутствии ассоциации частиц) в качестве условия равновесия можно принять
![]() .
(10 - 10)
.
(10 - 10)
Величина ech, определяемая равенством (10 - 10), называется электрохимическим потенциалом .
Электрохимический потенциал играет важную роль в электрохимии, особенно при построении модели двойного электрического слоя.
Определим концентрацию катионов, заряд которых в атомных единицах равен z+, и анионов с зарядом z в точке с электрическим потенциалом вблизи заряженной поверхности.
Для простоты примем зависимость химических потенциалов от концентраций ионов в форме
![]() .
.
В этом случае электрохимические потенциалы ионов окажутся равными
![]()
В объеме раствора (на относительно
большом расстоянии от поверхности)
электрический потенциал можно принять
равным нулю. Если концентрации ионов в
объеме равны
![]() и
и
![]() ,
то электрохимические равновесия можно
описать уравнениями
,
то электрохимические равновесия можно
описать уравнениями
![]()
или
 (10 - 11)
(10 - 11)
Алгебраическая сумма произведений концентраций ионов на их заряд равна плотности заряда в данной точке.
Более детально распределение заряженных частиц вблизи заряженной поверхности рассматривается в курсе коллоидной химии.
