
- •Введение
- •1. Основы химической термодинамики
- •1.1. Основные понятия и определения термодинамики
- •1.2. I закон термодинамики
- •1.3. Внутренняя энергия как термодинамическая функция состояния системы
- •1.4. Применение I закона термодинамики к анализу некоторых термодинамических процессов
- •1.5. Теплоемкость
- •1.6. Термохимия
- •1.6.1. Влияние температуры на тепловые эффекты химических реакций и других процессов
- •1.7. II закон термодинамики
- •1.7.1. Математическое выражение II закона термодинамики
- •1.7.2. Энтропия и направление самопроизвольного протекания процессов в изолированных системах
- •1.7.3. Расчет энтропии для различных термодинамических систем и процессов
- •1.8. Взаимосвязь энтропии и термодинамической вероятности
- •1.9. Термодинамические потенциалы и направление самопроизвольных процессов. Условие термодинамического равновесия в системе
- •Взаимосвязь энергии гельмгольца с другими термодинамическими функциями и параметрами состояния системы
- •Взаимосвязь энергии гиббса с другими термодинамическими функциями и параметрами состояния системы
- •1.9. Третий закон термодинамики
- •2. Химическое равновесие
- •2.1. Понятие о химическом потенциале
- •2.2. Химический потенциал индивидуального вещества и компонента раствора
- •1. Идеальные системы
- •2. Реальные системы
- •2.3. Способы выбора стандартного состояния
- •2.4. Условие химического равновесиЯ
- •2.5. Константы химического равновесия. Закон действующих масс
- •2.6. Уравнение изотермы химической реакции. Химическое сродство
- •2.7. Влияние температуры на константу химического равновесия (уравнения изобары и изохоры химической реакции)
- •2.8. Влияние давления на константу химического равновесия (уравнение планка)
- •2.9. Энтропийный метод расчета константы химического равновесия
- •3. Термодинамика растворов и гетерогенные (фазовые) равновесия
- •3.1. Основные понятия и определения
- •3.2. Условие термодинамического равновесия в гомогенных растворах
- •3.2.1. Термодинамика идеальных растворов
- •3.2.2. Термодинамика реальных растворов
- •3.3. Равновесие в гетерогенных системах.
- •3.3.1. Теорема равновесия гиббса
- •3.3.2. Правило фаз гиббса
- •3.3.3. Применение правила фаз гиббса к анализу структуры диаграмм состояния гетерогенных систем
- •3.3.4. Уравнение состояния однокомпонентной двухфазной системы (уравнение кЛаузиуса – клапейрона)
- •3.3.5. Примеры гетерогенных (фазовых) равновесий а. Фазовое равновесие жидкость – пар
- •Растворимость газов в жидкостях (закон генри)
- •Б. Фазовое равновесие жидкость – жидкость диаграммы взаимной растворимости жидкостей в ТройныХ системАх
- •Основные типы диаграмм взаимной растворимости тройных систем
- •Распределение вещества между двумя соприкасающимися, но несмешивающимися растворителями (Закон распределения Нернста)
- •Экстракция
- •В. Фазовое равновесие жидкость – твердое вещество растворимость твердых веществ в жидкостях (закон шредера)
- •3.3.6. Коллигативные свойства растворов
- •Понижение давления пара над раствором по сравнению с чистым растворителем
- •Повышение температуры кипения и понижение температуры замерзания растворов
- •Определение молекулярной массы раствореного вещества
- •Г рафическое определение Tк и Tз
- •Осмотическое давление. Методы разделения жидких смесей мембранными методами
- •4. Электрохимия
- •4.1. Термодинамика растворов сильных электролитов
- •4.2. Электростатическая теория растворов сильных электролитов
- •4.3. Равновесие в растворах слабых электролитов
- •4.4. Электропроводность растворов электролитов.
- •4.5. Зависимость молярНой электропроводностИ электролитов от их концентрации в растворе
- •4.6. Электродвижущие силы и электродные потенциалы
- •4.6.1. Механизм возникновения электродных потенциаЛов. Уравнение нернста
- •4.6.2. Гальванические элементы
- •4.9.3. Основные типы электродов и расчет их потенциала
- •4.9.5. Потенциометрия
- •5. Химическая кинетика и катализ
- •5.1. Основные понятия и определения
- •5.2. Основной закон химической кинетики. Молекулярность и порядок реакции
- •Основы формальной кинетики.
- •5.3. Кинетика необратимых реакций
- •5.4. Методы определения порядка реакции
- •5.5. Влияние температуры на скорость реакции
- •5.6. Основные понятия катализа
- •5.6.1. Гомогенный катализ
- •5.6.2. Гетерогенный катализ
2.3. Способы выбора стандартного состояния
Численное значение активности и коэффициентов термодинамической активности зависит от способа выбора стандартного состояния. Стандартное состояние может быть выбрано произвольно, но оно должно быть таким, чтобы полученными в последствии активностью и термодинамическим коэффициентом активности было удобно пользоваться.
Существует два основных способа выбора стандартного состояния:
В симметричном способе за стандартное состояние любого компонента выбирают состояние чистого (индивидуального) компонента при температуре системы (раствора). Тогда в стандартном состоянии имеем:
,
,
![]() .
.
Способ чаще используют в термодинамике растворов неэлектролитов.
В соответствии с ассиметричным (не симметричным) способом стандартное состояние различно выбирают для различных компонентов системы.
Для растворителя стандартное состояние выбирают так же, как и в симметричном способе, т.е.: , , .
Для растворенного вещества за стандартное состояние выбирают состояние данного вещества в бесконечно разбавленном растворе, т.е.:
![]() ,
,
![]() ,
,
![]() .
.
Этот способ используется в термодинамике растворов электролитов.
2.4. Условие химического равновесиЯ
Пусть в идеальной
газовой фазе при
![]() протекает химическая реакция:
протекает химическая реакция:
![]() ,
(106)
,
(106)
где
![]() ,
,
![]() ,
… – исходные вещества:
,
… – исходные вещества:
![]() ,
,
![]() ,…
– продукты реакции;
,…
– продукты реакции;
![]() ,
,
![]() ,
,
![]() ,
,
![]() – стехиометрические коэффициенты.
– стехиометрические коэффициенты.
Условием химического
равновесия является минимум энергии
Гиббса:
![]() .
Следовательно,
.
Следовательно,
![]() .
(90)
.
(90)
Вещества реагируют
пропорционально стехиометрическим
коэффициентам. Для характеристики
протекания реакции введем понятие
химической переменной
![]() ,
определяющей степень продвижения
реакции или ее развития:
,
определяющей степень продвижения
реакции или ее развития:
![]() ,
,
где
![]() – стехиометрический коэффициент в
уравнении реакции: для продуктов
стехиометрические коэффициенты
положительны, а для исходных веществ –
отрицательны.
– стехиометрический коэффициент в
уравнении реакции: для продуктов
стехиометрические коэффициенты
положительны, а для исходных веществ –
отрицательны.
Физический смысл химической переменной: равна числу моль компонента, вступившего в реакцию, приходящемуся на единицу стехиометрического коэффициента.
Тогда
![]() .
.
Уравнение (90), после
выноса за знак суммы общего сомножителя
![]() ,
перепишется:
,
перепишется:
![]() .
(107)
.
(107)
Произведение равно
нулю, если хотя бы один из множителей
равен нулю. Дифференциал химической
переменной
![]() не может быть равен нулю по определению,
следовательно
не может быть равен нулю по определению,
следовательно
![]() .
(108)
.
(108)
Полученное равенство представляет собой термодинамическое условие химического равновесия: при химическом равновесии алгебраическая сумма произведений химических потенциалов на стехиометрические коэффициенты равна нулю (произведения для продуктов реакции положительны, а для исходных веществ – отрицательны).
Пример:
![]() ;
;
![]() .
.
ЛЕКЦИЯ 7
2.5. Константы химического равновесия. Закон действующих масс
Запишем условие химического равновесия для реакции (106):
![]() .
(109)
.
(109)
Выразим химические потенциалы реагирующих веществ через их парциальные давления:
. (95)
Подставим в (109) значения химических потенциалов, при этом перенесем все функции температуры вправо:
 .
.
Выражение, стоящее
справа есть постоянная величина при
постоянной температуре, обозначим ее
через
![]() .
Тогда получаем:
.
Тогда получаем:
 ,
(110)
,
(110)
где
![]() – константа химического равновесия –
постоянная величина при постоянной
температуре.
– константа химического равновесия –
постоянная величина при постоянной
температуре.
Уравнение (110) называют законом действующих масс: при равновесии отношение произведений парциальных давлений продуктов реакций, взятых в степенях, равных стехиометрическим коэффициентам, к аналогичному произведению для исходных веществ, есть величина постоянная при постоянной температуре.
Равновесие участвующих в химической реакции веществ может быть достигнуто различными способами:
Например: а)
![]()
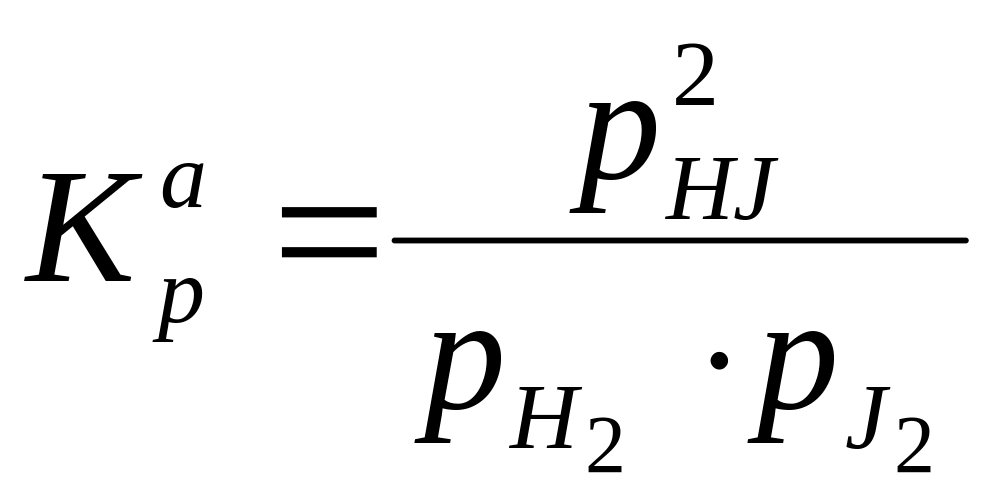 ;
;
б)
![]()
 .
.
Следовательно,
![]() .
.
Таким образом, константа равновесия химической реакции при не зависит от состава равновесной смеси, но зависит от способа написания химической реакции.
Для смеси идеальных газов закон действующих масс можно выразить через равновесные концентрации.
По уравнению
Менделеева – Клапейрона связь между
парциальным давлением и молярной
концентрацией
![]() :
:
![]() ,
,
![]() .
.
Подставим значение в закон действующих масс (110), получим:
 ,
,
где
![]() – изменение числа моль в ходе реакции.
– изменение числа моль в ходе реакции.
Обозначим
 .
(111)
.
(111)
где
![]() – константа химического равновесия,
выраженная через молярные концентрации.
– константа химического равновесия,
выраженная через молярные концентрации.
По уравнению Дальтона связь между и мольной долей компонента выражается:
![]() .
(97).
.
(97).
Тогда
 .
.
Обозначим
 .
(112)
.
(112)
где
![]() – константа химического равновесия,
выраженная через мольные доли.
– константа химического равновесия,
выраженная через мольные доли.
Таким образом,
константа
связана с
и
![]() уравнениями:
уравнениями:
![]() ;
(113)
;
(113)
![]() .
(114)
.
(114)
Для реакции, протекающей в реальном газовом растворе, химические потенциалы компонентов выражают через фугитивности реагирующих веществ:
, (101)
Тогда
 .
.
Если реакция протекает в реальном жидком растворе, то выражение для константы равновесия имеет вид:
 .
.
Если химическая реакция протекает с участием твердых веществ, то они не входят в закон действия масс, так как химический потенциал твердых веществ не изменяется в ходе протекания реакции.
В общем случае численные значения , и не совпадают. Совпадение наблюдается лишь для реакций, идущих без изменения числа моль.
