
- •Введение
- •1. Основы химической термодинамики
- •1.1. Основные понятия и определения термодинамики
- •1.2. I закон термодинамики
- •1.3. Внутренняя энергия как термодинамическая функция состояния системы
- •1.4. Применение I закона термодинамики к анализу некоторых термодинамических процессов
- •1.5. Теплоемкость
- •1.6. Термохимия
- •1.6.1. Влияние температуры на тепловые эффекты химических реакций и других процессов
- •1.7. II закон термодинамики
- •1.7.1. Математическое выражение II закона термодинамики
- •1.7.2. Энтропия и направление самопроизвольного протекания процессов в изолированных системах
- •1.7.3. Расчет энтропии для различных термодинамических систем и процессов
- •1.8. Взаимосвязь энтропии и термодинамической вероятности
- •1.9. Термодинамические потенциалы и направление самопроизвольных процессов. Условие термодинамического равновесия в системе
- •Взаимосвязь энергии гельмгольца с другими термодинамическими функциями и параметрами состояния системы
- •Взаимосвязь энергии гиббса с другими термодинамическими функциями и параметрами состояния системы
- •1.9. Третий закон термодинамики
- •2. Химическое равновесие
- •2.1. Понятие о химическом потенциале
- •2.2. Химический потенциал индивидуального вещества и компонента раствора
- •1. Идеальные системы
- •2. Реальные системы
- •2.3. Способы выбора стандартного состояния
- •2.4. Условие химического равновесиЯ
- •2.5. Константы химического равновесия. Закон действующих масс
- •2.6. Уравнение изотермы химической реакции. Химическое сродство
- •2.7. Влияние температуры на константу химического равновесия (уравнения изобары и изохоры химической реакции)
- •2.8. Влияние давления на константу химического равновесия (уравнение планка)
- •2.9. Энтропийный метод расчета константы химического равновесия
- •3. Термодинамика растворов и гетерогенные (фазовые) равновесия
- •3.1. Основные понятия и определения
- •3.2. Условие термодинамического равновесия в гомогенных растворах
- •3.2.1. Термодинамика идеальных растворов
- •3.2.2. Термодинамика реальных растворов
- •3.3. Равновесие в гетерогенных системах.
- •3.3.1. Теорема равновесия гиббса
- •3.3.2. Правило фаз гиббса
- •3.3.3. Применение правила фаз гиббса к анализу структуры диаграмм состояния гетерогенных систем
- •3.3.4. Уравнение состояния однокомпонентной двухфазной системы (уравнение кЛаузиуса – клапейрона)
- •3.3.5. Примеры гетерогенных (фазовых) равновесий а. Фазовое равновесие жидкость – пар
- •Растворимость газов в жидкостях (закон генри)
- •Б. Фазовое равновесие жидкость – жидкость диаграммы взаимной растворимости жидкостей в ТройныХ системАх
- •Основные типы диаграмм взаимной растворимости тройных систем
- •Распределение вещества между двумя соприкасающимися, но несмешивающимися растворителями (Закон распределения Нернста)
- •Экстракция
- •В. Фазовое равновесие жидкость – твердое вещество растворимость твердых веществ в жидкостях (закон шредера)
- •3.3.6. Коллигативные свойства растворов
- •Понижение давления пара над раствором по сравнению с чистым растворителем
- •Повышение температуры кипения и понижение температуры замерзания растворов
- •Определение молекулярной массы раствореного вещества
- •Г рафическое определение Tк и Tз
- •Осмотическое давление. Методы разделения жидких смесей мембранными методами
- •4. Электрохимия
- •4.1. Термодинамика растворов сильных электролитов
- •4.2. Электростатическая теория растворов сильных электролитов
- •4.3. Равновесие в растворах слабых электролитов
- •4.4. Электропроводность растворов электролитов.
- •4.5. Зависимость молярНой электропроводностИ электролитов от их концентрации в растворе
- •4.6. Электродвижущие силы и электродные потенциалы
- •4.6.1. Механизм возникновения электродных потенциаЛов. Уравнение нернста
- •4.6.2. Гальванические элементы
- •4.9.3. Основные типы электродов и расчет их потенциала
- •4.9.5. Потенциометрия
- •5. Химическая кинетика и катализ
- •5.1. Основные понятия и определения
- •5.2. Основной закон химической кинетики. Молекулярность и порядок реакции
- •Основы формальной кинетики.
- •5.3. Кинетика необратимых реакций
- •5.4. Методы определения порядка реакции
- •5.5. Влияние температуры на скорость реакции
- •5.6. Основные понятия катализа
- •5.6.1. Гомогенный катализ
- •5.6.2. Гетерогенный катализ
ЛЕКЦИЯ 1
Введение
Любые химические реакции сопровождаются рядом физических явлений: нагреванием или охлаждением, повышением или понижением давления, теплопередачей, поглощением или выделением теплоты, света, электрическими явлениями, изменением объема и т.д. Эти явления сильно влияют на характер реакции. Например, синтез аммиака ведется при высоком давлении в присутствии катализатора согласно реакции:
![]() (1)
(1)
Если реакцию
осуществить при давлении 850 атм., то
содержание
![]() в равновесной смеси составит около 30
%, а при 1700 атм. выход аммиака увеличится
до 50 %. То есть, при изменении одного
только давления можно повысить выход
конечного продукта почти вдвое.
в равновесной смеси составит около 30
%, а при 1700 атм. выход аммиака увеличится
до 50 %. То есть, при изменении одного
только давления можно повысить выход
конечного продукта почти вдвое.
Согласно правилу
Вант-Гоффа,
при увеличении
температуры на 10
![]() ,
скорость реакции возрастает в 2 – 4 раза.
Таким образом, с помощью изменения
различных физических параметров можно
управлять процессом.
,
скорость реакции возрастает в 2 – 4 раза.
Таким образом, с помощью изменения
различных физических параметров можно
управлять процессом.
Таким образом, физическая химия – это наука о взаимосвязи физических и химических явлений.
Физическая химия явилась родоначальницей ряда самостоятельных наук: коллоидной химии, физической химии ВМС, строения вещества и т.д.
В содержание курса физической химии входят следующие разделы:
Химическая термодинамика;
Растворы и гетерогенные равновесия;
Химическое равновесие;
Электрохимия;
Химическая кинетика и катализ.
1. Основы химической термодинамики
1.1. Основные понятия и определения термодинамики
Термодинамика – наука о взаимном превращении одних видов энергии в другие.
В основу термодинамики как науки положены законы (начала) термодинамики. Они носят эмпирический характер.
Химическая термодинамика – раздел ФХ, в котором термодинамические методы используют для анализа химических и физико-химических процессов: химических реакций, фазовых переходов (испарения, кристаллизации и др.), явлений в растворах и т.п.
Энергия – мера движения в системе. Основными формами передачи энергии от одного тела (системы) к другому являются:
теплота (Q);
работа (А).
При этом теплота связана с беспорядочным перемещением больших количеств микрочастиц (молекул), а работа – с их направленным движением.
Внутренняя энергия системы (тела) – совокупность всех видов энергий, присущих данному телу или совокупности тел (системе).
![]() ,
(2)
,
(2)
где
![]() – энергия
– энергия
![]() –го
вида движения, суммирование проводится
по всем видам энергии (поступательного,
колебательного, вращательного движения,
энергии электронных переходов и т. д.)
–го
вида движения, суммирование проводится
по всем видам энергии (поступательного,
колебательного, вращательного движения,
энергии электронных переходов и т. д.)
Объектом исследования термодинамики является термодинамическая система – это тело или совокупность тел, мысленно ограниченных от окружающей среды. Все то, что окружает систему – внешняя, или окружающая среда.
По способности взаимодействовать с внешней средой системы подразделяют: открытые; закрытые; изолированные.
Открытые системы могут обмениваться с окружающей средой теплом и массой (все открытые реакторы; явления, протекающие в природе).
Закрытые системы могут обмениваться с окружающей средой теплом, но не могут массой (все закрытые реакторы).
В адиабатных системах отсутствует теплообмен с окружающей средой.
Изолированные системы не могут обмениваться с окружающей средой ни теплом, ни массой (термос).
Состояние системы характеризуют термодинамические параметры состояния. Все параметры состояния можно подразделить на две группы:
Внешние параметры – параметры, которые оказывают воздействие на всю систему. Например, давление, объем и температура, напряженность электрического поля (если система помещена в электромагнитное поле);
Внутренние параметры – параметры, не зависящие от общего объема и массы системы. Например, концентрация веществ, входящих в систему.
Термодинамические параметры делят на экстенсивные и интенсивные.
Экстенсивные параметры (свойства) пропорциональны массе системы. Например, объем, площадь поверхности.
Интенсивные параметры (свойства) не зависят от массы системы. Например, температура, давление, плотность, концентрации компонентов, поверхностное натяжение.
Уравнение, связывающее параметры состояния термодинамической системы, называют уравнением состояния данной системы. Например, уравнение Менделеева – Клапейрона:
![]() ,
(3)
,
(3)
где
![]() – число моль идеального газа;
– число моль идеального газа;
![]() – универсальная
газовая постоянная (8,31
– универсальная
газовая постоянная (8,31
![]() ).
).
Процесс – любое изменение в системе, приводящее к изменению хотя бы одного из параметров ее состояния.
Если в результате протекшего процесса система возвращается в исходное состояние, то процесс называют круговым (циклическим или просто циклом).
В термодинамике состояние системы кроме параметров состояния принято характеризовать и функциями состояния, зависящими от параметров состояния системы. Процессы, протекающие в системе, характеризуют с помощью изменения термодинамических функций состояния.
Любая термодинамическая функция состояния обладает рядом важных свойств, вытекающих из математических представлений:
свойство аддитивности – величина термодинамической функции для всей системы складывается из величин этой функции для отдельных ее частей;
изменение любой функции состояния определяется только исходным и конечным состояниями системы и не зависит от пути перехода этой системы из исходного состояния в конечное. Это означает, что любое бесконечно малое приращение функции состояния обладает свойствами полного дифференциала (
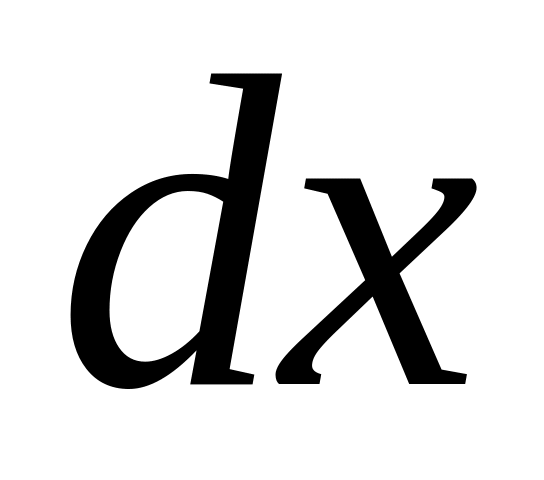 будет полным дифференциалом, когда
будет полным дифференциалом, когда
 ).
).
Если хотя бы одно из этих свойств не соблюдается, то данная функция не является функцией состояния и характеризовать систему с ее помощью нельзя.
