
- •Введение
- •1. Основы химической термодинамики
- •1.1. Основные понятия и определения термодинамики
- •1.2. I закон термодинамики
- •1.3. Внутренняя энергия как термодинамическая функция состояния системы
- •1.4. Применение I закона термодинамики к анализу некоторых термодинамических процессов
- •1.5. Теплоемкость
- •1.6. Термохимия
- •1.6.1. Влияние температуры на тепловые эффекты химических реакций и других процессов
- •1.7. II закон термодинамики
- •1.7.1. Математическое выражение II закона термодинамики
- •1.7.2. Энтропия и направление самопроизвольного протекания процессов в изолированных системах
- •1.7.3. Расчет энтропии для различных термодинамических систем и процессов
- •1.8. Взаимосвязь энтропии и термодинамической вероятности
- •1.9. Термодинамические потенциалы и направление самопроизвольных процессов. Условие термодинамического равновесия в системе
- •Взаимосвязь энергии гельмгольца с другими термодинамическими функциями и параметрами состояния системы
- •Взаимосвязь энергии гиббса с другими термодинамическими функциями и параметрами состояния системы
- •1.9. Третий закон термодинамики
- •2. Химическое равновесие
- •2.1. Понятие о химическом потенциале
- •2.2. Химический потенциал индивидуального вещества и компонента раствора
- •1. Идеальные системы
- •2. Реальные системы
- •2.3. Способы выбора стандартного состояния
- •2.4. Условие химического равновесиЯ
- •2.5. Константы химического равновесия. Закон действующих масс
- •2.6. Уравнение изотермы химической реакции. Химическое сродство
- •2.7. Влияние температуры на константу химического равновесия (уравнения изобары и изохоры химической реакции)
- •2.8. Влияние давления на константу химического равновесия (уравнение планка)
- •2.9. Энтропийный метод расчета константы химического равновесия
- •3. Термодинамика растворов и гетерогенные (фазовые) равновесия
- •3.1. Основные понятия и определения
- •3.2. Условие термодинамического равновесия в гомогенных растворах
- •3.2.1. Термодинамика идеальных растворов
- •3.2.2. Термодинамика реальных растворов
- •3.3. Равновесие в гетерогенных системах.
- •3.3.1. Теорема равновесия гиббса
- •3.3.2. Правило фаз гиббса
- •3.3.3. Применение правила фаз гиббса к анализу структуры диаграмм состояния гетерогенных систем
- •3.3.4. Уравнение состояния однокомпонентной двухфазной системы (уравнение кЛаузиуса – клапейрона)
- •3.3.5. Примеры гетерогенных (фазовых) равновесий а. Фазовое равновесие жидкость – пар
- •Растворимость газов в жидкостях (закон генри)
- •Б. Фазовое равновесие жидкость – жидкость диаграммы взаимной растворимости жидкостей в ТройныХ системАх
- •Основные типы диаграмм взаимной растворимости тройных систем
- •Распределение вещества между двумя соприкасающимися, но несмешивающимися растворителями (Закон распределения Нернста)
- •Экстракция
- •В. Фазовое равновесие жидкость – твердое вещество растворимость твердых веществ в жидкостях (закон шредера)
- •3.3.6. Коллигативные свойства растворов
- •Понижение давления пара над раствором по сравнению с чистым растворителем
- •Повышение температуры кипения и понижение температуры замерзания растворов
- •Определение молекулярной массы раствореного вещества
- •Г рафическое определение Tк и Tз
- •Осмотическое давление. Методы разделения жидких смесей мембранными методами
- •4. Электрохимия
- •4.1. Термодинамика растворов сильных электролитов
- •4.2. Электростатическая теория растворов сильных электролитов
- •4.3. Равновесие в растворах слабых электролитов
- •4.4. Электропроводность растворов электролитов.
- •4.5. Зависимость молярНой электропроводностИ электролитов от их концентрации в растворе
- •4.6. Электродвижущие силы и электродные потенциалы
- •4.6.1. Механизм возникновения электродных потенциаЛов. Уравнение нернста
- •4.6.2. Гальванические элементы
- •4.9.3. Основные типы электродов и расчет их потенциала
- •4.9.5. Потенциометрия
- •5. Химическая кинетика и катализ
- •5.1. Основные понятия и определения
- •5.2. Основной закон химической кинетики. Молекулярность и порядок реакции
- •Основы формальной кинетики.
- •5.3. Кинетика необратимых реакций
- •5.4. Методы определения порядка реакции
- •5.5. Влияние температуры на скорость реакции
- •5.6. Основные понятия катализа
- •5.6.1. Гомогенный катализ
- •5.6.2. Гетерогенный катализ
1.8. Взаимосвязь энтропии и термодинамической вероятности
В классической термодинамике состояние термодинамических систем описывается с помощью небольшого числа макроскопических параметров ( , , , ), доступных непосредственному измерению. Указанные параметры характеризуют макроскопическое состояние системы. Так как система состоит из микрочастиц, то макроскопические параметры обладают статистической природой и характеризуют средние свойства большого числа микрочастиц.
В статистической
термодинамике микросостояние
термодинамических систем характеризуют
микроскопическими параметрами –
координатами молекул (![]() ,
,
![]() ,
,
![]() ),
определяющими их положение в пространстве,
и импульсами движения молекул
),
определяющими их положение в пространстве,
и импульсами движения молекул
![]() ,
характеризующими энергию их движения.
,
характеризующими энергию их движения.
Одно и тоже макросостояние системы может быть реализовано большим числом различных микросостояний.
Число микросостояний,
реализующих данное макросостояние
системы, Больцман назвал термодинамической
вероятностью
![]() .
Чем больше
,
тем вероятнее пребывание системы в
данном состоянии.
.
Чем больше
,
тем вероятнее пребывание системы в
данном состоянии.
В статистической термодинамике предполагают, что процесс, приближающий систему к состоянию равновесия, соответствует переходу от менее вероятного состояния к более вероятному. Процесс, удаляющий систему от состояния равновесия, с точки зрения статистической термодинамики не является невозможным, просто он менее вероятен.
Таким образом, самопроизвольные процессы в изолированных системах характеризуются увеличением, как ее энтропии, так и термодинамической вероятности системы. Связь между энтропией и термодинамической вероятностью выражается уравнением Больцмана:
![]() ,
(67)
,
(67)
где
![]() – постоянная Больцмана.
– постоянная Больцмана.
Уравнение Больцмана лежит в основе современной статистической термодинамики, связывает макро- и микропараметры системы и позволяет понять свойства энтропии как функции состояния.
При абсолютном
нуле температур в системе абсолютный
порядок (![]() )
и энтропия
)
и энтропия
![]() .
При нагревании системы возникает
тепловое движение, упорядоченность в
системе уменьшается, энтропия возрастает.
При смешивании упорядоченность в
системе может, как увеличиваться, так
и увеличиваться. Таким образом,
энтропия – мера беспорядка в системе.
.
При нагревании системы возникает
тепловое движение, упорядоченность в
системе уменьшается, энтропия возрастает.
При смешивании упорядоченность в
системе может, как увеличиваться, так
и увеличиваться. Таким образом,
энтропия – мера беспорядка в системе.
ЛЕКЦИЯ 5
1.9. Термодинамические потенциалы и направление самопроизвольных процессов. Условие термодинамического равновесия в системе
Термодинамическими потенциалам называют такие термодинамические функции состояния, убыль которых в обратимо протекающих процессах при постоянстве определенных параметров равна максимальной полезной работе процесса.
Для того, чтобы получить представление о термодинамических потенциалах воспользуемся совместным математическим выражением I и II законов термодинамики. Получим его:
![]() уравнение
I закона термодинамики
(6)
уравнение
I закона термодинамики
(6)
![]() или
или
![]() уравнение II закона
термодинамики (49)
уравнение II закона
термодинамики (49)
Из сравнения уравнений (6) и (49) следует:
![]() (68) для
обратимых и необратимых процессов
(68) для
обратимых и необратимых процессов
![]() (69) для обратимых
процессов полезная работа максимальна
(69) для обратимых
процессов полезная работа максимальна
![]() (70) для
обратимых и необратимых процессов, если
единственной работой процесса является
работа расширения
(70) для
обратимых и необратимых процессов, если
единственной работой процесса является
работа расширения
![]() (71) для
обратимых процессов, если единственной
работой процесса является работа
расширения
(71) для
обратимых процессов, если единственной
работой процесса является работа
расширения
Известно, что
![]() .
Продифференцируем уравнение и решим
его относительно
,
получим:
.
Продифференцируем уравнение и решим
его относительно
,
получим:
![]() .
.
Подставим в уравнения (68) – (71) вместо его значение, получим:
![]() (72) для
обратимых и необратимых процессов
(72) для
обратимых и необратимых процессов
![]() (73) для
обратимых процессов полезная работа
максимальна
(73) для
обратимых процессов полезная работа
максимальна
![]() (74) для
обратимых и необратимых процессов, если
единственной работой процесса является
работа расширения
(74) для
обратимых и необратимых процессов, если
единственной работой процесса является
работа расширения
![]() (75) для
обратимых процессов, если единственной
работой процесса является работа
расширения
(75) для
обратимых процессов, если единственной
работой процесса является работа
расширения
Воспользуемся выражениями (68) – (75) для анализа некоторых термодинамических процессов.
 (изохорно-изоэнтропийный
процесс)
(изохорно-изоэнтропийный
процесс)
Рассмотрим процесс, единственным результатом которого является работа расширения. Из выражения (70) имеем:
![]() ;
;
![]() .
.
Знак неравенства относится к самопроизвольно протекающему (необратимому) изохорно-изоэнтропийному процессу, знак равенства характеризует термодинамическое равновесие.
Таким образом,
получили, что выражение
![]() (
(![]() ),
т.е. убыль внутренней энергии системы,
характеризует условие самопроизвольного
протекания изохорно-изоэнтропийного
процесса. Как только внутренняя энергия
достигает своего минимального значения
устанавливается термодинамическое
равновесие. Условие минимума внутренней
энергии системы при
),
т.е. убыль внутренней энергии системы,
характеризует условие самопроизвольного
протекания изохорно-изоэнтропийного
процесса. Как только внутренняя энергия
достигает своего минимального значения
устанавливается термодинамическое
равновесие. Условие минимума внутренней
энергии системы при
![]() :
:
![]() .
.
Из уравнения (69) получаем:
![]() ;
;
![]() .
.
Как видим, уменьшение внутренней энергии системы в изохорно-изоэнтропийном процессе характеризует максимальную работу этого процесса.
Таким образом, внутренняя энергия является изохорно-изоэнтропийным термодинамическим потенциалом.
 (изобарно-изоэнтропийный
процесс)
(изобарно-изоэнтропийный
процесс)
Из выражения (74) имеем:
![]() ;
;
![]() .
.
Знак неравенства характеризует условие самопроизвольного протекания (необратимого) изохорно-изоэнтропийного процесса. Как видно, таким условием является уменьшение энтальпии системы.
![]() (
(![]() ).
).
При установившемся термодинамическом равновесии в системе при энтальпия системы минимальна. Условие минимума функции:
![]() .
.
Используем теперь для анализа обратимого изобарно-изоэнтропийному процесса уравнение (73), которое перепишется в виде:
![]() ;
;
![]() .
.
Как видим, уменьшение энтальпии системы в изобарно-изоэнтропийном процессе характеризует максимальную работу этого процесса.
Таким образом, энтальпия является изобарно-изоэнтропийным термодинамическим потенциалом.
Рассмотренные
процессы на практике реализуются крайне
редко. Поэтому материал имеет в большей
степени теоретическое, чем практическое
значение. Большинство же реальных
процессов, протекающих в природе,
технологии реализуются либо при
![]() ,
либо при
,
либо при
![]() .
Рассмотрим эти процессы.
.
Рассмотрим эти процессы.
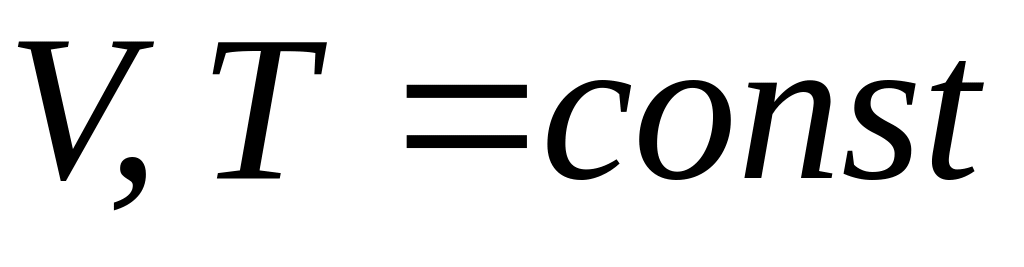 (изохорно-изотермический
процесс)
(изохорно-изотермический
процесс)
Для анализа воспользуемся выражением (70), тогда имеем:
![]() или
или
![]() ;
;
![]() .
.
Слева полный дифференциал, следовательно, изменение функции
![]() .
(76)
.
(76)
не
зависит от пути протекания процесса, а
определяется только начальным и конечным
состояниями системы. Кроме того, функция
аддитивная, так как составляющие ее
функции аддитивные. Следовательно,
функция
![]() обладает всеми свойствами термодинамической
функции состояния.
– функция (или энергия) Гельмгольца
(свободная энергия) – одна из важнейших
функций состояния.
обладает всеми свойствами термодинамической
функции состояния.
– функция (или энергия) Гельмгольца
(свободная энергия) – одна из важнейших
функций состояния.
![]() ;
;
![]() .
.
Знак неравенства характеризует условие самопроизвольного (необратимого) протекания изохорно-изотермического процесса. Как видно, таким условием является убыль энергии Гельмгольца.
При термодинамическом равновесии энергия Гельмгольца системы в изохорно-изотермических условиях минимальна. Условие минимума функции:
![]() .
.
Воспользуемся теперь уравнением (69) для анализа обратимого изохорно-изотермического процесса, получим:
![]() .
.
После интегрирования имеем:
![]() .
(77)
.
(77)
Как видим, уменьшение энергии Гельмгольца системы в изохорно-изотермическом процессе характеризует максимальную работу процесса.
Таким образом, энергия Гельмгольца является изохорно-изотермическим термодинамическим потенциалом.
Решим (76) относительно
![]() :
:
![]() ,
,
где – полная внутренняя энергия системы, складывается из 2 частей:
– свободная энергия – часть внутренней энергии, которая может быть превращена в работу (см. уравнение (77));
![]() – связанная энергия
– часть внутренней энергии, которая не
может быть превращена в работу. Она
обеспечивает существование самой
материальной системы.
– связанная энергия
– часть внутренней энергии, которая не
может быть превращена в работу. Она
обеспечивает существование самой
материальной системы.
