
- •Обработка результатов измерений
- •1. Химическая термодинамика
- •Лабораторная работа № 1.1
- •Калориметрия
- •Краткое теоретическое введение
- •Определение действительного изменения температуры в калориметрических опытах
- •Обработка полученных данных
- •Выполнение работы
- •Определение тепловой постоянной калориметра
- •Определение содержания кристаллизационной воды в CuSo4xH2o
- •Теплоты растворения 1 г соли в 50 мл воды CuSo4 xH2o и ZnSo4 xH2o
- •Пример расчёта
- •Вопросы для самопроверки
- •Лабораторная работа № 1.2 криометрия Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •Лабораторная работа № 1.3 определение термодинамических параметров реакций методом эдс Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •2. Химическая кинетика формальная кинетика Краткое теоретическое введение
- •2A продукты,
- •Экспериментальные методы определения скорости и порядка реакции
- •Лабораторная работа № 2.1 определение константы скорости инверсии сахарозы Теоретические основы работы
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •Лабораторная работа № 2.2 изучение кинетики окисления тиомочевины гексацианоферратом (III) в щелочном растворе Теоретические основы работы
- •Используемое оборудование
- •2. Технические данные
- •3. Узел светофильтров
- •1. Общие указания по эксплуатации
- •Измерение коэффициента пропускания или оптической плотности раствора
- •5. Выбор светофильтра
- •6. Выбор кюветы
- •7. Определение концентрации вещества в растворе
- •Последовательность выполнения работы
- •Вопросы для самопроверки
- •Лабораторная работа № 2.3 определение константы скорости иодирования ацетона Краткое теоретическое введение
- •Выполнение работы
- •Вопросы для самопроверки
- •Лабораторная работа № 2.4 определение константы скорости реакции омыления сложного эфира Теоретические основы работы
- •Выполнение работы
- •Задания
- •Вопросы для самопроверки
- •3.Электрохимия
- •Лабораторная работа № 3.1
- •Измерение электропроводности растворов электролитов
- •Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •3.1.1. Определение константы ячейки
- •3.1.2. Определение предельной электропроводности сильных электролитов
- •3.1.3. Определение предельной электропроводности слабых электролитов
- •3.1.4. Измерение константы диссоциации слабого электролита
- •Вопросы для самопроверки
- •Лабораторная работа № 3.2 числа переноса ионов. Кулонометрия Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •Лабораторная работа № 3.3 измерение электродвижущих сил и электродных потенциалов Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •3.3.1. Приготовление медного и цинкового электродов и определение их электродных потенциалов
- •3.3.2. Определение стандартного окислительно-восстановительного потенциала
- •3.3.3. Определение стандартных окислительно-восстановительных потенциалов методом потенциометрического титрования
- •Вопросы для самопроверки
- •Лабораторная работа № 3.4 водородный показатель. Буферные растворы Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •3.5.1. Калибровка стеклянного электрода и измерение рН раствора
- •3.5.2. Построение буферной диаграммы и определение буферной ёмкости
- •3.5.3. Потенциометрическое титрование слабого электролита
- •Вопросы для самопроверки
- •Лабораторная работа № 3.6 определение рН гидратообразования Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •Литература
Вопросы для самопроверки
1. Почему ЭДС, являясь мерой работы по обратимому переносу заряда по внешней цепи, выражает величину G реакции, идущей в гальваническом элементе?
2. Почему величина ЭДС зависит от температуры?
3. В каком случае ЭДС увеличивается с ростом температуры?
4. Выведите уравнения (1.9) – (1.13).
5. Почему термодинамические параметры реакции, проводимой по электрохимическому механизму, определённые методом ЭДС, применимы к реакции в любых условиях?
Задачи
1. Температурный коэффициент ЭДС элемента, в котором идёт двухэлектронная реакция, равен –3,710–4 ВК–1. Вычислить теплоту при обратимой работе элемента.
2. Элемент, образованный иодсеребряным и иодсвинцовым электродами, при 298 К имеет ЭДС, равную 0,2169 В. Температурный коэффициент ЭДС равен 1,3810–4 ВК–1. Изобразить схему элемента, записать уравнение реакции в элементе и рассчитать Е, G, Н, S и W при 310 К. Зависит ли величина Е от концентрации иодида в элементе? Почему?
3. Стандартная ЭДС элемента
Pt, H2 | HCl(p-p) | Hg2Cl2(тв) | Hg
при 20 С равна 0,2692 В, и 0,2660 В при 30 С. Запишите уравнение реакции в элементе, вычислите для неё G, Н, S , а также W при обратимой работе элемента.
2. Химическая кинетика формальная кинетика Краткое теоретическое введение
Если реагенты (или реагенты и катализатор) находятся в различных фазах, то реакция называется гетерогенной; Если же реакция протекает в одной фазе, то она называется гомогенной. Гомогенные реакции идут в объёме фазы, гетерогенные – на поверхности раздела фаз.
Скорость гомогенных реакций определяется изменением молярной концентрации с в единицу времени t и выражается как производная концентрации по времени для любого вещества, участвующего в реакции, как в качестве исходного компонента, так и в качестве продукта.
В общем случае скорость реакции, протекающей по уравнению
![]() ,
(2.А)
,
(2.А)
где
1,
2,
![]() ,
,
![]() – стехиометрические коэффициенты,
может быть представлена
несколькими выражениями:
– стехиометрические коэффициенты,
может быть представлена
несколькими выражениями:
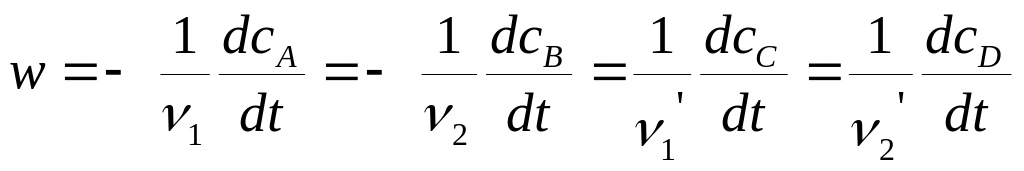 .
(2.1)
.
(2.1)
Исходные вещества расходуются, а продукты реакции образуются в эквивалентных количествах (соответственно стехиометрическим коэффициентам), поэтому при определении скорости реакции нет необходимости следить за изменением концентрации всех взаимодействующих веществ.
Скорость реакции можно определить и как производную степени полноты реакции (глубина ее протекания) по времени. Скорость реакции зависит от природы реагирующих веществ, их концентрации, присутствия посторонних веществ (например, катализаторов) и их концентрации. На скорость реакции влияют также среда, в которой протекает реакция, и условия протекания реакции: температура, давление (особенно для реакций с участием газов), облучение (фотохимические реакции) и т. п.
Основным законом химической кинетики является постулат, выражающий зависимость скорости реакции от концентрации реагирующих веществ. В соответствии с ним скорость реакции в каждый момент времени пропорциональна произведению возведенных в некоторую степень концентраций реагирующих веществ (закон действия масс). Так, для реакции (2.А) скорость, равная разности скоростей прямой и обратной реакций, может быть выражена кинетическим уравнением
![]() (2.2)
(2.2)
Коэффициенты пропорциональности k1 и k2 в уравнении (2.2) называются константой скорости реакции (прямой и обратной).
Когда k1 >> k2 , т.е. скорость обратной реакции ничтожно мала по сравнению со скоростью прямой, равновесие оказывается полностью сдвинутым вправо и уравнение (2.2) переходит в уравнение
![]() (2.3)
(2.3)
Из уравнений (2.2) и (2.3) видно, что скорость необратимой1 (односторонней) реакции зависит только от концентрации исходных веществ, в случае обратимой реакции (2.А) – от концентраций как исходных веществ. так и продуктов реакции.
Константа скорости k в уравнении (2.3) равняется скорости реакции при условии, что концентрации каждого из реагирующих веществ равны единице, поэтому её называют также удельной скоростью реакции. Такой физический смысл константы скорости указывает на то, что величина ее должна зависеть от всех факторов, которые влияют на скорость реакции, за исключением концентрации реагирующих веществ. Численное значение константы скорости зависит также от выбора единиц времени и концентрации. Размерность константы определяется тем кинетическим уравнением, по которому производится её расчет, т. е. зависит от порядка реакции.
Каждая реакция характеризуется порядком, а также её молекулярностью. Молекулярность реакции определяется числом частиц, участвующих в одном элементарном акте химического превращения. При этом число молекул продуктов процесса не имеет значения. В зависимости от этого различают реакции: 1) мономолекулярные, 2) бимолекулярные, 3) тримолекулярные.
Порядок реакции определяется показателем степени при концентрации в кинетическом уравнении реакции. Если порядок равен единице, то реакцию называют реакцией первого порядка, если двум – второго порядка, если трём – третьего порядка. В зависимости от порядка реакции кинетические уравнения для расчета константы скорости реакции различны.
Порядок реакции является чисто эмпирической величиной. Только для элементарной реакции, протекающей в один этап, он равен её молекулярности, так как стехиометрическое уравнение правильно отражает истинный механизм лишь такой реакции. Различают полный и частный порядок реакции. Каждый из показателей степени при концентрациях в дифференциальном уравнении скорости выражает частный порядок по данному веществу. Сумма показателей степени при концентрациях определяет полный (суммарный) порядок реакции.
Протекание реакции сложным путем, в несколько стадий, является одной из причин расхождения между молекулярностью и порядком реакции. Другой причиной расхождения может быть значительный избыток одного из реагентов в реакционной смеси. Тогда концентрация этого реагента остаётся практически постоянной в ходе реакции, а порядок реакции будет меньше, чем определяемый по стехиометрическому уравнению. Например, такие бимолекулярные реакции, как инверсия тростникового сахара или гидролиз уксусного ангидрида оказываются кинетически реакциями первого порядка, так как концентрацию воды здесь можно считать неизменной. Подобного рода реакции иногда называют псевдомономолекулярными. Порядок реакции зависит от условий её протекания. Его можно изменить, например, варьированием концентрации или давления.
Кинетическая классификация реакций. В химической кинетике реакции разделяют по следующим признакам:
По числу частиц, участвующих в реакции (молекулярность и порядок реакции);
По природе частиц, участвующих в элементарном акте реакции. Реакции, в которых участвуют молекулы, относятся к группе молекулярных реакций; реакции с участием атомов или свободных радикалов – к группе цепных реакций; реакции с участием ионов – к группе ионных реакций;
По числу фаз, участвующих в реакции. Реакции, протекающие в одной фазе, называют гомогенными. Реакции, протекающие на поверхности или у поверхности раздела фаз, называют гетерогенными;
По использованию катализаторов: каталитические, автокаталитические и некаталитические;
По степени сложности (по механизму протекания): a) обратимые и необратимые; б) изолированные и параллельные; в) последовательные; г) сопряжённые.
Большинство реакций моно- и бимолекулярные. Вероятность одновременного столкновения большего числа молекул определённого вида ничтожно мала; поэтому даже тримолекулярные реакции немногочисленны. По числу стадий реакции делятся на простые и сложные. Простая (элементарная) реакция состоит из однотипных элементарных актов. В простой химической реакции реагенты непосредственно превращаются в конечные продукты без образования промежуточных веществ. Простая реакция протекает без участия катализатора и не тормозится ингибиторами. Для простой реакции, как правило, существует лишь одно переходное состояние.
Сложная (многостадийная) реакция состоит из нескольких (иногда большого числа) простых реакций – элементарных стадий, связанных друг с другом через реагенты или продукты. Часто продукт одной стадии служит реагентом для других стадий, являясь промежуточным продуктом. Если промежуточный продукт очень быстро подвергается последующим превращениям, то он является лабильным продуктом и обычно присутствует в системах в весьма низкой квазистационарной концентрации.
Следовательно, если стехиометрические коэффициенты в уравнении химической реакции велики, то реакция протекает в несколько стадий и общая скорость реакции определяется скоростью самой медленной из них.
В зависимости от уравнения, связывающего скорость реакция с концентрацией реагирующих веществ, различают реакции первого порядка (сумма показателей степени в уравнении (2.3) равна 1), второго порядка и т.д. Порядок реакции может быть отрицательным, нулевым, дробным. Если порядок реакции не целочисленный и не равен молекулярности реакции, то изучаемая реакция относится к сложным.
Реакция первого порядка схематически может быть представлена уравнением
A → B (возможно образование нескольких продуктов).
Её скорость определяется дифференциальным уравнением
![]() , (2.4)
, (2.4)
которое после интегрирования даёт
 , (2.5)
, (2.5)
а
период
полураспада
определяется как
![]() ,
где
,
где
![]() –
начальная концентрация вещества А,
–
начальная концентрация вещества А,
![]() – концентрация прореагировавшего
вещества А за истекший промежуток
времени;
– концентрация прореагировавшего
вещества А за истекший промежуток
времени;
![]() – концентрация вещества А в данный
момент времени;
– концентрация вещества А в данный
момент времени;
![]() – степень превращения; k
– константа
скорости реакции.
– степень превращения; k
– константа
скорости реакции.
Из уравнения (2.5) следует, что размерность константы скорости для реакции первого порядка – обратное время [t–1]; для превращения данной части вещества требуется одинаковое время, независимо от исходной концентрации, т. е. в единицу времени превращению подвергнется одна и та же часть вещества. Примером реакций первого порядка служат радиоактивный распад, разложение простых эфиров при высоких температурах, процессы изомеризации.
Реакция второго порядка может быть представлена уравнением
А + В продукт (продукты) реакции
Её скорость в соответствии с уравнением (2.3) может быть выражена следующим уравнением:
![]() (2.6)
(2.6)
или, после интегрирования:
 (2.7)
(2.7)
Если
![]() ,
то выражение для константы скорости
примет вид:
,
то выражение для константы скорости
примет вид:
![]() и
и
 (2.8)
(2.8)
Если реакцию второго порядка схематически представить как
