
- •Глава 1. История, предмет и задачи радиохимии
- •1.1 История радиохимии
- •1.2 Предмет и задачи радиохимии
- •1.3 Особенности радиохимии
- •1.4 Значение радиохимии
- •1.5 Радиохимия и экология
- •Глава 2. Физические основы радиохимии
- •2.1 Элементарные частицы
- •2.2 Протонно-нейтронный состав ядер
- •2.3 Свойства атомного ядра
- •2.3.1 Заряд, число нуклонов и масса ядра
- •2.3.2 Размеры ядер
- •2.3.3 Изотопы, изобары, изотоны
- •2.4 Энергия ядра
- •2.4.1 Энергия покоя
- •2.4.2 Энергия связи ядра
- •2.5 Устойчивость ядер
- •2.6 Ядерные силы
- •2.7 Ядерные модели
- •2.7.1 Капельная модель
- •2.7.2 Модель ферми-газа
- •2.7.3 Оболочечная модель
- •Вопросы
- •Глава 3. Радиоактивность
- •3.1 Законы радиоактивного распада
- •3.2 Абсолютная радиоактивность
- •3.3 Период полураспада
- •3.4 Радиоактивное равновесие
- •3.5 Радиоактивные семейства
- •Вопросы
- •Глава 4. Типы ядерных превращений
- •4.1 Альфа - распад
- •4.2 Бета - распад
- •4.3 Гамма - излучение ядер (изомерный переход)
- •4.4 Спонтанное деление
- •4.5 Испускание запаздывающего протона
- •4.6 Испускание запаздывающего нейтрона
- •Вопросы
- •Глава 5. Взаимодействие ядерного излучения с веществом
- •5.1 Взаимодействие альфа – частиц с веществом
- •5.2 Взаимодействие электронов с веществом
- •5.2.1 Ионизационные потери
- •5.2.2 Тормозное излучение (радиационные потери)
- •5.2.3 Излучение вавилова – черенкова
- •5.2.4 Электронно–позитронная аннигиляция
- •5.2.5 Пробеги электронов в веществе
- •5.3 Взаимодействие гамма – квантов с веществом
- •5.3.1 Фотоэффект (фотоэлектрическое поглощение)
- •5.3.2 Комптоновское рассеяние
- •5.3.3 Образование электрон-позитронной пары
- •5.3.4 Когерентное рассеяние
- •5.3.5 Ослабление гамма-излучения в веществе
- •5.4 Взаимодействие нейтронов с веществом
- •Вопросы
- •ГлАва 6. Радиационная химия
- •6.1 Количественные характеристики радиационно –химических превращений
- •6.2 Основные виды радиационно-химических превращений
- •6.3 Радиационная химия воды и водных растворов
- •6.3.1 Выходы продуктов радиолиза воды
- •6.4 Действие ионизирующих излучений на органические вещества
- •6.5 Радиолиз водных растворов днк ( дезоксирибонуклеиновая кислота)
- •6.6 Радиолиз водных растворов белков
- •6.7 Радиационная стойкость материалов
- •6.7.1 Радиационная стойкость некоторых материалов ядерной энергетики
- •6.8 Радиационно- химические технологии
- •Глава 7. Получение радионуклидов. Ядерные реакции
- •7.1 Ядерные реакции
- •7.2 Механизм ядерных реакций
- •2. Закон сохранения числа нуклонов.
- •7.3 Основные характеристики ядерных реакций
- •7.3.1 Выход ядерной реакции
- •7.3.2 Эффективное сечение ядерных реакций
- •7.4 Классификация ядерных реакций
- •7.5 Ядерные реакции и образование радионуклидов в природе
- •7.6 Получение радионуклидов по ядерным реакциям
- •7.6.1 Реакции, при которых заряд ядра z не меняется
- •7.6.4 Получение радионуклидов из продуктов распада урана и тория
- •Вопросы
- •Глава 8. Особенности поведения радиоактивных веществ в ультраразбавленных растворов
- •8.1 Коллоидообразование
- •8.2 Адсорбция
- •Вопросы
- •Глава 9. Методы выделения, разделения и концентрирования радиоактивных изотопов
- •9.1 Соосаждение
- •9.1.1 Количественная теория соосаждения
- •9.2 Экстракция
- •9.2.1 Виды экстракционных равновесий
- •9.2.2 Константа и коэффициент распределения
- •9.2.3 Достоинствами экстракционных методов являются
- •9.3 Хроматография
- •9.3.1 Ионообменная хроматография
- •9.3.2 Распределительная хроматография
- •9.3.3 Осадочная хроматография
- •9.4Электрохимические методы
- •9.4.1 Метод без применения внешней эдс (бестоковое осаждение, цементация)
- •9.4.2 Метод с применением внешней эдс ( электролиз)
- •9.4.3 Разделение изотопов методом электромиграции (электрофорез)
- •9.5 Метод сциларда – чалмерса (эффект отдачи)
- •9.6 Другие методы
- •Глава 10. Химия радиоактивных элементов
- •10.1 Технеций (экамарганец) 43Tc
- •10.2 Прометий –
- •10.3 Полоний
- •10.4 Астат (85At)
- •10.5 Радон (86Rn)
- •10.6 Франций ( 87Fr)
- •10.7 Радий (88Ra)
- •10.8 Актиноиды (89Ас, 90Th, 91Pa, 92u, 93Np, 94Pu, 95Am, 96Cm, 97Bк, 98Cf, 99Es, 100Fm, 101Md, 102No, 103Lr)
- •10.8.1 Общие свойства актиноидов
- •10.8.2 Актиний (89Ас)
- •10.8.3 Торий (90th)
- •10.8.5 Уран (92u)
- •10.9 Трансурановые элементы ( 93Np, 94Pu, 95Am)
- •10.9.1 Общие свойства трансурановых элементов
- •10.9.2 Нептуний 93Np
- •10.9.3 Плутоний (94pu)
- •10.9.4 Америций (95am )
- •10.10 Трансамерициевые актиноиды (96Cm, 97Bк, 98Cf, 99Es, 100Fm, 101Md, 102No, 103Lr)
- •10.10.1 Общие свойства трансамерициевыех актиноидов
- •10.10.1 Кюрий(96Cm)
- •10.10.2 Берклий ( 97Bk)
- •10.10.3 Калифорний (98Cf)
- •10.10.4 Эйнштейний (99Es)
- •10.10. 5 Фе́рмий (100Fm)
- •10.10.6 Менделевий 101Md
- •10.11 Трансактиноидные элементы (104Rf, 105Db, 106Sb, 107Bh, 108Hs, 109Mt, 110Ds, 111Rg, 112-118)
- •10.11.1 Общие свойства трансактиноидных элементов
- •10.11.2 Резерфордий (104Rf до 1974 г. Курчатовий)
- •10.11.3 Дубний (нильсборий, ганий)
- •Глава 11. Химия радиоактивных элементов
- •11.1 Технеций (экамарганец) 43tc
- •11.2 Прометий –
- •11.3 Полоний
- •11.4 Астат
- •11.5 Радон (86Rn)
- •11.6 Франций ( 87Fr)
- •11.7 Радий (88Ra)
- •11.8 Актиний ( 89Ас) и актиноиды
- •11.9 Торий (90Th)
- •11.10 Протактиний 91Pa
- •11.11 Уран
- •11.12 Трансурановые элементы
- •11.13 Трансамерициевые актиноиды (96Cm, 97Bк, 98Cf, 99Es, 100Fm, 101Md, 102No, 103Lr)
- •11.14 Трансактиноиды
- •Глава 12. Химия радиоактивных элементов
- •12.1 Технеций (экамарганец) 43Tc
- •12.2 Прометий –
- •12.3 Полоний
- •12.4 Астат
- •12.5 Радон ( 86Rn)
- •12.6 Франций( 87Fr)
- •12.7 Радий (88Ra)
- •12.8 Актиний ( 89Ас) и актиноиды
- •12.8.1 Общие свойства актиноидов
- •Глава 13. Некоторые вопросы прикладной радиохимии
- •14.1 Получение ядерной энергии
- •Приложение
9.3.1 Ионообменная хроматография
Механизмом элементарного акта ионообменной хроматографии является гетерогенный обратимый стехиометрический обмен между ионами в растворе и неподвижными ионами, находящимися в твердой фазе.
При ионообменной хроматографии сорбентами служат ионообменники (иониты) - вещества, которые имеют в своем составе катионы или анионы, способные к обмену в растворе с другими катионами и анионами.
В качестве ионообменников могут служить естественные минералы или синтетические органические полимерные вещества.
Обменная способность органических ионообменников значительно выше, чем неорганических.
Важнейшие ионообменные смолы, это продукты сополимеризации стирола.
Такой полимер образует матрицу ионита. В процессе синтеза или после него в сополимер вводят функциональные группы, содержащие ионы, способные к обмену. Такие группы называются обменными. Если сополимер содержит группы SO3Н, СООН, ОН, то он проявляет свойства катионообменника (катионита). Наличие групп N(CH3)2, NH2CH3 придает сополимеру свойства анионообменника. Способность ионита к обмену определяется степенью диссоциации обменных групп, которая зависит как от химической природы групп, так и от свойств раствора.
Важнейшими физико – химическими характеристиками ионообменных смол являются обменная емкость и набухаемость.
Обменная емкость - это мера способности ионита поглощать ион из раствора. Полная обменная емкость ионита (ПОЕ) определяется максимальным числом миллиграмм – эквивалентов ионов, которые могут быть поглощены 1г воздушно – сухого ионита.
Набухаемость характеризует изменение удельного объема ионита при погружении в раствор, а также при изменении состава и концентрации раствора.
Важной характеристикой хроматографического процесса является коэффициент распределения Кр, равный отношению равновесных концентраций исследуемого элемента в ионите и в растворе:
Кр = ![]() , (8.14)
, (8.14)
где Си – равновесные концентрации в ионите;
Ср – равновесные концентрации в растворе.
Отношение коэффициента распределения обменивающихся ионов называется коэффициентом разделения:
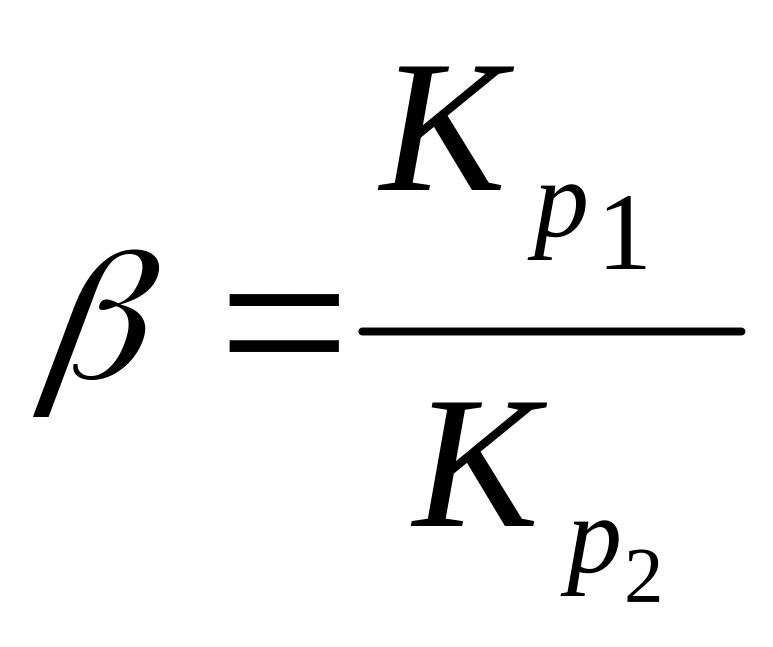 (8.15)
(8.15)
Значение Кр используют для выбора оптимальных условий разделения радиоактивных элементов (ионов). Чем больше отношение коэффициента распределения двух элементов (т.е., чем выше коэффициент разделения, тем полнее разделение).
Эффективность разделения методом ионообменной хроматографии, в отсутствие комплексообразующих агентов, зависит от химической природы разделяемых ионов и условий разделения.
Эффективность ионообменных разделений в равновесных условиях возрастает с увеличением числа элементарных актов.
Если в качестве элюэнта используются комплексообразующие агенты, например ЭДТА, эффективность разделения элементов в этом случае обусловлена избирательностью их связывания в непоглощаемый ионитом комплексный ион.
В радиохимии для определения Кр вместо концентраций используют удельные радиоактивности:
Кр![]() , (8.16)
, (8.16)
где Io и Ip – начальная и равновесная удельная радиоактивности раствора,
V – общий объем используемого раствора,
m – навеска сухого ионита.
Кроме ионообменной хроматографии, для разделения радиоактивных элементов используют также распределительную и осадочную хроматографию.
